IL-1β表达与食管鳞状细胞癌患者临床病理参数关系的分析
周 剑, 冯 晨, 郑树涛, 刘 清, 刘 涛, 谭豆豆, 马 蓉, 陈玉梅, 卢晓梅
(新疆医科大学1附属肿瘤医院, 2临床医学研究院, 乌鲁木齐 830011; 2乌鲁木齐市友谊医院病理科, 乌鲁木齐 830000)
肿瘤微环境中释放的炎性细胞因子与食管癌的发生、发展密切相关。研究发现,炎性细胞因子的数量增加,促进肿瘤细胞浸润及肿瘤血管形成,从而促进肿瘤进展[1-2]。白细胞介素1-β(IL-1β)是一种重要的炎性细胞因子,IL-1β在促炎细胞因子的信号转导通路中起着至关重要的作用[3-4]。此外,多种肿瘤中均发现IL-1β表达增加,IL-1β表达的增加与肿瘤细胞的进展与转移有关[5-6]。尽管IL-1β在多种恶性肿瘤中扮演着重要作用,但IL-1β与食管鳞状细胞癌的预后及临床病理参数的相关性仍不清楚,本研究通过免疫组织化学染色探讨IL-1β与食管鳞状细胞癌(ESCC)患者预后的相关性及与ESCC患者淋巴结转移、临床分期等重要临床病理指标的相关性。
1 材料与方法
1.1临床病理标本ESCC组织标本30例,癌旁组织(距病灶3 cm以外)30例作为阴性对照,组织标本均来自新疆医科大学一附医院2000~2008年间手术切除并通过病理检查证实的ESCC及癌旁组织。30例ESCC组织标本中,男性20例,女性10例,年龄41~79岁,中位年龄58岁。病理分级Ⅰ级4例,Ⅱ级13例,Ⅲ级13例,根据美国癌症联合会(AJCC)2009年第7版TNM分期标准,T分期包括T1+T2期12例,T3+T4期18例,有淋巴结转移病例20例,无淋巴结转移病例10例。
1.2主要抗体和试剂兔抗IL-1β多克隆抗体(浓缩型1∶200)、PV-9000试剂盒、DAB显色试剂盒均为北京中杉金桥生物技术公司产品。
1.3免疫组织化学染色和结果判定食管癌组织芯片常规脱蜡,采用0.01 mol/L的枸橼酸钠缓冲液微波加热修复抗原。免疫组化二步法操作步骤参照试剂盒说明书进行。以磷酸盐缓冲液取代一抗作为空白对照,用已知的阳性组织切片作为阳性对照。IL-1β表达于胞质和胞膜,呈现黄褐色或棕褐色颗粒为染色阳性。在低倍镜 (×100) 下观察整张切片,随机选择4个高倍视野 (×400) 计数阳性细胞,所有切片在1个月后重复计数,取2次计数的平均值作为该样本表达的最终结果。
1.4统计学处理采用SPSS 19.0 软件对数据进行分析,食管癌组织和癌旁组织IL-1β阳性表达细胞密度的比较及IL-1β与ESCC患者临床病理参数的比较采用χ2检验;单因素生存率分析用Kaplan-Meier检验,以P<0.05为差异有统计学意义。
2 结果
2.1食管癌组织与癌旁组织中IL-1β浸润密度比较食管癌组织IL-1β阳性表达细胞的中位数为32.6个/高倍视野,癌旁组织为5.3个/高倍视野,食管癌组织IL-1β阳性表达细胞密度明显高于癌旁组织 (图1),差异有统计学意义(P<0.01)。
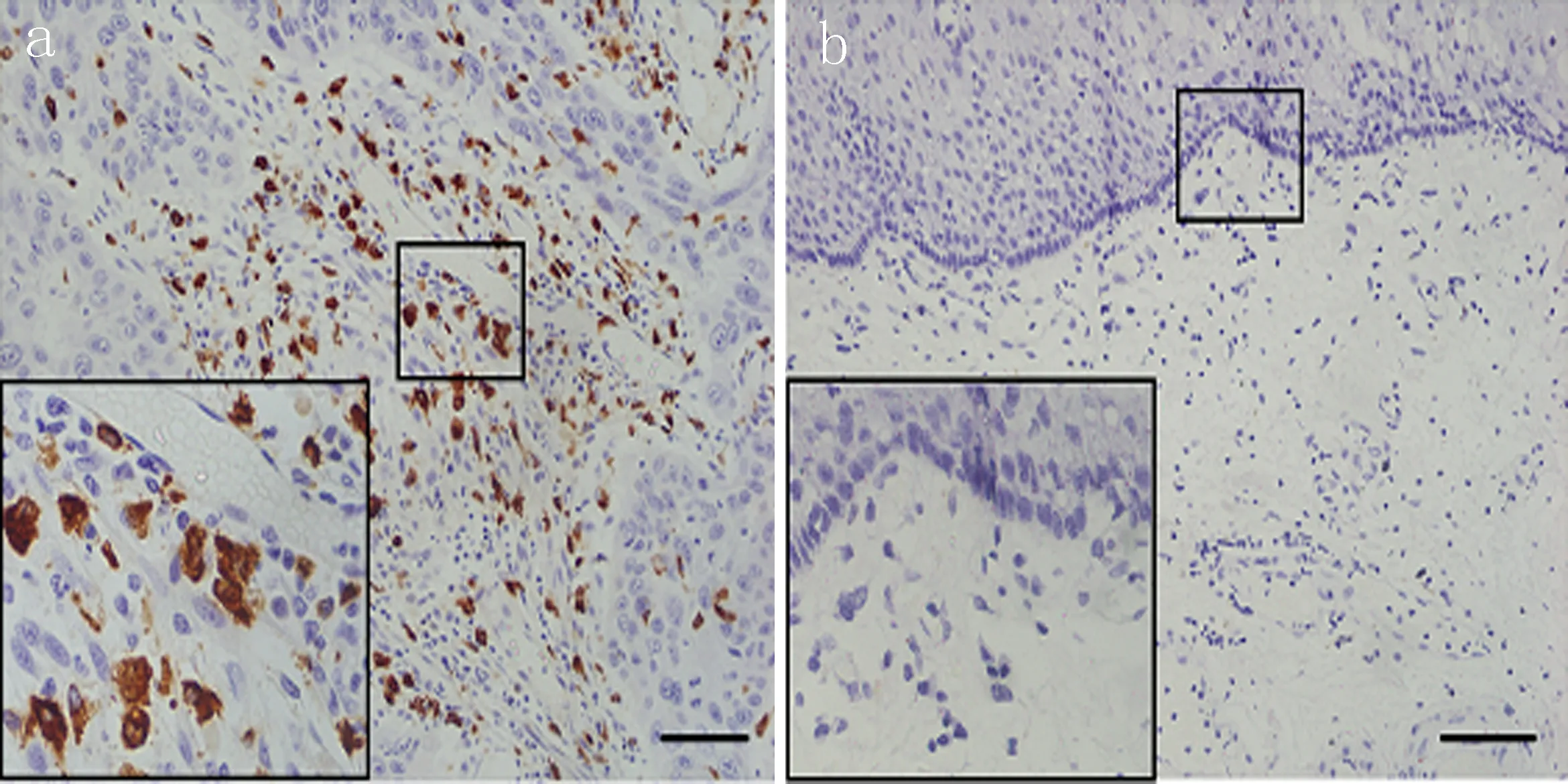
a: IL-1β在食管癌组织中的表达 b: IL-1β在癌旁组织中的表达
图1IL-1β在ESCC及癌旁组织中的表达
2.2IL-1β阳性细胞浸润密度与临床病理参数的相关性IHC结果表明,ESCC组织中IL-1β表达与患者淋巴结转移(P=0.018) 及T分期(P=0.011)明显相关,差异有统计学意义(P<0.05)。ESCC组织中IL-1β表达与患者的性别(P=1.000)、年龄(P=0.470)、病理分级(P=0.117) 的相关性无统计学意义(P>0.05) (表1)。
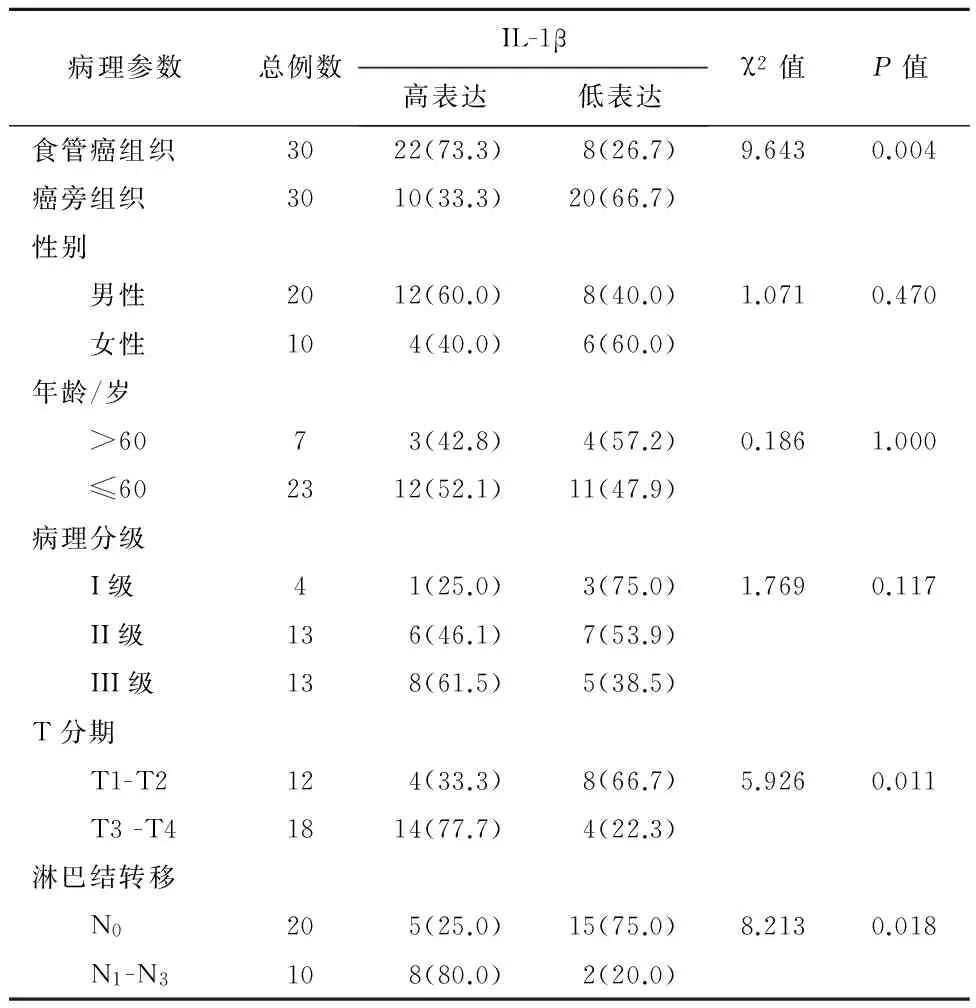
表1 30例食管鳞状细胞癌IL-1β表达与临床病理参数的分析/例(%)
2.3生存分析30例ESCC患者,手术时间为2007年~2010年,生存时间6~66个月,平均生存时间为26个月。从2007年~2010年,30例ESCC患者存活14例,死亡16例,5 a生存率为47%。生存分析显示,食管癌组织中IL-1β表达低的患者5 a生存率明显高于表达高的患者,差异有统计学意义(P<0.01, 图2)。

3 讨论
食管癌是我国常见的消化道恶性肿瘤之一,食管癌早期症状不明显,患者就诊时多已是中晚期,导致食管癌患者5 a生存率不足20%[7]。因此,临床上需要有效的分子标志物,对食管癌患者预后及淋巴结转移等重要临床病理指标作出更为及时和准确的评估。炎性细胞因子在肿瘤的发生发展过程中起着重要作用[8-9]。IL-1β是一种重要的炎性细胞因子,由成熟的巨噬细胞及血液中的单核细胞所分泌,肿瘤微环境中IL-1β浸润数量增加可增强肿瘤细胞的侵袭转移能力[10-12]。此外,在胃癌和结肠癌的研究中发现,肿瘤组织中IL-1β表达高,患者预后差,表明IL-1β可作为胃和结肠肿瘤患者预后不良的标志物[13-15]。
本研究运用IHC技术检测了IL-1β浸润与ESCC患者预后的相关性及与ESCC患者淋巴结转移等临床病理指标的相关性。30例食管癌组织中IL-1β阳性细胞最多56个/高倍视野,最少15个/高倍视野,IL-1β在食管癌组织中阳性细胞中位数为32.6个/高倍视野;而30例癌旁组织中IL-1β阳性细胞数最多17个/高倍视野,最少2个/高倍视野,IL-1β在癌旁组织中阳性细胞中位数为5.3个/高倍视野,IHC结果表明,IL-1β在ESCC组织中的阳性细胞数明显高于癌旁组织,差异有统计学意义(P<0.05)。生存分析结果显示,IL-1β表达高的患者其生存期明显低于表达低的患者,差异也有统计学意义。本研究进一步探讨了IL-1β表达与ESCC患者淋巴结转移、T分期等临床病理参数的相关性,结果表明,ESCC组织中IL-1β表达与患者淋巴结转移及T分期明显相关,差异有统计学意义(P<0.05),而ESCC组织中IL-1β表达与患者性别、年龄、临床分级的相关性无统计学意义(P>0.05)。
综上所述,IL-1β浸润与食管癌患者预后、淋巴结转移及T分期相关,表明IL-1β不但在ESCC患者的预后,而且在ESCC患者淋巴结转移及临床分期中扮演着重要角色,IL-1β可作为判断食管癌患者预后及淋巴结转移的潜在分子标志物。但本研究只限于免疫组化水平的检测,IL-1β参与食管癌浸润转移的分子和细胞方面的机制性研究还有待于进一步证实。
参考文献:
[1] FRANCESCONE R, HOU V, GRIVENNIKOV S I. Microbiome, inflammation, and cancer[J]. Cancer J, 2014, 20(3):181-189.
[2] LIU J, LIN P C, ZHOU B P. Inflammation fuels tumor progress and metastasis[J]. Curr Pharm Des, 2015, 21(21):3032-3040.
[3] NETEA M G, VAN DE VEERDONK F L, VAN DER MEER J W, et al. Inflammasome-independent regulation of IL-1-family cytokines[J]. Annu Rev Immunol, 2015(33):49-77.
[4] DINARELLO C A. An expanding role for interleukin-1 blockade from gout to cancer[J]. Mol Med, 2014, 20(Suppl 1):S43-58.
[5] TARASSISHIN L, LIM J, WEATHERLY D B, et al. Interleukin-1-induced changes in the glioblastoma secretome suggest its role in tumor progression[J]. J Proteomics, 2014,(99):152-168.
[6] 周剑, 贺家勇, 刘涛, 等. 食管鳞状细胞癌组织中M2型巨噬细胞浸润与患者预后及临床病理参数的相关性[J]. 新疆医科大学学报, 2017, 40(11):1380-1387.
[7] KATO H, NAKAJIMA M. Treatments for esophageal cancer:a review[J]. Gen Thorac Cardiovasc Surg, 2013, 61(6):330-335.
[8] ATSUMI T, SINGH R, SABHARWAL L, et al. Inflammation amplifier, a new paradigm in cancer biology[J]. Cancer Res, 2014, 74(1):8-14.
[9] CANDIDO J, HAGEMANN T. Cancer-related inflammation[J]. J Clin Immunol, 2013, 33 (Suppl 1):S79-84.
[10] QUAIL D F, JOYCE J A. Microenvironmental regulation of tumor progression and metastasis[J]. Nat Med, 2013, 19(11):1423-1437.
[11] LANDSKRON G, DE LA FUENTE M, THUWAJIT P, et al. Chronic inflammation and cytokines in the tumor microenvironment[J]. J Immunol Res, 2014(2014):149185.
[12] FATHIMA-HURMATH K, RAMASWAMY P, NANDAKUMAR D N. IL-1beta microenvironment promotes proliferation, migration, and invasion of human glioma cells[J]. Cell Biol Int, 2014, 38(12):1415-1422.
[13] LI S, WANG W, ZHANG N, et al. IL-1beta mediates MCP-1 induction by Wnt5a in gastric cancer cells[J]. BMC Cancer, 2014(14):480-485.
[14] VORONOV E, APTE R N. IL-1 in Colon inflammation, colon carcinogenesis and invasiveness of colon cancer[J]. Cancer Microenviron, 2015, 8(3):187-200.
[15] LI Y, WANG L, PAPPAN L, et al. IL-1beta promotes stemness and invasiveness of colon cancer cells through Zeb1 activation[J]. Mol Cancer, 2012(11):87-92.

