晚期肺腺癌伴肺癌性淋巴管病18F-FDG PET/CT的检查特征
孙晓琰, 雷 贝, 常 城, 王利华, 刘 柳, 阮茂美, 谢文晖
(上海交通大学附属胸科医院核医学科, 上海 200030)
肺癌因其高发病率及高恶性程度,成为主要的致死性恶性肿瘤,其中 2/3 的患者在诊断时已为晚期[1],肺癌患者中40%以上为肺腺癌。世界范围内肺腺癌的发病率呈逐年上升趋势[2],肺腺癌已成为亚洲最主要的肺癌病理学亚型之一,是肺癌研究中的主要对象[3]。肺癌性淋巴管病(pulmonary lymphangiticcarcinomatosis, PLC) 是一种肺内、外恶性肿瘤转移并在肺淋巴管内弥漫性广泛生长的肺内转移癌,是肺内外肿瘤肺内转移的一种特殊类型[4]。虽然PLC并不常见,但在临床实践中观察到晚期肺腺癌合并PLC的患者并不少见,而相关报道却罕见。随着PET/CT融合技术的发展,标准摄取值(standardized uptak value, SUV) 、肿瘤代谢体积(metabolic tumor volume, MTV)、病灶糖酵解总量(total lesion glycolysis, TLG)等代谢参数被应用于肿瘤相关研究中。本研究通过回顾性分析上海市胸科医院确诊的晚期肺腺癌患者PET/CT代谢参数特点,探讨晚期肺腺癌伴或不伴PLC患者的PET/CT检查特征的差别,以期为晚期肺腺癌伴PLC患者的治疗及预后提供更多依据。
1 资料及方法
1.1一般资料回顾性研究2016年8月-2017年12月上海胸科医院核医学科行PET/CT检查患者4 000余例,从中筛选88例IV期肺腺癌患者,其中男性47例,女性41例,年龄35~86岁,平均年龄(61.63±12.65)岁。其中伴PLC的28例(PLC组),不伴PLC的60例(Non-PLC组)。研究的纳入标准:(1)发生于肺部的肿瘤病理证实为肺腺癌。(2)根据国际抗癌联盟(UICC)肺癌分期标准第8版(2017年1月实施)入选IV期肺癌。(3)未经过抗癌治疗。(4)肺门及纵隔转移性淋巴结均经病理证实。(5)远期转移病灶均经病理学、CT、MR、骨显像等检查证实或联合证实。(6)PLC病灶经病理或HRCT或薄层CT检查并且结合多次随访综合证实。排除标准:(1)其它类型肺癌及多中心癌(如肺腺癌伴直肠癌等)。(2)非IV期肺腺癌。(3)有癌症治疗史。(4)高度疑似PLC但不符合纳入标准的病例。(5)合并活动性肺结核、肺间质性疾病、肺水肿、机会性感染、放射性纤维化、自身免疫性疾病、药物性肺疾病。
1.2检查方法使用德国西门子公司Biograph mCT-S PET/CT(64排螺旋CT),对患者行PET/CT+屏气状态下薄层CT扫描。18F-FDG由上海安迪科正电子技术有限公司生产提供,药物pH值约7.0,放化纯度>95%。检查前患者禁食6 h以上,控制血糖<7.8 mmol/L,根据患者体质量以0.10~0.15 mCi/kg为标准,静脉注射18F-FDG平静休息45~60 min。扫描时患者仰卧位,扫描范围为颅底至股骨上1/3处,选择检查范围后进行螺旋CT扫描,条件为管电压120 kV,管电流由CAREDose 4D技术自行调整,层厚5.0 mm。之后分5~6个床位采集全身PET图像,采集用时2 min/床位。应用CT数据对PET图像进行衰减校正,采用TrueX+TOF法进行图像重建。所有患者均加做层厚1.0 mm薄层屏气肺CT扫描。
1.3图像分析(1)肺部原发病灶的测量:采集好的图像传输至PACS图像后处理工作站。由1名主治及主治以上职称医师对病灶使用3D测量法,结合横断面、冠状面、矢状面图像,分别将肺癌病灶、胸部各区转移性淋巴结等研究对象勾画入容积感兴趣区(volume of interest, VOI)内。(2)淋巴结的分区及测量:根据国际肺癌研究协会的相关标准[5],将淋巴结分为14区,12~14区淋巴结位置不易确定,出现少且观察存在困难。本研究主要观察1区~11区淋巴结的分布及代谢参数情况,部分区需要区分左右,用L、R区分。PET/CT 诊断肺癌淋巴结转移的标准为:淋巴结SUVmax ≥ 2.5,淋巴结内无斑块状钙化, 淋巴结分布于肿瘤所在肺叶的淋巴引流区,沿肺门纵隔呈明显的不对称分布。同机CT检出的淋巴结即使其短径≥1.0 cm,如果无肉眼可识别的放射性摄取增高,诊断为淋巴结转移阴性。(3)代谢参数的测量:采用绝对阈值法(SUVthreshold2.5),由软件自动勾画病灶边界,得到病灶的最大标准摄取值(maximum standardized uptake value,SUVmax)、肿瘤代谢体积(metabolic tumor volume,MTV)、最大直径,计算病灶糖酵解总量(total lesion glycolysis, TLG)。
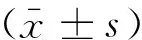
2 结果
在PLC组28例患者中,PLC病灶呈弥散性发生于单侧肺的有13/28例(46%),呈局限性发生于单侧肺的有13/28例(46%),呈弥漫或局灶性发生于双肺的有2/28例(7%)。18F-FDG PET/CT显像后,在目视下PLC组病例均见小叶间隔增厚伴放射性摄取、支气管血管束增粗伴放射性摄取增强,同时见肺门及纵隔淋巴结肿大伴放射性摄取增强。
分析2组PET/CT影像后,对2组患者的临床病理特征及代谢参数进行了比较。临床病理资料的比较显示年龄、性别、肿瘤直径、原发肿瘤的代谢参数(SUVmax、MTV、TLG)在2组间未见差异(P>0.05)。而肺癌类型在PLC组和Non-PLC组间存在差异(P<0.05)。在远处转移病灶中,PLC组及Non-PLC组患者仅头颈、腹盆淋巴结转移的发生率存在差异(P<0.05),其余脏器的转移率2组间均未见明显差异,见表1。
PLC组与Non-PLC组病例均见肺部淋巴结肿大或显示伴放射性异常浓聚,为了分析2组间肺部转移性高代谢淋巴结是否存在分布及代谢差异,对2组间淋巴结进行比较发现PLC组与Non-PLC组在1区、2R区、3A、5区淋巴结转移率有差异(P<0.05),PLC组在1区、3A、5区出现淋巴结转移的机率更高。PLC组与Non-PLC组比较,SUVmax仅在7区出现了差异(P<0.05),PLC组高于非PLC组。 MTV、TLG值在1区、7区存在差异(P<0.05),PLC组高于Non-PLC组,见表2。

表1 PLC组及Non-PLC组患者临床病理特征及代谢参数比较
3 讨论
PLC是恶性肿瘤肺内转移的一种特殊途径,病理基础是癌细胞在淋巴管内生长阻塞淋巴结管,使管腔扩张、淋巴液淤滞,同时伴炎细胞浸润及不同程度水肿。肺癌性淋巴管病发病率较低,在转移性肺癌中发病率为 6%~8%[6], 80%源于腺癌,肺原发恶性肿瘤伴PLC亦多与肺腺癌相关。虽然PLC发病率较低,但在晚期肺腺癌中并不少见,应用PET/CT对晚期肺腺癌伴或不伴PLC患者检查特征进行比较的研究,国内外尚无类似报道。

表2 PLC组及Non-PLC组患者肺部转移淋巴结代谢参数比较/例
目前PLC影像学诊断基本依靠高分辨CT,其特点为小叶间隔结节样增厚、支气管血管束串珠样增粗、胸膜串珠样增厚、肺门及纵隔淋巴结肿大等[7]。查阅国内外文献,肺癌性淋巴管病PET/CT领域的相关研究有限,早期Digumarthy等[8]、Acikgoz等[9]描述了PLC患者PET的主要显像特点为PLC肺及累及的支气管血管束的放射性摄取增高,由于仪器的限制,上述研究未做PET与CT的同机融合,无法对病灶进行精准量化研究。Prakash等[10]分析了PLC的PET/CT融合图像,结果示PLC肺的平均SUV值显著高于对侧正常肺野,PET/CT对PLC诊断的灵敏度为86%,特异度为100%。本研究中28例IV期肺癌伴PLC患者均出现了小叶间隔增厚伴放射性摄取及支气管血管束代谢增高,所有患者均见肺门及纵隔淋巴结肿大伴高代谢,其PET/CT影像学特点与之前报道基本一致。 关于PLC的产生可分为两种情况:一是易经淋巴管转移的肿瘤(如肺癌、乳腺癌、胃癌等),肿瘤细胞首先转移至肺门淋巴结,再阻塞肺内的淋巴回流,肿瘤通过肺门淋巴结逆向扩散到肺内的淋巴管中;易发生血行转移的肿瘤(如肝癌、胰腺癌等)则先经肺内血管播散,再经血液、淋巴回流转移至肺内淋巴管内形成PLC,常不伴肺门淋巴结转移。本研究中晚期肺腺癌伴PLC组患者肺门及纵隔均见肿大伴代谢增高的淋巴结,同时通过比较2组远处转移器官转移情况,PLC组腹膜后淋巴结转移率明显高于无PLC组,说明PLC组肿瘤细胞更易沿淋巴系统转移扩散。
PET/CT代谢参数中SUVmax用来评价肿瘤局部最高代谢活性,SUVavg用来评价肿瘤平均代谢活性,MTV测量肿瘤代谢体积,其测量基础是肿瘤的代谢活性,避免了CT或MRI测量肿瘤最大径和体积时,因包含无活性坏死组织而不能准确反映肿瘤的实际大小的可能,MTV反映了异常代谢肿瘤细胞即存在代谢活性的肿瘤的总体积。TLG是一个基于代谢体积及代谢活性的综合参数,反映了肿瘤整体的代谢特点。MTV与TLG主要被应用在肿瘤的诊断价值、预后评估、临床病理特征等研究中[11-13]。Ooi等[14]应用PET/CT代谢参数研究伴或不伴PLC晚期非小细胞肺癌与FDG摄取的相关性以评估PLC对生存的影响,结果显示在PLC组中肺原发性肿瘤的TLG对无进展生存期有显著的预测作用,而在Non-PLC组中全身TLG可能是一个有效的预测指标。本研究应用PET/CT对晚期肺腺癌伴或不伴PLC患者检查特征进行比较,本研究发现这些参数对量化比较两组患者肺原发病灶及转移淋巴结、远处受累器官代谢特性有重要意义。通过对2组肺癌的转移性淋巴结进行分区比较发现PLC组肺癌患者在1、2R、3A、5区出现转移性淋巴结的频率高于无PLC组,说明PLC组转移性淋巴结在肺部淋巴结分组中分布更广。而PLC组转移性淋巴结在7区的SUVmax较非PLC组更高,提示PLC组在7区的肿瘤代谢最大活度高于非PLC组。PLC组转移性淋巴结在1、7区的MTV及TLG值大于无PLC组,说明PLC组转移性淋巴结在1、7区的有活性的转移灶体积更大,转移性病灶活跃程度更高。
综上所述,晚期肺腺癌伴PLC患者PET/CT影像学可见小叶间隔增厚伴放射性摄取及支气管血管束代谢增高,肺门及纵隔淋巴结肿大伴高代谢。与晚期肺腺癌不伴PLC患者PET/CT代谢参数比较发现晚期肺腺癌伴PLC患者肺部及肺外转移淋巴结分布范围更广,1、7区转移性淋巴结肿瘤代谢体积更大、转移淋巴结肿瘤细胞代谢更高活性更强。
参考文献:
[1] TORRE L A, SIEGEL R L, JEMAL A. Lung cancer statistics [J]. Adv Exp Med Biol,2016,893:1-19.
[2] LORTET-TIEULENT J, SOERJOMATARAM I, FERLAY J, et al. International trends in lung cancer incidence by histological subtype:adenocarcinoma stabilizing in men but still increasing in women[J]. Lung Cancer,2014,84(1):13-22.
[3] ZHOU C. Lung cancer molecular epidemiology in China: recent trends[J]. Transl Lung Cancer Res,2014,3(5):270-279.
[4] CHAREST M, ARMANIOUS S. Prognostic implication of the lymphangiticcarcinomatosis pattern on perfusion lung scan[J]. Can Assoc Radiol J, 2012,63(4): 294-303.
[5] USCH V W, ASAMURA H, WATANABE H, et al. The IASLC lung cancer staging project:a proposal for a new international lymph nodemap in the forthcomingseventh edition of theTNM classificationfor lung cancer[J].Thorac Oncol,2009,4(5):568-577.
[6] BHATTACHARYA P K, JAMIL M, KHONGLAH Y, et al. A rare case of pulmonary lymphangitic carcinomatosis in a young adult with carcinoma stomach[J]. J Clin Diagn Res, 2017,11(8):7-9.
[7] OIKONOMOU A, PRASSOPOULOS P. Mimics in chest disease: interstitial opacities[J]. Insights Imaging, 2013, 4(1): 9-27.
[8] DIGUMARTHY S R, FISCHMAN A J, KWEK BH , et al. Fluorodeoxyglucose positron emission tomography pattern of pulmonary lymphangiticcarcinomatosis [J]. J Comput Assist Tomogr, 2005, 29(3): 346-349.
[9] ACIKGOZ G, KIM S M, HOUSENI M, et al. Pulmonary lymphangiticcarcinomatosis (PLC): spectrum of FDG-PET findings [J]. Clin Nucl Med, 2006, 31(11): 673-678.
[10] PRAKASH P, KALRA M K, SHARMA A, et al. FDG PET/CT in assessment of pulmonary lymphangiticcarcinomatosis[J]. AJR Am J Roentgenol, 2010, 194(1): 231-236.
[11] JAYACHANDRAN P, PAL R K, QUON A, et al. Postchemoradiotherapy positron emission tomography predicts pathologic response and surviral in patients with esophageal cancer[J].Int J Radiat Oncol Biol Phys,2012,84(2):471-477.
[12] 张倩,辛军,李红,等.18F-FDG PET/CT显像半定量参数MTV、TLG联合 SUV在乳腺癌诊断中的应用价值[J].中国临床医学影像杂志,2016,27(9):620-624.
[13] 汤泊,张银,李天女,等.18F-FDG PET-CT代谢参数与肺鳞状细胞癌临床病理特征的关系[J].肿瘤研究与临床, 2017,29(5):316-321.
[14] OOI H, CHEN C Y, HSIAO Y, et al. Fluorodeoxygulcoseuptake in advanced Non-small cell lung cancer with and without pulmonary lymphangitic carcinomatosis[J]. Anticancer Research, 2016, 36(5): 4313-4320.

