性别及去卵巢手术对肾血管性高血压大鼠左心室肥厚的影响
邬利娅·伊明, 帕提古丽·阿布拉, 阿布来提·阿布力孜, 阿瓦古丽·达吾提, 阿迪力·阿不都热合曼, 阿迪拉·迪里夏提, 刘 丹, 周文婷, 艾尼瓦尔·吾买尔
(1新疆医科大学药学院药理学教研室, 乌鲁木齐 830011; 2新疆维吾尔医学专科学校, 新疆 和田 848000)
肾血管性高血压是一种常见的继发性高血压,狭窄大鼠一侧肾动脉(2K1C),即在一侧肾动脉中放置银夹使肾动脉血流量减少约50%,导致肾素释放增加,激活肾素血管紧张素系统(RAS)而使全身平均动脉压逐渐增加形成肾血管性高血压[1-2],是由Goldblatt于1934年研发并成为该病的经典动物模型[3-4]。
左心室肥厚(LVH)是高血压最常见的一种靶器官损伤,是针对长期左心室后负荷增加的一种代偿性反应, 然而,长期增高的心室壁压力可影响左心室结构的完整性,提示机械负荷和几种神经体液因素参与左心室肥厚过程[5]。RAS在高血压的发生发展中起关键作用,其主要效应分子血管紧张素Ⅱ(AngⅡ)除了血流动力学作用外,尚可诱导心肌细胞纤维化而发挥促其增生作用及致炎作用,尤其是局部组织RAS的过度激活参与LVH的发生发展[6]。
本研究选用10周龄清洁级(SPF)SD大鼠制备2K1C肾血管性高血压模型,研究肾血管性高血压大鼠左心室肥厚形成的性别差异性;切除双侧卵巢造成雌激素水平低下,再制备2K1C肾血管性高血压模型,研究雌激素水平对肾血管性高血压大鼠左心室肥厚形成的影响。
1 材料与方法
1.1实验动物160只10周龄SPF SD大鼠,雌雄各半,体质量(200±20)g,购自新疆医科大学实验动物中心。实验在新疆医科大学实验动物中心SPF级实验室进行,手术后的大鼠常规喂养。SD大鼠的使用得到新疆医科大学实验动物中心的同意,所有的操作符合动物伦理学的管理准则。
1.2实验仪器与试剂大鼠血压监测仪(上海奥尔科特生物技术有限公司),三通管及四通管(法国Plastimed公司),单通道转动器(美国Spalding Medical products),血压换能器(复旦大学电子工程系PT14M),A/D采样板(中科院声学所科声公司),JA2003型电子天平(上海天平仪器厂),超高速低温离心机(Eppendorf公司),UV-2802紫外可见分光光度计(上海尤尼柯仪器有限公司),戊巴比妥钠购自Sigma公司,总蛋白抽提试剂盒和蛋白定量试剂盒购自上海天根生物有限公司,AngⅡ的1型受体(AT1)抗体、AngⅡ2型受体(AT2)抗体、血管紧张素转化酶1(ACE1)抗体、血管紧张素转化酶2(ACE2)抗体,均购自美国SantaCruz 公司。二抗[辣根过氧化物酶(HRP)标记的抗兔、抗山羊]、硝酸纤维素薄膜、免疫印迹增强化学发光试剂盒购自尚柏生物医学技术(北京)有限公司,其余与实验相关的生化试剂和耗材购自上海生工生物工程技术服务公司。
1.3实验方法
1.3.1 肾血管性高血压及雌激素低下模型的制作 取80只雄性和80只雌性SD大鼠,随机分为雌性组雄性假手术组(2K1C-sham-M组)、雄性组(2K1C-M组)、雌性组(2K1C-F组)和雌性去势组(2K1C-VOX组),每组40只。所有实验动物适应性饲养1 w后,腹腔注射3%戊巴比妥钠(45 mg/kg)麻醉,按文献[7]所述,分离右侧肾动脉并套以U型银夹(内径为0.25 mm),完成一侧肾动脉狭窄手术,缝合切口,假手术组所有的操作同手术组,分离肾动脉不套U型银夹。按文献[8]所述,40只雌性SD大鼠完成右侧肾动脉狭窄手术后,用镊子移开腹内组织,分离卵巢,结扎卵巢动脉及脂肪组织并切除双侧卵巢,逐层关腹缝合消毒切口,术后肌内注射青霉素(8万单位/只)。术后动物保温,清醒后每笼5只动物,置实验动物中心SPF级实验室常规喂养至实验结束。
1.3.2 大鼠血压及左心室指数的测定 大鼠用3%的戊巴比妥钠(45 mg/kg)腹腔注射麻醉,准确称重后,行股动脉插管,连接于大鼠血压监测系统,连续测定血压10 min,记录收缩压(SBP)和舒张压(DBP),高血压的成模标准为SBP>150 mmHg,戊巴比妥钠(45 mg/kg)麻醉状态下, SBP被抑制10%[8],SBP>135 mmHg为成模标准,血压高于此标准入选,低者剔除。入选的大鼠开胸迅速摘下心脏,去除左右心房及右心室,用预冷的磷酸盐缓冲液(PBS)冲洗,滤纸吸干,称量左心室(包括室间隔)湿重,以左心室重量与体质量之比计算左心室指数(LVW/BW)。
1.3.3 大鼠左心室组织蛋白的提取及测定 称取左心室组织重0.1g,0℃加入PBS液充分洗涤后,剪碎组织加入0.5 mL组织裂解液匀浆,以4℃ 12 000 g离心10 min,取上清液分装,用Bradford 法测定蛋白浓度,将样品置微量恒温加热器95℃变性10 min,冷却后-20℃冻存。
1.3.4 蛋白质印迹法(Western blot法)测定ACE1、ACE2、 AT1和AT2蛋白表达 配制10%SDS-PAGE 分离胶及基层胶,每个样品50 μg及生物素结合的蛋白标准各10 μL加样电泳分离,转移到硝酸纤维素膜上。以封闭液(5%脱脂奶粉)室温封闭膜1 h,TBS/T缓冲液洗膜3次,以稀释后的一抗:ACE抗体(1∶2 000)、ACE2抗体(1∶1 000)、AT1抗体(1∶1 000)和AT2抗体(1∶500)室温温孵过夜。TBS/T洗膜3次,用HRP结合的二抗体在室温孵育膜1 h,洗膜3次。采用DAB试剂直接在硝酸纤维素膜上显色。过氧化物酶使底物发生反应,与反应部位产生棕色沉淀物,显色时间为5~20 min。显色充分后,及时将标本脱水封固。采用Imagetool凝胶图像分析软件对硝酸纤维素膜扫描分析。以每组目的蛋白表达的面积灰度值与β-actin表达的面积灰度值的比值而作为半定量分析值。
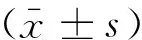
2 结果
2.1性别及去卵巢手术对2K1C大鼠左心室肥厚与2K1C-sham-M组比较,2K1C组SBP、DBP升高(P<0.01),与2K1C-M组比较,2K1C-F组SBP、DBP升高(P<0.01),而2K1C+OVX组与2K1C-F组间差异无统计学意义;与2K1C-sham-M组比较,2K1C组LVW/BW增加(P<0.01); 2K1C-F组的LVW/BW高于2K1C-M组和2K1C-OVX组(P<0.01),提示雌性组的左心室肥厚程度严重,见表1。

表1 2K1C大鼠血压及左心室指数的变化
注:与2K1C-sham-M组比较,**P<0.01; 与2K1C-M组比较,#P<0.05,##P<0.01; 与2K1C- F组比较,◆P<0.05,◆◆P<0.01。
2.2大鼠左心室组织中ACE1和ACE2蛋白表达的性别差异与2K1C-sham-M组比较,2K1C-F组的心脏组织中ACE1的蛋白的表达升高(P<0.05)。与2K1C-sham-M组比较,2K1C-M组和2K1C-F组心脏组织中ACE2蛋白的表达下降(P<0.05),见图1。
2.3大鼠心脏组织中AT1和AT2受体蛋白表达性别差异性与2K1C-sham-M组比较,2K1C-M组和2K1C-F组心脏组织中AT1受体的蛋白表达增加(P<0.05),2K1C-F组与其他各组相比,心脏织中AT1受体的蛋白表达明显增加(P<0.01)。与2K1C-sham-M组比较,各手术组心脏组织中AT2受体的蛋白降低,2K1C-OVX组明显降低(P<0.05),见图2。
3 讨论
RAS在血压调节和各种心血管系统疾病中发挥着重要的作用。随着细胞、分子生物学实验技术的发展与进步,人们发现除了经典的循环RAS外,还存在局部组织RAS,尤其是存在于心脏、血管、肾脏等最重要器官局部组织中[10-12]。局部产生的AngⅡ可通过自分泌、旁分泌等方式,在细胞生长、增生和代谢等方面发挥重要的作用。

注:1为2K1C-sham-M组; 2为2K1C-M组; 3为2K1C-OVX组; 4为2K1C-F组; 与2K1C-male-sham组比较,*P<0.05; 与2K1C-OVX组比较,◆P<0.05。
图12K1C大鼠心脏组织中ACE1和ACE2蛋白表达的性别差异

注: 1为2K1C-sham-M组; 2为2K1C-M组; 3为2K1C-OVX组; 4为2K1C-F组; 与2K1C-male-sham组比较,*P<0.05,**P<0.01; 与2K1C-M组比较,#P<0.05; 与2K1C-OVX组比较,◆P<0.05,◆◆P<0.01。
图22K1C大鼠心脏组织中AT1和AT2蛋白表达的性别差异
雌激素可影响RAS的作用,雌激素缺乏时会增加肾素和ACE1的水平,并上调AT1受体表达[13]。而这些效应可通过雌激素治疗而逆转[14-15]。雌激素还可影响RAS的受体后效应,即在血管内皮细胞,可降低由血管紧张素Ⅱ介导的iNOS和NADPH氧化酶的过度表达,减轻氧化应激和促炎症反应[16]。雌激素还可直接淬灭RAS诱导的血管内活性氧的产生,减少氧化应激[17]。此外,RAS的激活或抑制均存在明显的性别差异性。
为了阐明雌激素与RAS组分之间的相互作用及对左心室肥厚的影响,本研究选用10周龄雌性和雄性的SD大鼠制备2K1C肾血管性高血压模型。为了进一步了解雌激素的作用,切除双侧卵巢造成雌激素水平低下,再行2K1C手术,常规喂养32 w后,观察血压及左心室肥厚的程度。结果表明:2K1C-F组大鼠的SBP、DBP均明显高于2K1C-M组和2K1C-VOX组(P<0.05),提示雌激素可肾血管性高血压大鼠的血压水平;2K1C-F组的LVW/BW明显高于2K1C-M组和2K1C-OVX组(P<0.05),提示2K1C-F组的心肌肥厚最为严重。
本研究结果显示:2K1C-F大鼠左心室组织中ACE1的蛋白的表达升高(P<0.05);2K1C-M组和2K1C-F组心脏组织中ACE2蛋白的表达下降(P<0.05); 2K1C-F组大鼠左心室组织中AT1受体的蛋白表达高于2K1C-M组和2K1C-F组(P<0.05),AT2受体的蛋白表则降低,提示雌性肾血管性高血压大鼠的RAS的收缩轴ACE-AngⅡ-AT1是处在过度激活状态。
综上所述,雌性肾血管性高血压大鼠的血压水平和左心室肥厚程度明显高于雄性组。其机制可能与明显升高心脏组织中ACE及AT1受体的蛋白表达有关。
参考文献:
[1] NYSTRÖM H C, JIA JOHANSSON M, LAMBERT G, et al. Neurohormonal influences on maintenance and reversal of two-kidney one-clip renal hypertension[J]. Acta Physiol Scand,2002,175(3):245-251.
[2] OLIVEIRA-SALES E B, TOWARD M A, CAMPOS R R, et al. Revealing the role of the autonomic nervous system in the development and maintenance of Goldblatt hypertension in rats[J]. Auton Neurosci, 2014,183(100):23-29.
[3] GOLDBLATT H, LYNCH J, HANZAL R F, et al. Study on experimental hypertension: Production of persistent elevation of systolic pressure by means of renal ischemia [J]. J Exp Med, 1934, 59 (3):347-380.
[5] TSURUDA T, SEKITA-HATAKEYAMA Y, HAO Y, et al. Angiotensin Ⅱ stimulation of cardiac hypertrophy and functional decompensation in osteoprotegerin- deficient mice[J]. Hypertension, 2016, 67(5):848-856.
[6] LI L, YI-MING W, LI Z Z, et al. Local RAS and inflammatory factors are involved in cardiovascular hypertrophy in spontaneously hypertensive rats[J]. Pharmacol Res, 2008, 58(3-4):196-201.
[7] 古孜力努尔·依马木, 邬利娅·伊明, 依巴代提·托合提, 等. 罗勒提取物对肾性高血压大鼠的影响[J]. 新疆医科大学学报,2009,32(3):259-264.
[8] 马虎, 阿迪力·阿不都热合曼, 秦浩, 等.雌激素对肾血管性高血压大鼠心脏功能及氧化应激的影响[J]. 新疆医科大学学报, 2016, 39(4):441-448.
[9] YI-MING W, SHU H, MIAO C Y, et al. Asynchronism of the recovery of baroreflex sensitivity, blood pressure, and consciousness from anesthesia in rats[J]. J Cardiovasc Pharmacol,2004, 43(1):1-7.
[10] PAUL M, MEHR A P, KREUTZ R, et al. Physiology of local renin-angiotensin systems[J]. Physiol Rev, 2006, 86(3):747-803.
[11] CRACKOWER M A, SARAO R, OUDIT G Y, et al. Angiotensin-converting enzyme 2 is an essential regulator of heart function[J]. Nature, 2002, 417 (6891):822-828.
学习能力的培养对小学生来说并非易事,需要教师本着巨大的责任感,循序渐进,因材施教,为学生创造良好的学习环境和氛围,激发学生的自主学习意识和探索精神,只有这样,数学教学才能事半功倍。
[13] HALL J E. Historical perspective of the renin-angiotensin system[J]. Mol Biotechnol, 2003, 24(1):27-39.
[14] XU J W, IKEDA K, YAMORI Y. Genistein inhibits expressions of NADPH oxidase p22phox and angiotensin II type 1 receptor in aortic endothelial cells from stroke-prone spontaneously hypertensive rats[J]. Hypertens Res, 2004, 27(9): 675-683.
[15] GRAGASIN F S, XU Y, ARENAS I A, et al. Estrogen reduces angiotensin II-induced nitric oxide synthase and NAD(P)H oxidase expression in endothelial cells[J]. Arterioscler Thromb Vasc Biol, 2003, 23(1):38-44.
[16] ALVAREZ A, HERMENEGILDO C, ISSEKUTZ A C, et al. Estrogens inhibit angiotensin II-induced leukocyteendothelial cell intER ctions in vivo via rapid endothelial nitric oxide synthase and cyclooxygenase activation[J]. Circ Res, 2002, 91(12):1142-1150.
[17] BEHL C, SKUTELLA T, LEZOUALC’H F, et al. Neuroprotection against oxidative stress by estrogens:structure-activity relationship[J]. Mol Pharmacol, 1997, 51(4):535-541.

