64例小肠间质瘤临床诊治分析
唐 鹏,闵 江,钱 昆,张 伟
(重庆医科大学附属第一医院胃肠外科 400010)
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是起源于胃肠道Cajal 细胞或与Cajal细胞同源的间叶干细胞的梭形细胞肿瘤,发病率约2/10万,平均发病年龄约60岁[1]。GIST可见于消化道任何部位,最常见于胃(60%~70%),小肠次之(25%~40%)[2]。小肠间质瘤(small intestine stromal tumor,SIST)为GIST的一种,常见于空肠。由于SIST病变部位隐匿、解剖的特殊性、临床症状不典型、检查手段有限,早期诊断困难,往往被误诊或漏诊[3]。本文旨在通过回顾性分析本院2012年12月至2016年8月经手术治疗且病理检查确诊的64例SIST患者的临床资料,总结SIST的临床特征、危险因素、诊断及治疗,并探讨影响其预后的因素,以提高对SIST的诊治水平。
1 资料与方法
1.1一般资料 回顾性分析本院胃肠外科2012年12月至2016年8月经病理组织学证实为SIST的64例患者的临床资料。病例纳入标准:(1)术后病理检查确诊为SIST;(2)术后行免疫组织化学检查;(3)病历资料完整,目标变量不缺失。
1.2病理诊断标准 本研究中SIST的生物学危险性根据JOENSUU等[4]的美国国立卫生署(NIH)2008年胃肠间质瘤切除术后危险度分级原则,分为极低危险度、低危险度、中危险度、高危险度4级,生物学危险分级与生存率等预后指标有良好的相关性。按照病灶最大直径、核分裂象数以及是否破裂等因素,SIST危险度分级如下,(1)极低危险度:肿块最大直径小于2 cm,核分裂象小于或等于5/50 HPF;(2)低危险度:肿块最大直径2~5 cm,核分裂象小于或等于5/50 HPF;(3)中危险度:肿块最大直径小于或等于2 cm,核分裂象大于5/50 HPF;(4)高危险度:肿块最大直径大于2 cm,核分裂象大于5/50 HPF或肿瘤最大直径5~10 cm,核分裂象小于或等于5/50 HPF或只要肿瘤直径大于10 cm或核分裂象大于10/50 HPF或任何大小的肿瘤破裂。
1.3随访 对本组64例患者进行门诊、住院及电话随访,随访内容包括患者术后复查结果、肿瘤有无复发或转移、是否接受靶向药物治疗等。

2 结 果
2.1一般资料 64例患者中,男23例,女41例。发病年龄20~78岁,平均(55.6±12.4)岁,其中,≤50岁21例,51~60岁16例,61~70岁20例,>70岁7例。64例SIST患者中,病变位于近端小肠(十二指肠、空肠)45例(70.3%),远端小肠(空回肠交界、回肠)19例(29.7%),其中距屈氏韧带1 m内空肠37例(57.8%),回肠17例(26.6%),十二指肠5例(7.8%),距屈氏韧带1 m以上空肠3例(4.7%),空回肠交界2例(3.1%)。
2.2临床表现 SIST临床表现缺乏特异性,本组64例病例中,消化道出血30例,腹痛18例,腹部包块8例,腹胀5例,恶心呕吐3例,详见表1。
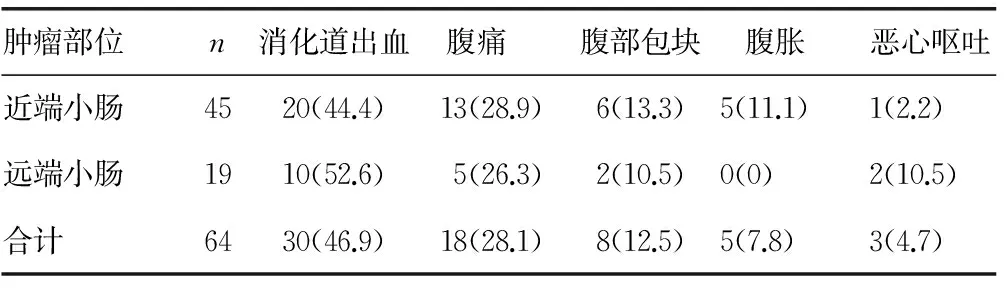
表1 近、远端SIST的临床表现[n(%)]
2.3辅助检查 57例患者行CT检查,33例提示SIST(其中2例提示肝转移),23例提示小肠占位,1例提示肠梗阻。24例行腹部彩超检查,12例提示腹部包块,6例提示SIST(其中2例提示肝转移,表现为肝内散在类圆形低密度影)。16例行胃十二指肠镜检查,8例提示十二指肠黏膜隆起性质待定,3例提示间质瘤。影像学及内镜检查对SIST的检出率及诊断符合率见表2,不同检查方法对SIST的检出率及诊断符合率差异有统计学意义(P<0.05),各种检查方法中,螺旋CT最有价值,螺旋CT检出率及诊断符合率在近、远端SIST间差异没有统计学意义(P>0.05),见表3。
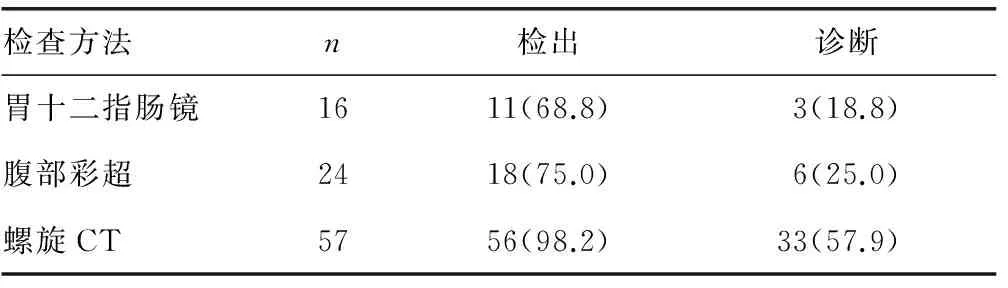
表2 各种检查方法对SIST的检出率及诊断符合率比较[n(%)]

表3 螺旋CT检出率及诊断符合率在近远端SIST间的比较[n(%)]
2.4病理及免疫组化 64例患者均接受手术治疗,除12例(18.8%)行姑息性切除术外,其余52例(81.2%)均将病灶完整切除,术后病理证实切缘均为阴性,无围术期死亡。术后病理结果均提示SIST,根据NIH危险度分级对上述64例SIST生物学行为进行评价,极低危险度8例(12.5%),低危险度22例(34.4%),中危险度3例(4.7%),高危险度31例(48.4%)。病理诊断肿瘤平均最大直径(6.2±4.2)cm,肿瘤最大直径小于或等于5 cm者35例,肿瘤最大直径大于5 cm者29例,肿瘤核分裂象数小于或等于5/50 HPF者42例,核分裂象数大于5/50 HPF者22例。近端小肠与远端小肠在肿瘤直径、核分裂象数、肿瘤危险度及Ki-67阳性率间差异均有统计学意义(P<0.05),见表4。
2.5治疗及随访 64例患者均接受手术治疗,52例行根治性切除术,12例行姑息性切除术,其中8例极低危险度和22例低危险度患者均未口服甲磺酸伊马替尼(imatinib mesylate,IM)治疗,1例高危险度患者因为个人原因未服用IM治疗,其余3例中危险度和30例高危险度患者均接受IM口服治疗,剂量为400 mg。
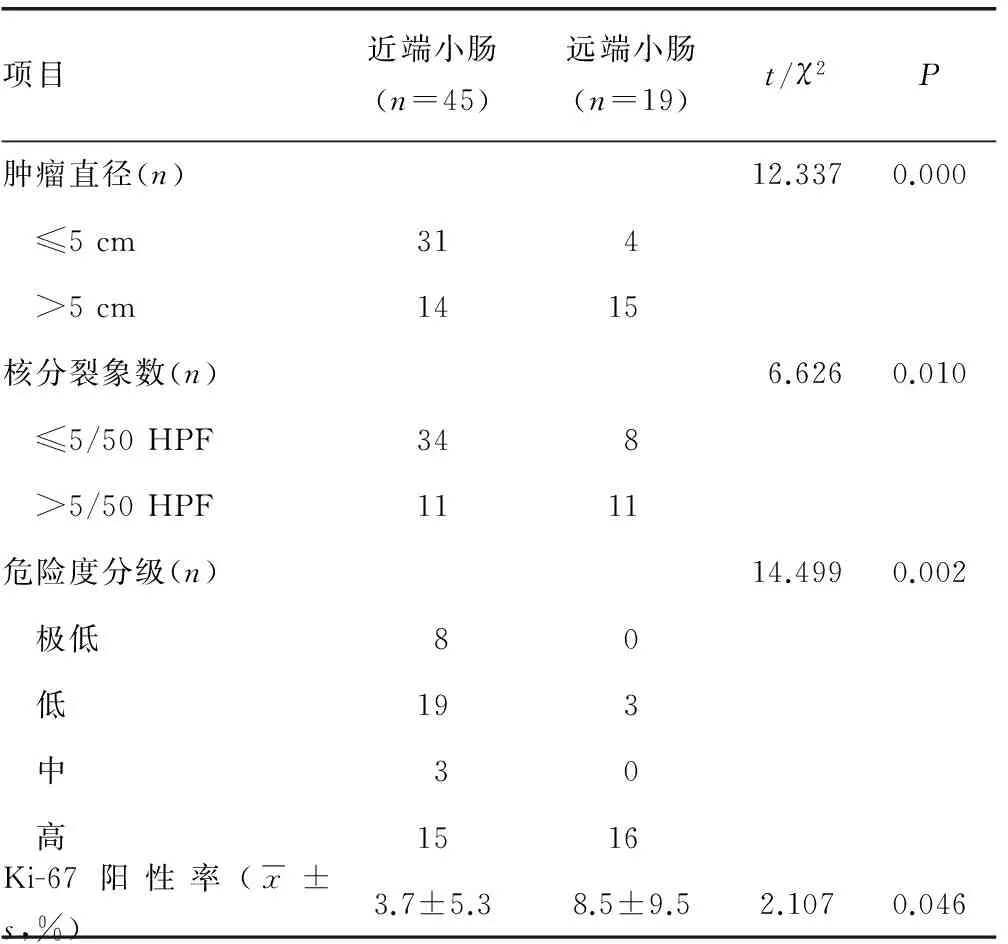
表4 近远端SIST与肿瘤直径、核分裂象数、肿瘤危险度、Ki-67阳性率关系
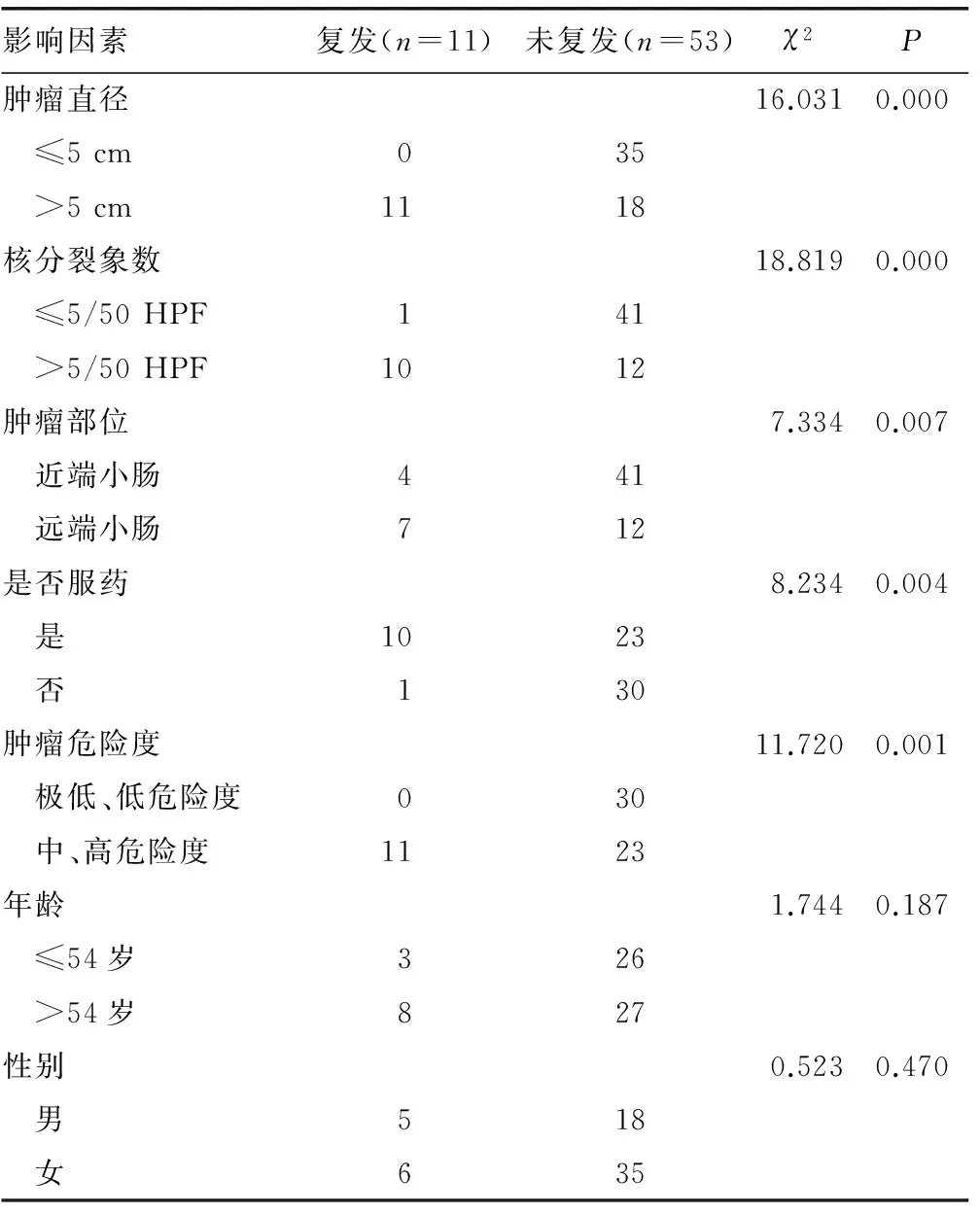
表5 各种因素与肿瘤复发的相关性(n)
通过门诊、住院及电话随访,本组64例患者均随访,无失访病例。30例极低、低危险度未口服IM患者,仅行动态影像学随访,中位随访时间17(8~51)个月,未见肿瘤复发及转移。除1例高危险度患者因个人原因未服用IM治疗外,其余中、高危险度患者均接受IM治疗,33例接受IM口服治疗的中、高危险度患者,中位随访时间24(11~55)个月,随访时间1~2年者16例,随访时间2~3年者8例,随访时间大于3年者9例。33例服药患者中有5例出现水肿、恶心、腹痛、血小板减少、皮疹等不良反应,但均可耐受。复发转移11例,其中3例在术后1年内复发转移,7例在术后2年内复发转移,1例在术后3年内复发转移。1例因个人原因未服IM治疗,于术后4个月复发,术后9个月病情恶化死亡;3例复发后停药,未再继续治疗,分别于停药3、6、7个月后死亡;3例再次手术,术后继续口服IM,2例带瘤生存,1例13个月后死于肿瘤复发转移;4例出现IM耐药,改服索坦(舒尼替尼),带瘤生存。肿瘤直径、核分裂象数、肿瘤部位、是否服用IM、肿瘤危险度等因素与肿瘤复发的相关性差异有统计学意义(P<0.05),性别、年龄与肿瘤复发的相关性差异无统计学意义(P>0.05),见表5。
3 讨 论
GIST是来源于消化道间叶组织的肿瘤,小肠是仅次于胃的GIST的第二好发部位,SIST恶性程度明显高于胃间质瘤。本组64例SIST患者中近端小肠45例(70.3%),其中距屈氏韧带1 m内空肠37例(57.8%),远端小肠19例(29.7%),近端小肠发病率高于远端小肠,且大多数为距屈氏韧带1 m内的空肠。SIST的临床表现缺乏特异性,消化道出血是SIST最常见的临床表现,本组患者中消化道出血30例,多表现为黑便或大便隐血阳性,主要是因为肿瘤来源于肌层,向内可侵及黏膜下层及黏膜固有层,于黏膜表面形成溃疡,可导致消化道出血[5],对于消化道出血原因不明的患者要考虑间质瘤的可能。其余临床表现可以为腹胀、腹痛、腹部包块、恶心呕吐等。由于SIST临床表现不典型,加之小肠疾病检查手段有限,早期诊断SIST较为困难。
目前对SIST的临床诊断主要依靠内镜及影像学检查,最终诊断需依靠组织病理学及免疫组织化学检查。各种内镜及影像学检查方法对于SIST的检出率取决于肿瘤部位、大小及生长方式[6]。本组病例中16例行胃十二指肠镜检查,3例提示SIST,诊断符合率18.8%,胃十二指肠镜是十二指肠降段及水平段SIST首选检查手段,但对于其他位置的间质瘤无效,故诊断符合率较低。近年来随着胶囊内镜及双气囊小肠镜的发展,内镜对SIST的诊断率大大提高。胶囊内镜作为一种小肠的无创检查手段,由于其费用较贵、易受肠道内情况干扰、不能反复检查、不能取活检、对较小孤立病灶检出能力有限等因素的限制,仅作为一种无创性筛查手段。双气囊小肠镜因其可操控性、图像清晰、可在内镜下进行活检及治疗、安全性好等优势,是目前临床上诊断SIST的常用方法[7]。腹部彩超由于分辨率较低、易受肠道内气体等因素的影响,本研究检出率为75%,诊断符合率为25%,检查效能较低。腹部螺旋CT检查操作简便、要求低且无创,检出率及诊断符合率均较高,本研究检出率为98.2%,诊断符合率为57.9%,在本组病例的各种检查方法中,螺旋CT是最有效的检查手段(P<0.05),螺旋CT的检出率及诊断符合率在近、远端SIST间差异无统计学意义(P>0.05)。本组64例患者中,肿瘤最大直径小于或等于5 cm者35例,肿瘤最大直径大于5 cm者29例,肿瘤核分裂象数小于或等于5/50 HPF者42例,核分裂象数大于5/50HPF者22例。近端SIST与远端SIST在肿瘤直径、核分裂象数、肿瘤危险度、Ki-67阳性率方面均存在差异(P<0.05),近端SIST大多直径小于或等于5 cm,核分裂象数小于或等于5/50 HPF,危险性较低。Ki-67可反映细胞分裂和增殖活性,辅助鉴别疾病的恶性程度,同时也被应用于定量分析肿瘤的生长分数、肿瘤的分级、增生程度及预后的预测,远端小肠间质瘤Ki-67阳性率高于近端小肠间质瘤,远端SIST恶性程度亦高于近端SIST[8]。
当前SIST的治疗主要依靠手术治疗和分子靶向治疗。对于未发生转移且可切除的SIST患者来说,手术切除是最重要的治疗方法[9],中国胃肠间质瘤诊断治疗共识(2013 年)中对手术适应证做了明确阐述。本文64例患者均接受手术治疗,52例行根治性切除术,12例行姑息性切除术,完整切除和切缘阴性是手术治疗SIST的基本原则,可有效地防止复发及转移。由于腹腔种植转移及血行转移至肝脏为SIST的常见转移方式,极少淋巴结转移,在SIST的手术治疗中,除非有明确淋巴结转移迹象,无需常规清扫淋巴结[10]。SIST包膜较薄,容易破裂,手术过程中应动作轻柔,保证包膜完整,避免由于包膜破裂导致的腹腔种植转移。SIST恶性程度较胃间质瘤高,且易复发转移,据统计术后复发转移率可高达85%[11],对传统放化疗不敏感。IM是一种选择性kit/PDGFRA受体酪氨酸激酶抑制剂,作为新一代的分子靶向治疗药物,为无法切除、复发或转移的GIST 患者带来希望[12]。目前普遍认为,对于中危患者,应至少给予IM辅助治疗1年,高危患者辅助治疗时间至少3年,发生肿瘤破裂患者,考虑延长辅助治疗时间[9]。肿瘤复发与肿瘤直径、核分裂象数、是否服用IM、肿瘤危险度、肿瘤部位等因素有关(P<0.05),肿瘤直径大、核分裂象数多、危险度高、远端小肠的患者容易复发转移,性别、年龄与肿瘤复发不存在相关性(P>0.05)。有文献[13]报道伊马替尼的初治耐药达12%,晚期耐药超过40%,中位时间为25个月。舒尼替尼是一类能够选择性地靶向多种受体酪氨酸激酶的新型药物,适用于GIST复发进展后的二线治疗或IM不能耐受的GIST的治疗[9]。由于SIST恶性程度高,易肝转移及腹腔内种植转移,专家认为极低危险度及低危患者每6个月随访1次盆、腹腔CT或MRI,持续5年;对中、高危患者,每3个月随访1次盆、腹腔CT或MRI,持续3年,3年后每6个月随访1次,直至5年[14]。手术联合分子靶向的新治疗模式使SIST患者从中获益,提高了患者生存率,但目前仍存在不良反应、价格昂贵、耐药等问题亟待解决。
[1]FLETCHER C D,BERMAN J J,CORLESS C,et al.Diagnosis of gastrointestinal stromal tumors:A consensus approach[J].Hum Pathol,2002,33(5):459-465.
[2]NEGREANU L M,ASSOR P,MATEESCU B A.Interstitial cells of Cajal in the gut -A gastroenterologist′s point of view[J].World J Gastroenterol,2008,14(41):6285-6288.
[3]张龙方,韩全利,汪娜,等.小肠间质瘤的超声表现及病理特征[J].解放军医学杂志,2009,34(3):342-344.
[4]JOENSUU H.Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J].Hum Pathol,2008,39(10):1411-1419.
[5]俞文渊,严冬华,王鹏.胃肠道间质瘤临床诊治及预后分析[J].实用临床医药杂志,2013,17(19):133-135.
[6]曾艳,梁浩.小肠间质瘤45例诊治分析[J].解放军医学杂志,2014,39(7):568-571.
[7]翁书强,唐文清,崔璨,等.小肠间质瘤(SIST)83例临床诊治分析[J].复旦学报(医学版),2013,40(6):729-732,751.
[8]JIANG J,JIN M S,SUO J,et al.Evaluation of malignancy using Ki-67,p53,EGFR and COX-2 expressions in gastrointestinal stromal tumors[J].World J Gastroenterol,2012,18(20):2569-2575.
[9]沈琳,李健,秦叔逵,等.中国胃肠间质瘤诊断治疗共识(2013年版)[J].临床肿瘤学杂志,2013,18(11):1025-1032.
[10]REICHARDT P,REICHARDT A.Gastrointestinal stromal tumour (GIST):current standards in multimodal management[J].Zentralbl Chir,2011,136(4):359-363.
[11]NEUHAUS S J,CLARK M A,HAYES A J,et al.Surgery for gastrointestinal stromal tumour in the post-imatinib era[J].ANZ J Surg,2005,75(3):165-172.
[12]GRIGNOL V P,TERMUHLEN P M.Gastrointestinal stromal tumor surgery and adjuvant therapy[J].Surg Clin North Am,2011,91(5):1079-1087.
[13]BAYRAKTAR U D,BAYRAKTAR S,ROCHA-LIMA C M.Molecular basis and management of gastrointestinal stromal tumors[J].World J Gastroenterol,2010,16(22):2726-2734.
[14]中华医学会外科学分会胃肠外科学组.胃肠间质瘤规范化外科治疗专家共识[J].中国实用外科杂志,2015,35(6):593-598.

