CVP动态变化结合E/A对早期脓毒症患者预后评估的价值*
魏桂芳,常银江,杨宵曼,杜玉明
(1.河南省濮阳市人民医院重症医学科 457000;2.郑州大学附属第一医院重症医学科 450000)
脓毒症(sepsis)是一种全身多器官功能疾病,导致全身多器官功能障碍,病死率极高,成为危重病患者重要的死因之一[1-2]。心脏是脓毒症损伤的重要靶器官,而心肌是最易损伤的组织[3],研究证实脓毒症造成的心肌损害及肺动脉高压会造成中心静脉压(central venous pressure,CVP)以及舒张功能的异常[4]。CVP过去是评估危重病患者容量状态的指标,目前已证实CVP与患者容量反应性的相关性差[5],但仍不清楚CVP动态观测是否可作为脓毒症患者预后评价的指标。心脏超声技术是目前临床应用最广泛的评价左心室舒张功能的技术,脉冲多普勒法记录的二尖瓣扩张早期的血流速度与心房收缩期峰值血流速度的比值(E/A),是观测心脏舒张功能的重要指标,随着床旁重症超声的普及而成为评估重症及脓毒症患者心脏功能的重要指标,为了探究有关心脏舒张功能与脓毒症的预后关系的指标,特设计进行本研究,旨在探讨CVP动态变化(△CVP)结合E/A对脓毒症患者预后评估的价值。
1 资料与方法
1.1一般资料 选取2013年1月至2016年6月濮阳市人民医院重症医学科收治的行CVP监测同时行床旁超声容量评估及E/A检测的脓毒症患者。
1.1.1入选标准 脓毒血症患者符合2012年国际严重脓毒症和脓毒性休克治疗指南中的脓毒症诊断标准[6]:在感染的基础上,增加了全身一般表现、血流动力学参数、炎症参数、器官功能不全参数、组织灌注参数等。
1.1.2排除标准 (1)急性心肌炎、急性心肌梗死;(2)心包疾病、先天性心脏病、心脏瓣膜病、梗阻性肥厚型心肌病、限制性心肌病;(3)严重肝、肾衰竭;(4)肺动脉高压、肺源性心脏病;(5)甲状腺功能亢进、甲状腺功能减退、Cushing 综合征等内分泌系统疾病;(6)恶性肿瘤以及其他严重影响CVP测定、心脏舒张功能超声测定的疾病。所有入选者均由本人或其直系亲属签订知情同意书,研究通过濮阳市中心医院伦理委员会审查批准。
1.2方法
1.2.1CVP检查 所有入重症医学科的患者入科时,平卧位沿右颈内静脉置入中心静脉导管,连接压力换能器,并与监护仪连接,调零后检测CVP记录当时的数值,6、24 h后的数值,分别记为h0,h6,h24,每个测量值均连续测量3次,取平均值,计算其动态变化值,取其绝对值前6 h记为Δh1,前24 h为Δh2。
1.2.2超声心动图检查 超声心动图检查仪器:Philips iE33彩色多普勒超声显像仪,S5-1 探头(频率为1.7~3.4 MHz) 。左室长轴切面采用M型超声测量收缩末期左房内径(LAD),室间隔厚度(IVST)、左室后壁厚度(LVPWT);心尖四腔切面采用Simpson 法测量左心室射血分数(LVEF)。脉冲多普勒测量包括二尖瓣E、A,计算E/A比值。每个测量值均连续测量3次,分别记录入科时(H0),6 h后(H1),24 h后(H24)取平均值。
1.2.3其他指标 (1)患者一般临床特征:年龄、性别;(2)急性生理学与慢性健康状况评分系统Ⅱ(APACHE Ⅱ)评分;(3)序贯器官衰竭(SOFA)评分;(4)28 d病死率。

2 结 果
2.1入选两组患者一般临床特征及比较 2013年1月至2016年6月之间在濮阳市人民医院重症医学科收治的行CPV监测同时行床旁超声容量评估及E/A检测的脓毒症患者315例,剔除病历资料不全者25例,排除基础心脏瓣膜疾病患者57例,最终纳入符合条件患者共233例。其中男126例,女107例;年龄30~88岁,平均(58.68±16.41)岁。这些患者28 d存活122例(存活组),生存率为52.4%,死亡111例(死亡组),死亡率为47.6%。存活组和死亡组基线资料具有可比性,其中性别、年龄、感染来源、机械通气时间比较差异无统计学意义(P>0.05),但入住ICU时间、APACHEⅡ和SOFA评分差异有统计学意义(P<0.05),存活组APACHEⅡ、SOFA评分均低于死亡组(表1)。
2.2死亡组与存活组的ΔCVP的动态变化 存活组的ΔCVP之Δh1和Δh2比死亡组增高,组间差异有统计学意义(P<0.05),见表2。
2.3死亡组与存活组E/A的比较 存活组的E/A之H0、H6比死亡组增高,组间差异有统计学意义(P<0.05),见表3。

表1 存活组和死亡组入组时一般基线资料比较
*:χ2值;APTT:活化部分凝血酶原时间;MAP:平均动脉压

表2 存活组和死亡组ΔCVP的比较
2.4对预后评价的ROC曲线分析 对入科第1天的APACHEⅡ评分、SOFA评分,入科时CVP、Δh1、Δh2、CVP数值以及E/A、H0、H6、H24的曲线下面积分别为0.761、0.690、0.558、0.778、0.705、0.792、0.818、0.693,H6结合Δh1曲线下面积分别为0.844(P<0.01),H24结合Δh2的曲线下面积为0.737(P<0.01),见表4、图1。
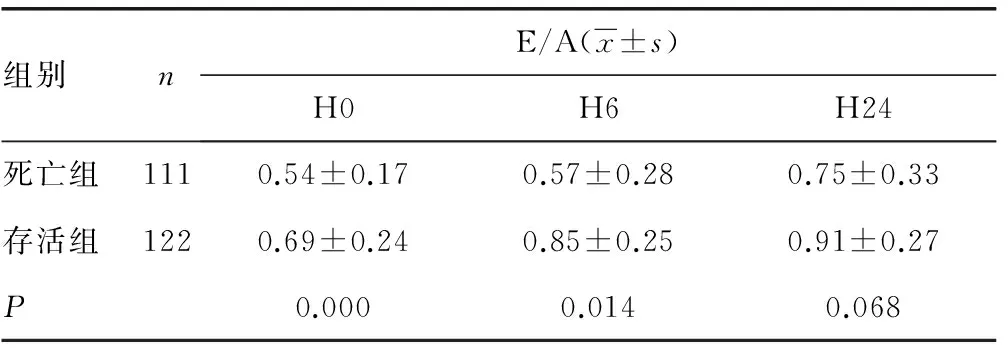
表3 存活组和死亡组E/A的比较
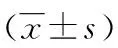
表4 患者预后评价的ROC曲线分析
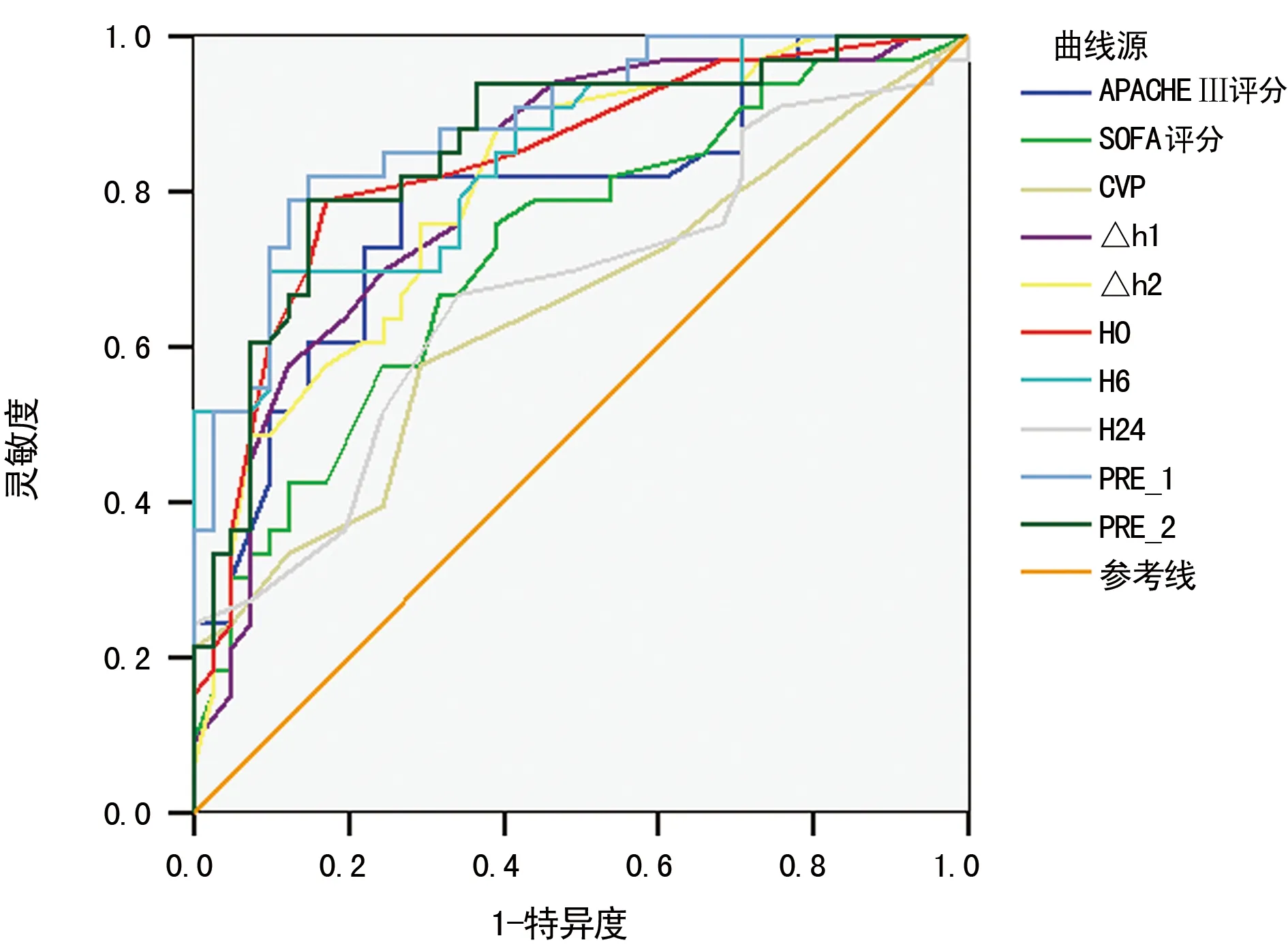
图1 患者预后评价的ROC曲线
3 讨 论
近年来心脏舒张功能在脓毒症的发病过程中越来越受到重视,CVP最早成为重症患者容量反应性的重要指标,但近来越来越多的研究证明,CVP绝对值与患者的容量反应性的相关性差[7-8],不能作为评价容量反应性的指标。CVP作为直接测量右房压力的指标,理论上可以间接反映患者的心脏舒张功能,近期相关的研究[9]发现动态监测ΔCVP可以反映患者心脏功能变化,特别是舒张功能,而研究已经显示心脏的舒张功能是脓毒症预后评价的重要指标之一。本研究发现入科时CVP,以Δh2的截断点分别取12.5、6.58 mm Hg时的ROC曲线下面积分别为0.558、0.705,对预后评价的效果较差,而Δh1时即入科6 h后截断值取5.61 mm Hg时,ROC曲线下面积为0.778,对预后的预测强度优于同时期的APACHEⅡ评分及SOFA评分,对于预后的评估较传统评分具有较高的准确性及可靠性,有利于早期评估病情,制订合理的治疗方案,Δh1与脓毒症死亡相关度高、预测病情严重程度准确度高,CVP作为重症医学科一个常见的监测指标,其简单易用、可操作性强,且成本较低。这显示了Δh1可作为脓毒症的一个新的评价指标,其临床价值值得深入研究。
诊断心脏舒张功能的金标准为超声心动图。床旁超声作为近年来重症医学科常用检查手段,具有无创、迅速、可靠性好等特点,在评估容量反应性及诊断方面有着重要的优势,E/A作为传统的测量心脏舒张功能的重要指标,在近年来越来越受到重视。STURGESS等[10]研究显示,舒张功能障碍是死亡的独立预测因子,E/A作为临床上较为常用测量心脏舒张功能的指标,相较有创的血流动力学指标,具有成本低廉、测量迅速、无创等优点。本研究显示心脏的舒张功能障碍与患者预后相关;但鉴于心脏超声所测的E/A受心脏某些因素的影响,本研究排除了急性心肌炎、急性心肌梗死、心包疾病、先天性心脏病、心脏瓣膜病、梗阻性肥厚型心肌病、限制性心肌病、严重肝肾衰竭、肺动脉高压、肺源性心脏病等严重影响患者E/A测量的疾病。本研究显示入科时即H0时、H6时两组E/A存在一定差异,H24时差异无统计学意义,可能与早期脓毒症心脏功能舒张障碍有关;研究显示这种舒张功能障碍是一种急性可逆的反应,其本质不是心肌缺血,不受血管活性药影响[11-12]。本研究显示在H0、H6时截断值为0.68、0.75时,ROC曲线下面积分别为0.792、0.818,对预后的评估优于APACHEⅡ评分及SOFA评分,可以作为预后评判的一个独立指标,为早期评判病情提供线索。而在H6时预后评价的效果最好,考虑可能与患者6 h系统目标导向治疗(EGDT)后,患者心脏功能有所恢复,心脏从应激性状态中恢复,心脏的功能有所恢复有关。尽管最近EGDT饱受质疑,但是脓毒症治疗早期6 h,是脓毒症患者治疗黄金时间[13]。相关的文献证明早期积极合理的干预,可以改善患者的预后,降低患者的病死率。患者H24时,存活组与死亡组E/A没有明显的统计学差异,同时对患者预后评价作用较弱,可能与患者早期干预后治疗反应性较差、患者心肌受到进一步的损伤、心脏舒张功能改善不完全有关。但是E/A的测量受操作者主观因素以及心脏本身的情况以及体位等因素影响较大,结合ΔCVP能够更客观地估计患者病情减少的主观因素及干扰因素对患者病情的影响,本研究显示,Δh1与H6的E/A值联合双变量的ROC曲线下面积为0.844,Δh2与H24的E/A的联合双变量的ROC曲线下面积为0.737,Δh1与H6的E/A值联合双变量预测患者预后的强度最高,高于同期的本文其他观测指标;这两个指标简单易得,相较于其他预后评价的指标,包括繁琐的APACHEⅡ评分及SOFA评分,具有简单、可操作性强等特点,可以对患者病情及预后进行初步的评估指导患者进行下一步的治疗。
综上所述,脓毒症引起的舒张功能障碍越来越引起重视[14],作为传统的监测手段,CVP在预测重症患者的容量反应性方面越来越受到质疑,有研究证实CVP的动态变化可以反映容量反应性[15]。本研究并没有对容量反应性进行研究,本研究显示CVP动态变化值特别是在早期Δh1可以对患者的预后做一个初步的评估;H6时患者的E/A可以作为预后评价的重要指标,具有较好的敏感性与特异性;相关的观测指标中h6结合Δh1对预后评估的强度最大,敏感性与特异度较好,可作为早期病情评估重要的指标。
不足之处,本研究床旁超声受患者体位以及患者体表脂肪厚度、观测者主观水平影响,即使是同一患者相关的测量指数变化较大。另外本研究进一步推广依赖大规模的临床研究。
[1]KEEGAN J,WIRA C R 3rd.Early identification and management of patients with severe sepsis and septic shock in the emergency department[J].Emerg Med Clin North Am,2014,32(4):759-776.
[2]GAIESKI D F,EDWARDS J M,KALLAN M J,et al.Benchmarking the incidence and mortality of severe sepsis in the United States[J].Crit Care Med,2013,41 (5):1167-1174.
[3]WENCESLAU C F,MCCARTHYY C G,SZASZ T,et al.Mitochondrial N-formyl peptides induce cardiovascular collapse and sepsis-like syndrome[J].J Physiol Heart Circ Physiol,2015,308 (7):H768-777.
[4]BULL T M,CLARK B,MCFANN K,et al.Pulmonary vascular dysfunction is associated with poor outcomes in patients with acute lung injury[J].Am J Repsir Crit Care Med,2010,182(9):1123-1128.
[5]MAGDER S.Value of CVP:an epidemiological or physiological question?[J].Int Care Med,2016,42(3):458-459.
[6]DELLINGERR P,LEVY M M,RHODES A,et al.Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock:2012[J].Crit Care Med,2013,41(2):580-637.
[7]MARIK P E.Fluid responsiveness and the six guiding principles of fluid resuscitation[J].Crit Care Med,2016,44(10):1920-1922.
[8]ESKESEN T G,WETTERSLEV M,PEMER A.Systematic review including re-analyses of 1148 individual data sets of central venous pressure as a predictor of fluid responsiveness[J].Intens Care Med,2016,42(3):1-9.
[9]JOZWIAK M,PERSICHINI R,MONNET X,et al.Management of myocardial dysfunction in severe sepsis[J].Semin Respir Crit Care Med,2011,32(2):206-214.
[10]STURGESS D J,MARWICK T H,JOYCE C,et al.Prediction of hospital outcome in septic shock:a prospective comparison of tissue Doppler and cardiac biomarkers[J].Critical Care,2010,14(2):R44.
[11]ZHANGZ,XIAOX,SHENGY,etal.Ultrasonographicmeasurementoftherespiratoryvariation
in the inferior vena cava diameter is predictive of fluid responsiveness in critically ill patients:Systematic review and meta-analysis[J].Ultrasound Med Biol,2014,40(5):845-853.
[12]BISWAS A.Preventing the development of acute cor pulmonale in patients with acute respiratory distress syndrome:the first step[J].Ann Transl Med,2016,4(7):146.
[13]ANGUS D C,van der POLL T.Severe sepsis and septic shock[J].N Engl J Med,2013,369(9):840-851.
[14]ROLANDO G,ESPINOZA E D,AVID E,et al.Prognostic value of ventricular diastolic dysfunction in patients with severe sepsis and septic shock[J].Rev Bras Ter Intensiva,2016,27(4):219-224.
[15]SARLAK H,TANNSEVEN M,DURAN E.Fluid management dilemma in severe sepsis and septic shock patients[J].Am J Emerg Med,2015,33(9):1311-1312.

