酿酒酵母制备固态发酵饲料的参数优化及品质评价
孙 宏,李园成,吴逸飞,沈 琦,姚晓红,汤江武,王 新
(浙江省农业科学院植物保护与微生物研究所,浙江杭州 310021)
固态发酵饲料是一种利用有益微生物对饲料原料进行固态发酵处理,获得含有活性益生菌、酶、矿物质和多种未知促生长因子等活性组分的高品质生物饲料[1]。单一原料的固态发酵饲料(如发酵豆粕、发酵棉籽粕、发酵菜籽粕等)中含有低分子量多肽、寡糖、有机酸(丁酸)等活性物质[2-4];同时固态发酵处理可降解这些饲料原料中的抗营养成分,提高其消化率,从而显著提高其营养品质[3-4]。动物试验也证实饲喂固态发酵饲料可显著提高动物的生长性能,改善动物肠道消化功能和健康水平[3]。
近年来,固态发酵饲料的研究逐渐转向对多种混合饲料原料的发酵处理。酿酒酵母是最为常见的发酵菌株,其不但富含齐全的营养物质,且经酵母菌发酵过的饲料也具有独特的色、香、味,饲料适口性得到显著改善[5-6]。目前,有关采用酵母菌制备固态发酵饲料的工艺参数的报道较少,特别是现有工艺主要通过单因素、正交试验分析,缺乏对多种发酵参数交互作用的评价。本试验拟以酵母菌为发酵菌株,对发酵原料的组成、糖化酶添加量、接种量等参数进行优化,并采用响应面设计确定最佳发酵工艺,对发酵后的饲料进行初步营养评价,以期为酵母菌制备固态发酵饲料提供合理应用技术参数。
1 材料与方法
1.1 发酵原料与菌株 玉米、豆粕和麸皮均购自绍兴科盛饲料有限公司。玉米含水率12.2%、粗蛋白含量8.6%;豆粕含水率9.4%、粗蛋白含量47.2%;麸皮含水率10.5%、粗蛋白含量19.3%。发酵前原料粉碎过40目筛备用。
酿酒酵母(Saccharomyces cerevisiae)Yn由浙江省农业科学院植物保护与微生物研究所酶与发酵工程实验室选育和保藏。
1.2 试剂及培养基 糖化酶购于北京索莱宝科技有限公司,酶活大于1.0×105U/g;羧苄青霉素、葡萄糖、麦芽糖、硫酸铵、蛋白胨、酵母浸粉和尿素均为市售分析纯。酿酒酵母Yn培养基为马铃薯培养基(PDA):马铃薯(去皮)200 g、葡萄糖20 g、水1 000 mL、自然pH,121℃灭菌30 min;固体培养基加入1.5%的琼脂粉;使用前加入羧苄青霉素,使其最终浓度达100 μg/ mL。
1.3 固态发酵饲料的制备
1.3.1 酿酒酵母Yn发酵种子液的制备 取酵母菌Yn斜面刮取一环接种于含有20 mL PDA液体培养基的50 mL三角瓶中,放入30℃ 摇床培养箱中180 r/min培养24 h,制成种子液(平板计数菌数为3.1×108CFU/mL),备用。
1.3.2 不同发酵底物比例对发酵饲料中酵母菌数的影响发酵底物为玉米、豆粕和麸皮以不同质量比(4:2:4、5:2:3、6:2 :2、7:2 :1和8:2:0)混合的原料100 g,将上述原料混匀后,装入500 mL三角瓶中,接种5%(v/w)酿酒酵母Yn后,加水控制料水比至1:0.8(w/w),自然pH,放置于30℃培养36 h。发酵完毕后,取样采用涂布平板法测定酵母菌活菌数(CFU/g,以干质量计),每组3个重复。
1.3.3 不同糖化酶添加量对发酵饲料中酵母菌数的影响初始发酵底物为玉米、豆粕和麸皮(质量比为5:2:3)混合的原料100 g,底物混合均匀后加入终浓度分别为0、200、400、600、 800 U/g的糖化酶,其余操作同1.3.2,确定不同糖化酶添加量对发酵饲料中酵母菌数的影响。
1.3.4 不同接种量对发酵饲料中酵母菌数的影响 初始发酵底物为玉米、豆粕和麸皮(质量比为5:2:3)混合的原料100 g,糖化酶的添加量为200 U/g,酵母菌Yn接种量(v/w)分别为3%、5%、8%、10%,其余操作同1.3.2,确定不同接种量对发酵饲料中酵母菌数的影响。
1.3.5 不同料水比对发酵饲料中酵母菌数的影响 糖化酶的添加量为200 U/g,接种量为5%(v/w),料水比(w/w)分别为1:0.6、1:0.8、1:1和1:1.2,其余操作同1.3.4,确定不同料水比对发酵饲料中酵母菌数的影响。
1.3.6 不同发酵温度对发酵饲料中酵母菌数的影响 初始发酵底物为玉米、豆粕和麸皮(质量比为5:2:3)混合的原料100 g,糖化酶添加量为200 U/g,料水比为1:0.8(w/w),分别于 25、28、30、35、37℃ 下恒温发酵36 h,其余操作同1.3.4。
1.3.7 响应面试验优化发酵条件 根据单因素试验结果,选取影响显著的接种量、料水比以及加酶量进行响应面分析,试验设计和分析通过Design-Expert.v8.0.6软件完成,每个因素设置3个编码水平,以酵母菌Yn在固态发酵饲料中的活菌数为响应值(酵母菌的浓度转化成对数),试验因素水平和编码见表1。每个处理设置3个重复。

表1试验因素水平与编码表
1.3.8 酵母菌Yn制备固态发酵饲料的最适条件验证采用响应面试验所获得的最佳发酵条件进行发酵饲料制备。为了避免水分对菌数计数的影响,发酵后一部分取样直接采用涂布平板法测定酵母菌活菌数(CFU/g,以干质量计)[6],另一部分样品放置于50℃条件下烘干,粉碎过60目筛待测饲料营养成分。
1.4 指标测定方法 水分、粗蛋白、粗脂肪、总磷、低分子肽、总酚和维生素B2含量的检测均参照文献[7]的报道。
1.5 统计分析 数据采用SPSS 13.0 统计软件进行单因子方差分析(ANOVA),组间多重比较采用Duncan´s分析,结果以平均值±标准差表示。
2 结果与分析
2.1 不同发酵底物比例对发酵饲料中酵母菌数的影响由图1可见,随着发酵底物中玉米添加量的增加和麸皮添加量的减少,酵母的活菌数先升后降,在玉米、豆粕和麸皮质量比为5:2:3时,酵母活菌数最高,达到6.5×109CFU/g(干重)。当玉米添加量继续增加时,酵母活菌数降低。因此,玉米、豆粕和麸皮的适宜质量比为5:2:3。

图1 不同发酵底物比例对发酵饲料中酵母菌数的影响
2.2 不同糖化酶添加量对发酵饲料中酵母菌数的影响添加糖化酶可将玉米中的淀粉转化为糖类物质,供酵母菌体的生长和繁殖。由图2可知,添加糖化酶对酵母菌数提高的效果明显,当添加量达200 U/g时菌数最高,为8.8×109CFU/g,之后效果趋于平缓。考虑到成本因素,选取200 U/g为糖化酶的最适添加量。

图 2 不同糖化酶添加量对发酵饲料中酵母菌数的影响
2.3 不同接种量对发酵饲料中酵母菌数的影响 由图3所示,接种量为5%时,酵母菌数最高,达到1.15×1010CFU/g。因此选取酵母菌Yn的最适接种量为5%。
2.4 不同料水比对发酵饲料中酵母菌数的影响 由图4可知,料水比为1:0.8时,酵母菌数最高,为1.18×1010CFU/g。同时,不同料水比对固态发酵后酵母菌活菌数的影响较大,在本试验条件下的最适料水比为1:0.8。

图3 不同接种量对发酵饲料中酵母菌数的影响
2.5 不同发酵温度对发酵饲料中酵母菌数的影响 由图5所示,随着发酵温度增加,酵母菌数也升高,在30℃时酵母菌数最高,达到9.81×109CFU/g。之后随着温度增加,菌数逐渐下降,因而选取30℃为最适发酵温度。
2.6 响应面模型的建立与显著性分析 为了获得更为准确的酵母菌制备发酵活性饲料的参数,结合上述单因素试验结果,选取了接种量、加酶量和料水比进行Box-Behnken响应面设计,以活菌数为响应值进行寻优,结果如表2所示。

图4 不同料水比对发酵饲料中酵母菌数的影响

图5 不同发酵温度对发酵饲料中酵母菌数的影响
由多元线性和二项式拟合得到各因素对应酵母活菌数的数学模型:lnY=4.8-0.017A+0.071B-0.055C+8.894E-004AB+9.789E-003AC-0.059BC-0.011 A2-0.2B2-0.24C2,决定系数R2= 0.949 6。由方差分析可知(表3),模型P值为0.000 9,失拟项P值为0.123 4,说明此模型数据可靠,回归方程可满足对结果的分析和预测。对各因素的显著性分析可知,加酶量、料水比对固态发酵后酵母菌数的影响显著(P<0.05)。
由图6可知,在不同接种量、加酶量和料水比下,酵母活菌数都出现先增后减的趋势。通过软件获得最佳条件:接种量1.4%、加酶量220 U/g、料水比1:0.8,理论活菌数可达到1.24×1010CFU/g(干重)。
2.7 酵母菌Yn制备固态发酵饲料的最适条件验证 由表4可知,原料经过酵母菌固态发酵后,酵母活菌数折算干重达到1.30×1010CFU/g,与响应面预测值相比误差仅为4.83%。同时,粗蛋白、总酚、维生素B2和低分子量肽含量在发酵后显著提高(P<0.05),而粗脂肪含量则显著降低(P<0.05)。发酵处理对物料中总磷的含量没有影响(P>0.05)。
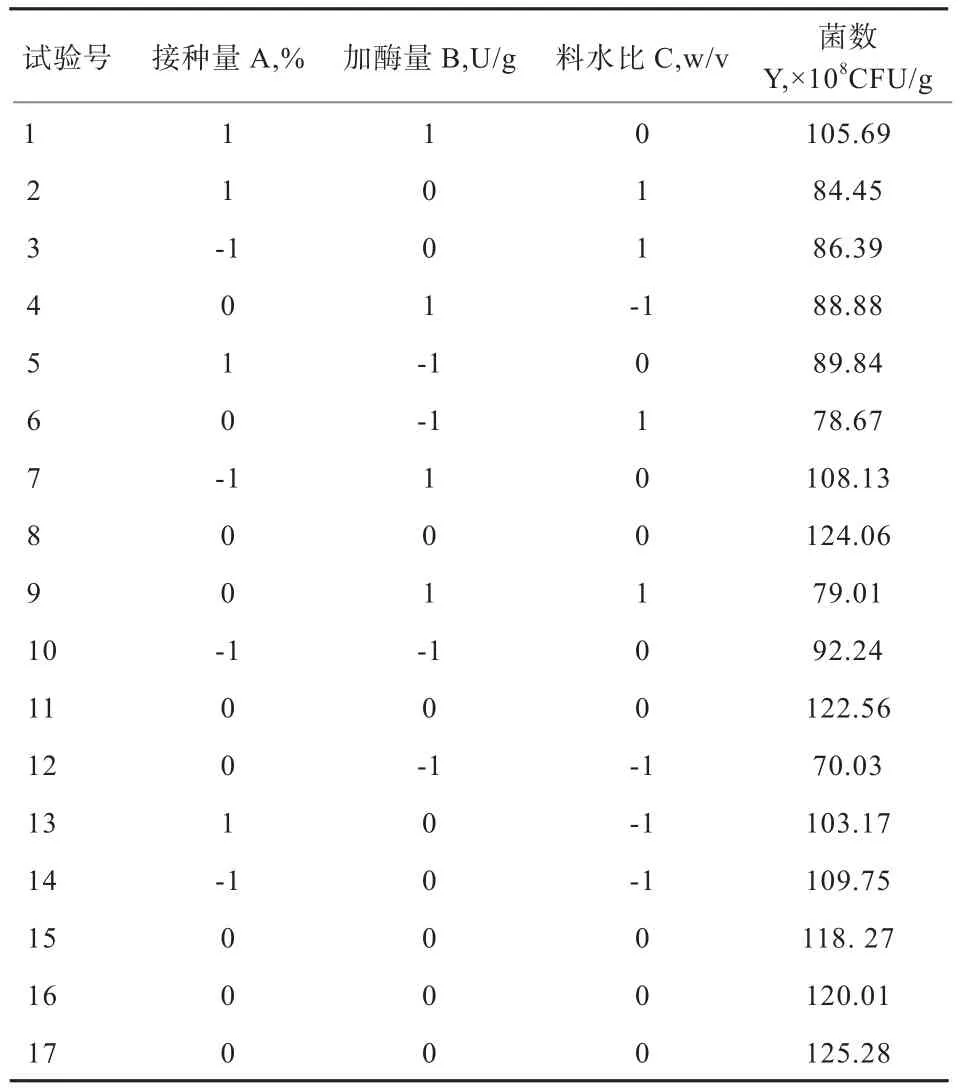
表2 发酵条件的响应面优化结果
3 讨 论

图6 接种量、加酶量和料水比的响应面图与等高线图
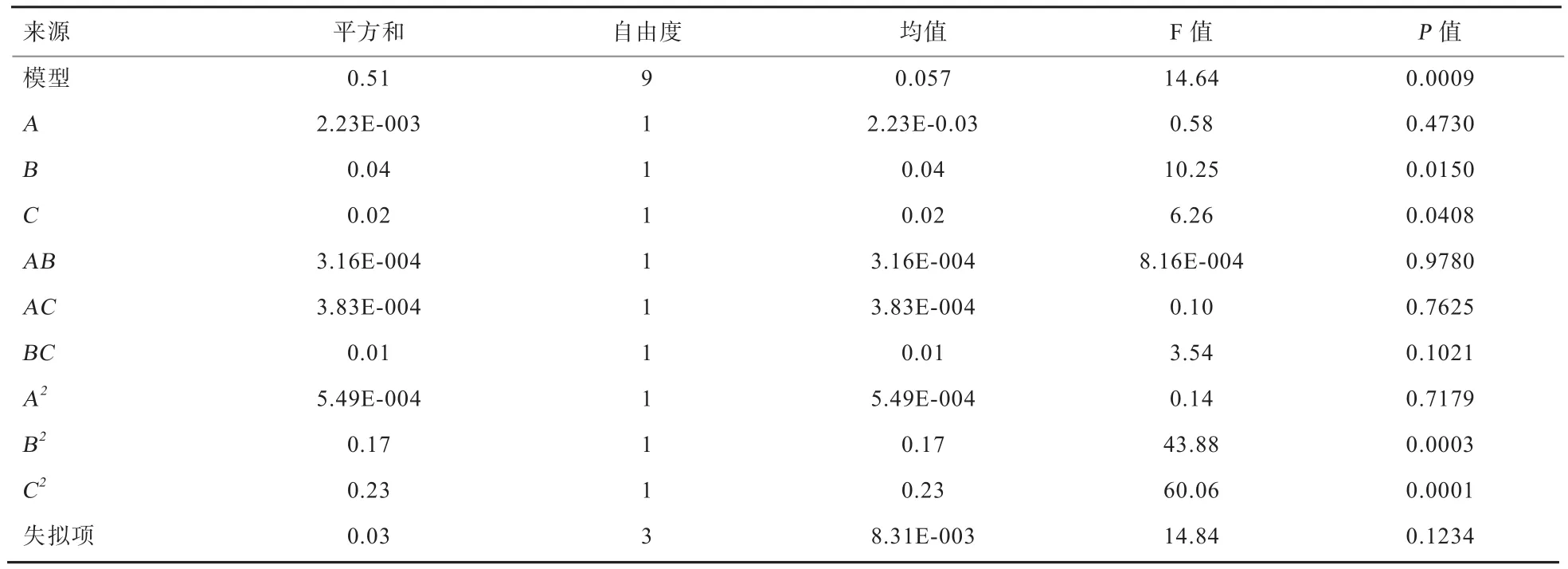
表3 响应面模型的方差分析

表4 最优条件下发酵前后饲料中营养成分的含量分析
3.1 不同发酵底物与发酵条件对发酵饲料中酵母菌数的影响 研究表明,固态发酵的程度与发酵底料中的可利用碳源含量直接相关[8]。玉米的含糖量显著高于麸皮,因而初期随着玉米添加量的提高,菌数呈不断增加的趋势。但粉碎的玉米在发酵过程中黏度较大,同时随着玉米的增加麸皮的比例会有所下降,从而减少了物料的通气性,导致本试验中酵母菌数因玉米含量过高而下降。赵国群等[9]研究表明,固态发酵中添加麸皮可降低培养基的含水率,增加物料氧气供给,而且改善培养基的营养。本研究结果表明,发酵基质中玉米、豆粕和麸皮的最佳质量配比为5:2:3。另一方面,糖化酶的加入可提高物料中可溶性糖类的含量,从而提高发酵基质中碳源的含量。本研究显示,最适宜的糖化酶添加量为200 U/g,该结果与潘丽娜等[6]添加300 U/g糖化酶用于酵母菌发酵糖渣的结果相似。同时,本研究结果表明酵母菌合适的添加量为5%,有研究表明过高的接种量可能会导致微生物的生长处于竞争状态,不利于菌体生长;同时接种量过小会导致固态发酵时启动较慢,增加污染杂菌的几率,也不利于酵母菌生长[10]。料水比是固态发酵中的一个重要因素,通过影响菌种与发酵基质的附着来影响发酵的效果[8]。一般认为酵母菌固态发酵含水率在50%~60%为宜[11],本研究结果与此一致。本研究结果还显示,较为适宜的发酵温度为30℃,而有研究报道酵母菌固态发酵秸秆、淀粉和豆粕为主的基质时最佳温度为28℃[12],这可能与发酵底料中营养成分的不同有关。
3.2 最佳发酵条件的确定 响应面优化所获得的回归方程精度较正交优化手段相比,由于考虑了不同因素间的相互作用,因而精度更高[10,13]。黎继烈等[10]通过响应面设计优化了油茶粕固态发酵枯草芽孢杆菌的发酵条件后发现,活菌数较优化前可提高5倍,达到2.04×1010CFU/g(干重)。施俊风等[14]采用响应面法获得酵母液态发酵的最佳条件为温度26℃、接种量1.2%,验证所测浓度为2.56×109CFU/mL。以上结果提示,不同的发酵方式可能对酵母菌发酵后的数量具有直接影响。潘丽娜等[6]在黄酒糟固态发酵生产酵母菌的研究中,通过正交试验对酵母菌数进行优化,获得最高菌数为4.0×109CFU/g(干重)。而本试验通过优化获得的最大酵母菌数达到1.30×1010CFU/g(干重),且与响应面预测最大值较为接近,表明该优化手段在本试验中科学可行。
3.3 酵母菌固态发酵后饲料营养品质的评价 本试验结果显示,采用酵母菌固态发酵后,饲料组分中粗蛋白、低分子量肽、总酚和维生素B2的含量均有显著提高,表明通过酵母菌发酵可改善饲料的营养组成。一般认为,物料中粗蛋白含量提高可能与发酵过程中微生物优先利用糖分,从而使发酵后物料损耗,总质量减少而间接提高其他营养组分有关[2],如Sharawy等[3]发现,采用酿酒酵母发酵豆粕后可显著提高发酵豆粕的粗蛋白含量。低分子量肽含量的提升是由于微生物在发酵过程中分泌的蛋白酶对物料中的蛋白进行降解所致[5]。张连忠[11]研究发现,酵母菌发酵玉米秸秆等农副产品可显著提高发酵后物料的粗蛋白含量至10.5%,同时酵母在发酵过程中能够将反应物中小分子肽含量提高222.86%。Chi等[5]同样在采用酿酒酵母发酵豆粕后发现,低于5 ku的低分子肽含量显著提高。总酚和维生素B2是2类生物活性物质,这些物质含量的提高可能与酵母在固态发酵过程中分泌氨基酸和多种生物活性物质有关[15],但具体机制仍需进一步研究。此外,本试验还发现饲料中的粗脂肪含量在酵母菌发酵后显著降低,这与吴逸飞等[9]的结果一致,可能是微生物利用了物料中的脂肪进行生长。
4 结 论
本试验条件下,确定了酿酒酵母Yn制备发酵饲料的合适参数:玉米、豆粕和麸皮质量比为5:2:3、接种量1.4%、加酶量220 U/g、料水比为1:0.8,发酵温度30℃。在此条件下,酵母活菌数折算干重达到1.30×1010CFU/g,粗蛋白、总酚、维生素B2和低分子量肽含量在发酵后显著提高,而粗脂肪含量则显著降低。因此,本试验获得的发酵参数在饲料发酵方面具有较好的应用前景。
参考文献:
[1] Longo M A, Deive F J, Domínguez A,et al. Solid-state fermentation for food and feed application[A]. In: Pandey A,Soccol C R, Larroche C. ed. Current Developments in Solidstate Fermentation[C]. New York: Springer Press, 2008, 379-411.
[2] Sun H, Tang J W, Yao X H,et al. Improvement of the nutritional quality of cottonseed meal by Bacillus subtilis and the addition of papain[J]. Int J Agr Biol, 2012, 14(4): 563-568.
[3] Sharawy Z, Goda A M S, Hassaan M S. Partial or total replacement of fish meal by solid state fermented soybean meal with Saccharomyces cerevisiae in diets for Indian prawn shrimp, Fenneropenaeus indicus, Postlarvae[J]. Anim Feed Sci Tech, 2016, 212(3): 90-99.
[4] Shi C Y, He J, Yu J,et al. Solid state fermentation of rapeseed cake with Aspergillus niger for degrading glucosinolates and upgrading nutritional value[J]. J Anim Sci Biotechnol, 2015,6(1): 13-20.
[5] Chi C H, Cho S J. Improvement of bioactivity of soybean meal by solid state fermentation with Bacillus amyloliquefaciens versus Lactobacillus spp. and Saccharomyces cerevisiae[J].LWT-Food Sci Technol, 2016, 68: 619-625.
[6] 潘丽娜. 黄酒糟固态发酵生产酵母培养物的研究[D]. 武汉:华中农业大学, 2013.
[7] 吴逸飞, 孙宏, 李园成, 等. 微生物固态发酵饲料的营养特性分析研究[J]. 浙江农业学报, 2016, 28 (12) : 2014-2020.
[8] 蔡昌凤, 杨茜, 方剑平, 等. SRB固态发酵条件优选及动力学方程建立[J]. 环境工程学报, 2014, 8(11): 4586-4592.
[9] 赵国群, 牛梦天, 卢士康, 等. 梨渣固态发酵培养多粘类芽孢杆菌的工艺[J]. 农业工程学报, 2016, 32(7): 303-308.
[10] 黎继烈, 胡铁, 崔培梧, 等. 油茶粕产枯草芽孢杆菌发酵条件优化[J]. 中国粮油学报, 2014, 29(1): 52-60.
[11] 张连忠. 酵母固态发酵过程中营养物质变化的研究[J]. 饲料工业, 2011, 32(2): 44-46.
[12] 张连忠. 酵母培养物固态发酵条件的研究[J]. 饲料研究,2015(8): 6-8.
[13] 高腾, 丁婵, 苏建青. 响应面优化超声辅助提取刺五加茎皮黄酮工艺[J]. 中国畜牧杂志, 2017, 53(8): 114-118.
[14] 施俊凤, 孙长青, 王春生, 等. 响应面法优化采后生防菌梅奇酵母培养条件[J]. 中国食品学报, 2015, 15(1): 80-84.
[15] Dey T B, Kuhad R C. Enhanced production and extraction of phenolic compounds from wheat by solid-state fermentation with Rhizopus oryzae RCK2012[J]. Biotech Rep, 2014, 4(1):120-127.

