河南省42株奶牛临床型乳房炎病原菌的分子鉴定及药敏试验
皇甫和平,潘昊纯,石冬梅,王 军,宋予震,许文博,史静柯,李聪聪,王林康
(河南牧业经济学院动物医学院,河南 郑州 450046)
奶牛乳房炎是由于病原菌侵入奶牛的乳腺组织,引起奶牛的乳房发生炎症。该病在个体养殖户、小型和大型奶牛养殖场均经常发生,病牛的乳品质和产奶量均降低,这不仅阻碍乳品经济产业的发展,还影响人类社会公共卫生事业以及食品安全,抑制着奶牛养殖业的发展。目前,对于奶牛乳房炎的防治主要使用抗生素,但长期使用抗生素,会使病原菌产生不同程度的耐药性。据流行病学调查报告显示,引起奶牛乳房炎的病原菌有150余种[1],但临床上较常见的有20多种,其中金黄色葡萄球菌、大肠杆菌、链球菌是主要病原菌,三者可占到90%之多[2],不同的地区不同的细菌所占的比例有一定的差异。因此及时掌握各自地区奶牛乳房炎病原菌的种类和耐药情况是非常重要的,不仅可以提高奶牛生产性能、减少经济损失,还对促进本省部分地区奶业持续健康发展具有极其重要的意义。
传统的细菌分离鉴定过程不仅繁琐复杂,而且耗时,16S rRNA基因序列分析可以实现对病原菌进行快速、准确地分类和鉴定[3]。课题组从郑州、焦作的3家奶牛场采集临床型乳房炎奶样并进行病原菌的分离培养,对16S rRNA基因进行了PCR扩增,通过药敏试验进行耐药性分析,为临床合理用药和改善乳房炎预防措施提供参考。
1 材料
1.1 培养基与试剂 营养肉汤,购自广东环凯微生物科技有限公司;鲜血琼脂平板、DL-2 000 DNA Marker,购自宝生物工程(大连)有限公司、4S Green核酸染料,购自上海生工生物工程技术服务有限公司。
1.2 仪器 900系列超低温冰箱由美国赛默飞世尔科技有限公司生产;ETC-811 PCR仪由北京东胜创新生物科技有限公司生产;Universal HoodⅡ凝胶成像系统由美国伯乐(BIO-RAD)公司生产。
1.3 药敏纸片 红霉素(E15)、头孢噻肟(CTX30)、环丙沙星(CIP5)、克林霉素(DA2)、庆大霉素(CN10)、左氧氟沙星(LEV5)、万古霉素(VA30)、四环素(TE30)、壮观霉素(SH100)、头孢曲松(CRO30)、氨苄西林(AMP10)、阿齐红霉素(AZM15)、阿米卡星(AK30)、氧氟沙星(OFX5)、复方新诺明(SXT25)、妥布霉素(TOB10)、氯霉素(C30),药敏片由英国OXOID公司生产。
1.4 引物 参考Weisburg[4]的方法合成16S rRNA基因通用引物,引物序列为:16S-F(5′-CCG AAT TCG TCG ACA ACA GAG TTT GAT CATGGCTCAG-3′)、16S-R(5′-CCC GGGATCCAAGCT TAC GGT TAC CTT GTT ACG ACT T-3′)。
2 方法
2.1 奶样采集 选择郑州的2家及焦作的1家奶牛场进行采样,共计采集临床型乳房炎病乳47份,奶样采集后2 h内送去实验室进行微生物的培养,或冻存于-80℃冰箱备用。
2.2 细菌的分离与培养 将奶样摇匀,以无菌操作涂布于血平板,37℃恒温箱中培养24 h,挑选可疑的典型菌落涂片、革兰染色、镜检。然后将典型菌落再次接种于鲜血琼脂平板进行纯化培养,18~24 h后镜检,如果细菌纯净则接种于营养肉汤,37℃,180 r/min震荡培养18 h,用于细菌DNA的提取。
2.3 DNA提取 取1 mL细菌肉汤于1.5 mL离心管中,10 000 r/min离心5 min弃掉上清液,加入600 μL TE缓冲液,100℃沸水浴10 min,立即冰浴2 min,12 000 r/min离心10 min。上清液即为DNA溶液,-20℃备用或者立即使用。
2.4 16S rRNA PCR16S rRNA PCR反应体系(25 μL):10 × Ex Taq Buffer 2.5 μL,Ex Taq酶 0.125 μL,Mg2+2 μL,dNTP 2 μL,模板 DNA 1 μL,16S rRNA-F 1μL,16S rRNA-R 1μL,ddH2O 15.375 μL。反应条件:94℃预变性30 s;98℃变性10 s,55℃退火30 s,72℃延伸1 min,30个循环;72℃延伸10 min。将PCR产物用1%琼脂糖凝胶在1×TAE电泳液中电泳,用4S Green Nucle Acid染色,在凝胶成像系统中观察PCR结果。
2.5 DNA测序鉴定 电泳检测后的PCR产物,由上海生工生物工程技术服务有限公司测序,并将测序结果通过NCBI在线软件BLAST进行比较分析。
2.6 药敏试验 选取17种药敏纸片,根据美国临床和实验室标准协会(CLSI)抗菌药物敏感性试验标准(M100-S23),通过抑菌圈的大小判定细菌对药物的耐药性与敏感情况[5]。
3 结果与分析
3.1 奶牛临床型乳房炎病原菌的分离结果 47份临床型奶牛乳房炎乳样共分离出细菌47株,鉴定出42株,其中郑州的2家奶牛场34株,焦作的1家奶牛场8株。根据细菌的分离培养,菌落形态,革兰染色镜检等特性,可初步判定分离细菌中主要有革兰阴性杆菌18株、革兰阳性杆菌14株、球菌9株、真菌1株等。
3.2 16S rRNA基因PCR结果 对分离的47株菌提取基因组DNA,扩增16S rRNA基因,结果如图1,扩增得到约1 600 bp的目的条带。

图1 部分样品16S rRNA扩增结果
3.3 16S rRNA方法测序分析 在NCBI上对所得的序列进行BLAST比对,结合传统的微生物鉴定法,对郑州、焦作地区的47份乳房炎奶样,共分离得到17种42株细菌,由表1可知,本试验检出的42株细菌中,郑州的2家奶牛场分离鉴定出14种34株菌,环境性病原菌12种28株,所占比例最多(82.4%),以大肠杆菌、克雷伯氏菌为主,分别占20.6%、17.6%;传染性病原菌只有2株金黄色葡萄球菌,占5.9%。焦作的1家奶牛场分离鉴定的病原菌只有4种8株,环境性病原微生物4株,占50.0%,未分离鉴定出传染性病原微生物。郑州和焦作3家奶牛场的环境性病原菌分离率高,说明两市的3家奶牛临床型乳房炎与环境性病原菌密切相关,应加强环境卫生管理,给奶牛提供一个舒适的环境。郑州的2家奶牛场分离得到的传染性病原菌比例、环境性病原菌比例均高于焦作,郑州的2家奶牛场更应该关注环境卫生的改善。焦作临床型乳房炎奶样没有分离鉴定出传染性病原菌,可能该市的1家奶牛场对致病菌采取了较好的防治措施。
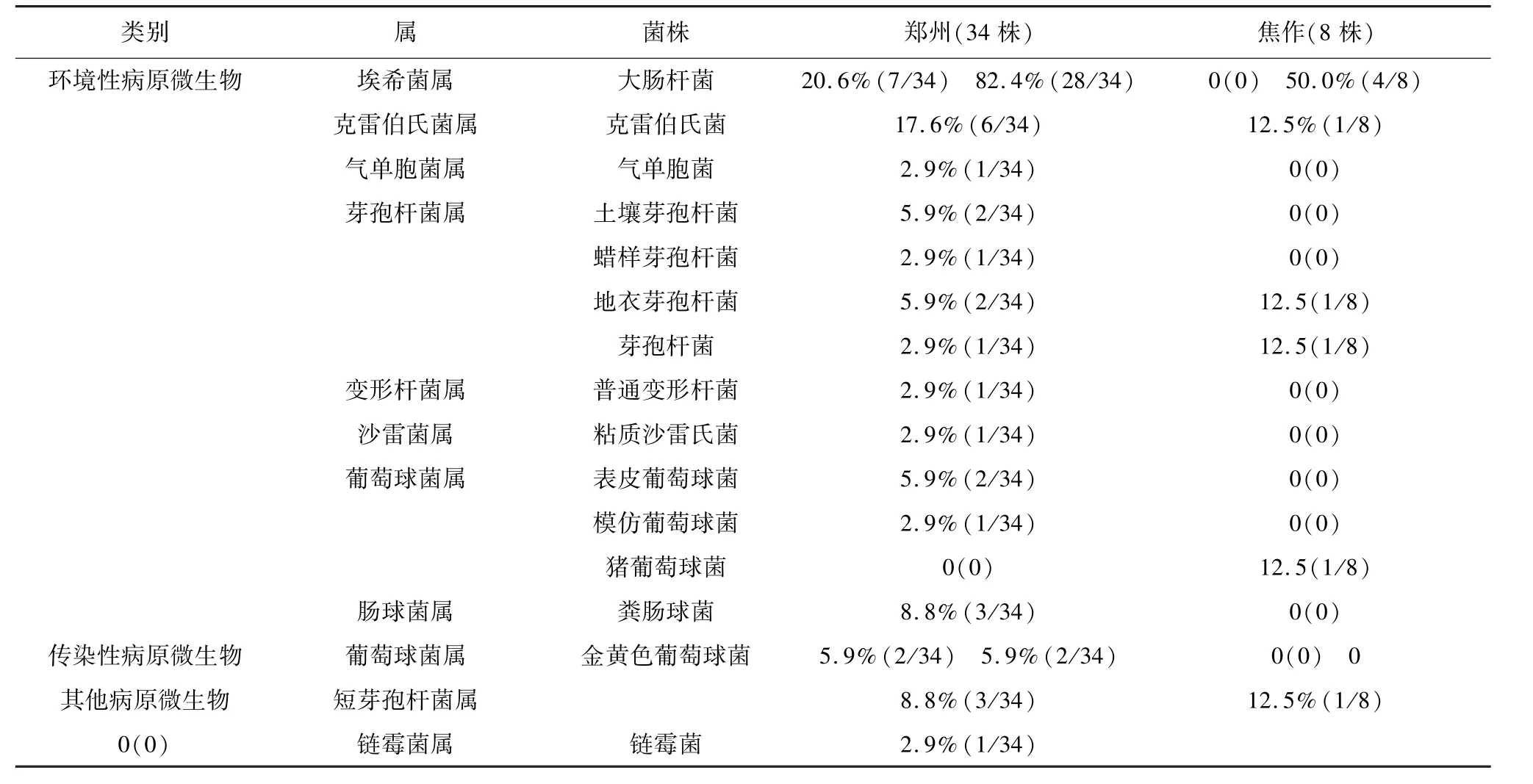
表1 分离菌株种类
3.4 药敏试验结果 分离菌株中的26株致病菌的耐药结果如表2,郑州的2家奶牛场的23株致病菌对11类药物均产生不同程度的耐药,耐药率4.35%~56.52%,对喹诺酮类、头孢类、复方新诺明、氨苄西林、四环素、氯霉素、红霉素的耐药率为8.70%~56.52%,对氨苄西林的耐药率最高,高达56.52%。焦作的1家奶牛场的3株致病菌只对复方新诺明、氨苄西林、四环素、氯霉素4种抗生素产生耐药性,耐药率33.33%~100%,对其余7类药物敏感。郑州和焦作两市的3家奶牛场致病菌对复方新诺明、氨苄西林、四环素、氯霉素这4种药物产生严重的耐药性,耐药率33.33%~100%。郑州奶牛场耐药情况比焦作奶牛场耐药情况严重。
26株致病菌的多重耐药结果如表3,分离的菌株产生了较为严重的多重耐药,26株致病菌有15株产生了多重耐药,占57.69%。其中,最严重的是1株大肠杆菌耐11种抗生素(3.85%),耐6种抗生素的菌有2株(7.69%),耐5种抗生素的菌有5株(19.23%),耐4种抗生素的菌有5株(19.23%),耐3种抗生素的菌有2株(7.69%)。
4 讨论
本次研究共计分离鉴定出17种42株细菌,说明河南省郑州、焦作两市的3家奶牛场临床型乳房炎的病原菌种类繁多,尤其是郑州的2家奶牛场,环境性致病菌数量均多于焦作,提醒相应奶牛场注意改善奶牛生活环境,加强管理。在分离的病原菌中,大肠杆菌,是环境性致病菌;克雷伯氏菌、表皮葡萄球菌、粘质沙雷菌是条件致病菌,对人有较强的致病性;粪肠球菌不仅可以诱发心内膜炎,还可以感染尿路和伤口;金黄色葡萄球菌可以引起人和动物的局部化脓性感染,其与蜡样芽孢杆菌均可以引起人类食物中毒;除此之外,还检测出普通变形杆菌、猪葡萄球菌、模仿葡萄球菌、气单胞菌,这些菌株均具有致病性。
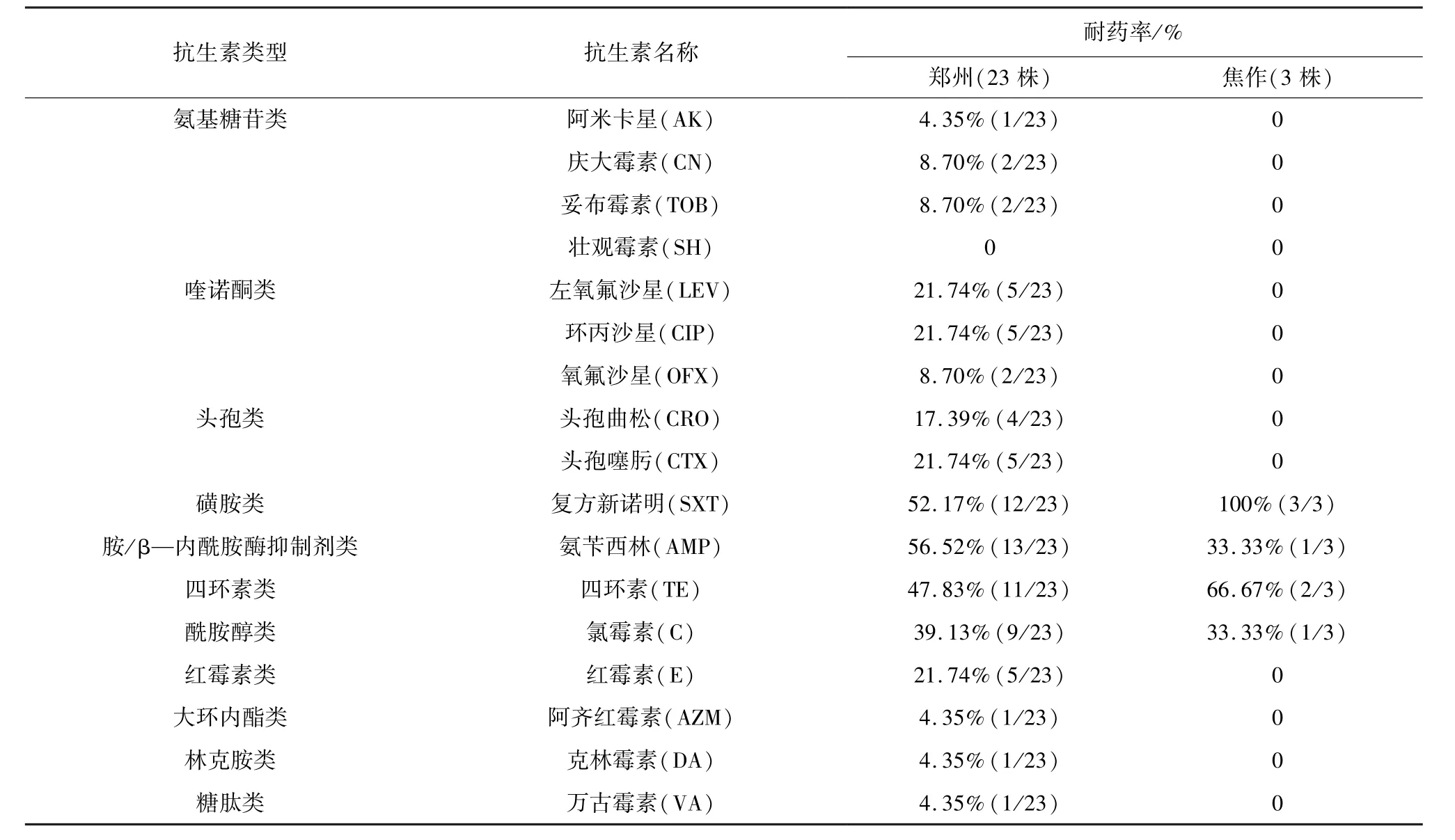
表2 分离菌株的耐药结果

表3 26株菌的多重耐药率
目前,对于奶牛乳房炎的防治还是以使用抗生素为主,但大量使用抗生素,会使牛乳中残留的抗生素超标,人类长期食用含抗生素的乳品,会危害人类的身体健康。分离菌株中的26株致病菌的耐药结果如表2,郑州2家奶牛场分离出的23株致病菌对11类药物均产生不同程度的耐药,耐药率4.35%~56.52%。焦作1家奶牛场分离出的3株致病菌只对复方新诺明、氨苄西林、四环素、氯霉素4种药物产生耐药性,耐药率33.33%~100%,对其余7类药物敏感。郑州的2家奶牛场耐药情况比焦作严重,这可能与牛场在发生乳房炎后长期固定使用这几种抗生素有关。一株病原菌同时对3种及3种以上的药物产生耐药为多重耐药。26株致病菌有15株产生多重耐药,多重耐药结果如表3,占57.69%。其中,最严重的是1株大肠杆菌耐11种抗生素(3.85%)。因此,建议该牛场定期对临床型乳房炎奶样进行细菌的分离鉴定、耐药性分析及合理交替使用抗生素,以便更好地防治乳房炎。本次试验分离的金黄色葡萄球菌数量少的原因可能是前期的药物治疗造成的,也可能是该牛场的金黄色葡萄球菌本来就少。
本次试验将传统的微生物分离鉴定方法和16SrRNA分子生物学鉴定方法结合起来,分析奶牛乳房炎中主要致病菌的种类,不仅大大缩短了确定病原菌的时间,还能够及时防治奶牛的乳房炎病症,为快速鉴定乳房炎致病菌提供有效方法和科学依据。
参考文献:
[1] 徐丹丹,杨彬,王建发,等.围产期奶牛乳房炎与E2、P4免疫调节作用及TLRs、NLRs介导天然免疫三者间的关系[J].中国兽医学报,2016,36(8):1 455~1 463.
[2] 周长卿,王珂,胡俊杰,等.青海地区奶牛乳房炎金黄色葡萄球菌的基因型分析[J].动物医学进展,2014,35(2):11~16.
[3] 杨霞,陈陆,王川庆.16SrRNA基因序列分析技术在细菌分类中应用的研究进展[J].西北农林科技大学学报,2008,36(2):55~60.
[4] Weisburg W G,Barns S M,Pelletier D A,et al.16S ribosomal DNAamplification for phylogenetic study[J].J Bacteriol,1991,173(2):697~703.
[5] 皇甫和平,许文博,石冬梅,等.奶牛蜂窝织炎奇异变行杆菌的分离鉴定及药敏试验[J].中国兽医杂志,2016,52(10):32~34.
[6] 甘露,李姝,徐君,等.奶牛乳房炎病原菌的分离和PCR方法快速鉴定[J].安徽师范大学学报,2012,35(4):344~350.

