定量磁敏感图黑质“燕尾征”在帕金森病诊断中的应用价值
管晓军 谢非 徐晓俊
帕金森病(PD)是老年人群常见的神经变性病。流行病学调查显示,我国≥65岁的老年人群患病率达1.7%[1]。由于缺乏客观生物学标志物,帕金森病的诊断主要依靠临床医师对患者临床症状与体征的评价[2],很大程度受主观因素的干扰,故近20年来帕金森病的诊断准确性无明显提高[3⁃4]。积极探寻可以提示帕金森病的客观生物学标志物,将有助于提高疾病诊断水平。黑质致密部多巴胺能神经元缺失是临床期帕金森病的特征性病理改变。尸体解剖研究显示,黑质致密部背外侧区即Nigrosome 1区是帕金森病多巴胺能神经元缺失最早、最严重的区域[5⁃6];且该区域铁沉积(加重局部神经元氧化应激负荷)与多巴胺能神经元缺失密切相关[7]。因此,黑质致密部背外侧区铁沉积有助于提示帕金森病。作为磁性物质,铁元素可以影响MRI信号。正常人群磁敏感加权成像(SWI)显示黑质致密部背外侧区呈现“燕尾”状高信号即“燕尾征”,而帕金森病患者该区域高信号消失,称为“燕尾征”消失[8]。研究显示,“燕尾征”消失征象用于诊断帕金森病的灵敏度较高(>88%),而特异度变化较大(37% ~ 95%)[7⁃11]。定量磁敏感图(QSM)是在SWI基础上的进一步发展,具有更清晰的信号对比度和分辨力[12⁃15]。在本研究中,我们采用QSM观察帕金森病患者黑质致密部背外侧区“燕尾征”,探讨该项技术是否有助于提高“燕尾征”在帕金森病诊断中的应用价值。
资料与方法
一、临床资料
1.纳入标准 (1)帕金森病的诊断符合英国帕金森病学会脑库帕金森病临床诊断标准[16]。(2)均行头部MRI检查。(3)本研究经浙江大学医学院附属第二医院道德伦理委员会审核批准,所有患者或其家属均知情同意并签署知情同意书。
2.排除标准 (1)其他中枢神经系统疾病病史、精神病病史和颅脑创伤史。(2)临床资料或影像学资料不全。(3)由于震颤等原因造成运动伪影较大,影响图像质量而无法进一步处理。
3.一般资料 (1)帕金森病组:根据纳入与排除标准,选择2010年10月-2016年10月在浙江大学医学院附属第二医院明确诊断的帕金森病患者共计76例,男性38例,女性38例;年龄35~77岁,平均(55.69±8.94)岁;病程0.25~17.10年,中位病程2.92(1.58,6.50)年;统一帕金森病评价量表第三部分(UPDRSⅢ)评分为 7~72分,平均为(28.75±15.53)分;Hoehn⁃Yahr分期 1~4级、平均(2.28±0.69)级,其中1级9例、1.5级5例、2级17例、2.5级30例、3级12例、4级3例。(2)正常对照组:选择同期在我院进行体格检查的健康志愿者共47例,头部MRI均未见明显异常,男性22例,女性25例;年龄37~79岁,平均(57.53±9.69)岁。两组受试者性别(χ2=0.118,P=0.731)和年龄(t=1.077,P=0.284)比较,差异均无统计学意义,具有可比性。
二、研究方法
1.头部MRI检查 采用美国GE公司生产的Signa EXCITE 3.0T MRI扫描仪,8通道头部线圈,梯度场强50 mT/m。受试者以医用海绵垫固定头部、佩戴耳塞降低噪音,以提高舒适度、减少运动伪影,首先进行T2⁃FLAIR成像扫描,以排除潜在病变,如占位性病变、畸形、软化灶或脑白质高信号(WMH)等,再行三维高分辨力 MRI(3D⁃HRMRI)、扩散张量成像(DTI)、静息态fMRI(rs⁃fMRI)、多回波采集的增强T2*加权血管成像(ESWAN)扫描。(1)3D⁃HRMRI:重复时间(TR)5.10 ms、回波时间(TE)1.20 ms,扫描视野(FOV)240 mm×240 mm,矩阵256×256,激励次数(NEX)1次,层厚1.20 mm、层间距为零,扫描时间160 s,共扫描124层,扫描范围覆盖大脑和小脑。(2)DTI:重复时间 12 000 ms、回波时间 105 ms,扫描视野240 mm×240 mm,矩阵128×128,激励次数1次,b值为1000 s/mm2,层厚3 mm、层间距为零,扫描时间170 s,共37层,扫描范围覆盖大脑和小脑。(3)rs⁃fMRI:重复时间 2000 ms、回波时间 30 ms,扫描视野240 mm×240 mm,矩阵64×64,激励次数1次,层厚5 mm、层间距1 mm,扫描时间370 s,共扫描23层,扫描范围覆盖大脑和小脑。(4)ESWAN序列:重复时间45 ms,回波次数8次,首次回波时间为5 ms,间隔 5.02 ms,末次回波时间 40.14 ms,翻转角(FA)25°,带宽频率31.25 kHz,平面内分辨率0.78×0.78,扫描视野200 mm×200 mm,重建后矩阵256×256,激励次数1次,层厚2.80 mm、层间距为零,加速因子为2,扫描时间210 s,共52层,扫描范围覆盖大脑和小脑。
2.图像处理 由同一位经验丰富的放射科医师采用盲法独立完成。参照文献[13⁃14]方法,采用STI Suite软件包(美国加利福尼亚大学伯克利分校研发)[17⁃18]进行 QSM 图像处理。(1)采用 Laplacian 法对相位图去包裹,该方法可以较好地保留所有脑组织空间低频成分,如灰质、白质和脑脊液。(2)由于未去包裹的相位图背景相位掩盖脑组织相位信息,采用V⁃SHARP法将球形半径由0.60 mm(脑边界处)扩大至25 mm(脑中心处),以去除背景相位。(3)由于重建单方向的QSM图可能出现线状伪影,导致细微结构(微病灶)丢失,采用iLSQR公式[17]估算磁化率边界,迭代评价仅来自异常K空间填充引起的磁化伪影,以获得剩余脑组织相位图和磁化率,最终获得QSM图。与SWI图不同,QSM图显示,正常人群由于黑质致密部背外侧区铁含量较低,故磁化率较低,表现为细条形或卵圆形低信号;帕金森病患者由于黑质致密部背外侧区铁沉积明显,故磁化率较高,表现为低信号消失,即“燕尾征”消失。双侧黑质致密部背外侧区低信号均存在为正常;单侧或双侧黑质致密部背外侧区低信号消失为异常,即“燕尾征”消失[7⁃11]。为便于比较几种技术对黑质的成像,选择同一层面的QSM图、SWI图、幅度图(magnitude image)和R2*图。
3.统计分析方法 采用SPSS 19.0统计软件进行数据处理与分析。呈正态分布的计量资料以均数±标准差(x±s)表示,采用两独立样本的t检验;呈非正态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示。计数资料以相对数构成比(%)或率(%)表示,采用χ2检验;计算帕金森病患者和正常对照者黑质致密部背外侧区“燕尾征”出现率和消失率;计算“燕尾征”消失征象诊断帕金森病的灵敏度、特异度和准确度。以P≤0.05为差异具有统计学意义。
结 果
QSM图具有极高的磁化率对比,可以清晰显示黑质部位,准确评价“燕尾征”的存在或消失,而SWI图、幅度图和R2*图分辨力较低,在本研究中无法达到诊断意义(图1~3)。
76例帕金森病患者中73例(96.05%)出现单侧或双侧“燕尾征”消失,包括单侧22例和双侧51例;47例正常对照者中28例(59.57%)出现单侧或双侧“燕尾征”消失,包括单侧15例和双侧13例,组间差异有统计学意义(χ2=26.311,P=0.000)。“燕尾征”消失诊断帕金森病的灵敏度为96.05%、特异度为40.43%、准确度为74.80%。
讨 论
本研究结果显示,QSM图具有极高的磁化率对比,是目前较为先进的黑质成像技术,可以满足“燕尾征”定性分析的需要;QSM图黑质致密部背外侧区“燕尾征”消失诊断帕金森病的灵敏度较高(96.05%)、特异度较低(40.43%),准确度为74.80%。
病理学研究显示,帕金森病患者脑组织多巴胺能神经元缺失进程具有明显的梯度变化,即随着疾病进展由外至内逐渐增多,其中影响最早且最严重的区域是黑质致密部背外侧区[5⁃6]。2008 年,Martin等[19]采用R2*技术定量测量黑质致密部铁含量,结果显示,帕金森病早期黑质致密部背外侧区即有明显的铁沉积,且该部位铁含量与帕金森病运动症状严重程度呈正相关(r2=0.270,P=0.010)。此后,研究者们采用不同MRI铁成像技术如SWI图、相位图(phase image)和幅度图等证实,大多数帕金森病患者黑质致密部背外侧区存在与铁元素相关的MRI信号改变[7⁃11]。Blazejewska 等[7]将 MRI与病理学相结合,进一步揭示MRI信号改变位置为黑质致密部背外侧区,且“燕尾征”消失与该区域铁沉积、黑色素减少和神经元缺失密切相关。本研究采用QSM技术观察帕金森病患者黑质MRI信号改变,96.05%(73/76)的患者黑质致密部背外侧区“燕尾征”消失,即存在铁沉积导致的局部磁敏感性改变,与既往研究结果相一致[7⁃11]。

图1 女性患者,53岁,临床诊断为帕金森病。头部MRI检查所见 1a 横断面QSM图显示,左侧黑质致密部背外侧区卵圆形低信号影(箭头所示) 1b~1d 同层面SWI图、幅度图和R2*图均显示不佳Figure 1 A 53 ⁃year⁃old female patient was diagnosed as PD.Head MRI findings Axial QSM showed an oval hypointensity in dorsolateral part of left substantia nigra pars compacta(arrow indicates,Panel 1a).SWI,magnitude image and R2*image in the same level failed to visualize"swallow tail sign"(Panel 1b-1d).
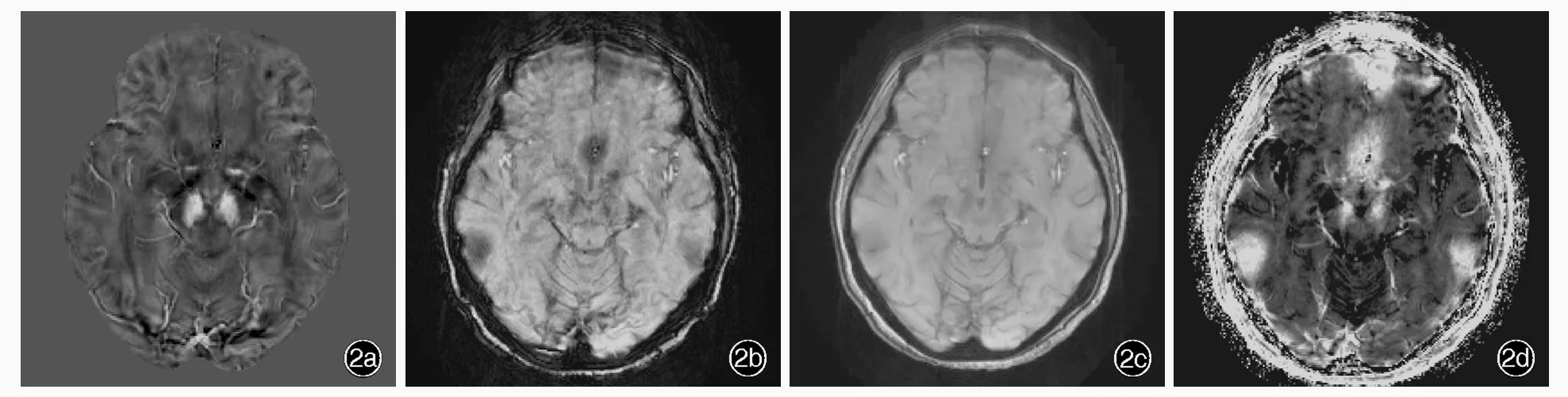
图2 女性患者,57岁,临床诊断为帕金森病。头部MRI检查所见 2a 横断面QSM图未见黑质致密部背外侧区低信号影 2b~2d 同层面SWI图、幅度图和R2*图均显示不佳Figure 2 A 57⁃year⁃old female patient was diagnosed as PD.Head MRI findings Axial QSM showed the absence of hypointensity in dorsolateral part of substantia nigra pars compacta(Panel 2a).SWI,magnitude image and R2*image in the same level failed to visualize"swallow tail sign"(Panel 2b-2d).
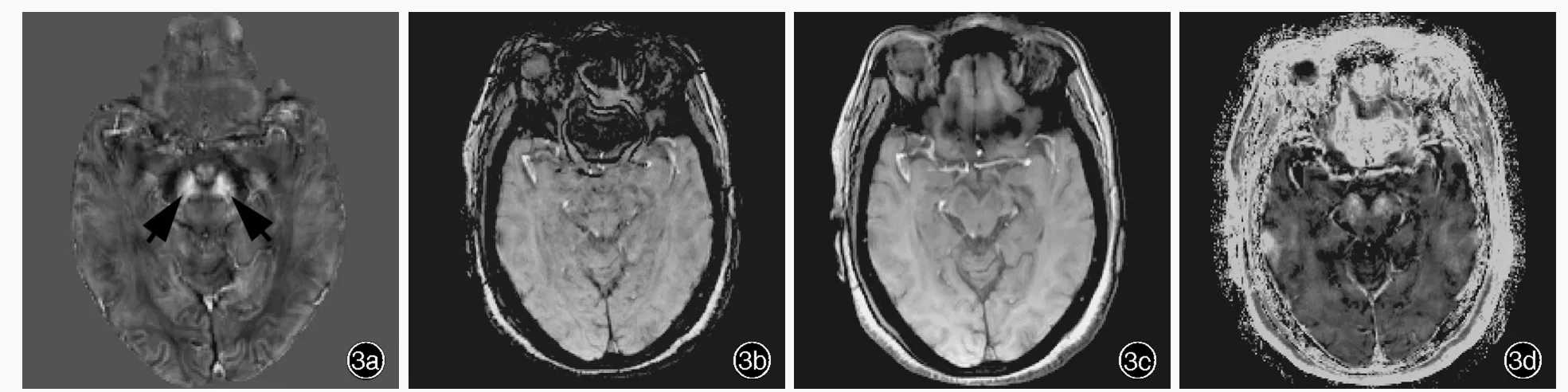
图3 正常女性,60岁。头部MRI检查所见 3a 横断面QSM图显示,双侧黑质致密部背外侧区可见卵圆形低信号影(箭头所示) 3b~3d 同层面SWI图、幅度图和R2*图均显示不佳Figure 3 Head MRI findings of a 60⁃year⁃old normal female Axial QSM showed bilateral oval hypointensity in dorsolateral part of substantia nigra pars compacta(arrows indicate,Panel 3a).SWI,magnitude image and R2*image in the same level failed to meet the diagnostic requirement(Panel 3b-3d).
尽管MRI在体研究和体外研究均证实帕金森病患者存在黑质致密部背外侧区铁沉积,且该区域铁沉积与多巴胺能神经元缺失密切相关,但能否根据黑质致密部背外侧区MRI信号改变以诊断帕金森病尚存争议。研究显示,正常老年人群“燕尾征”消失较为罕见,根据该征象鉴别诊断帕金森病患者与正常对照者的特异度高达 83% ~ 85%[7⁃9,11]。亦有研究显示,“燕尾征”消失诊断帕金森病的特异度仅为37%[10],与本研究特异度为40.43%相近。究其原因,可能包括以下几方面:(1)脑组织正常老化可以导致黑质⁃纹状体多巴胺能神经元缺失和黑质致密部铁沉积[20],“燕尾征”存在与否可能不足以区分脑组织正常老化与神经退行性变,定量测量铁含量可能有助于鉴别二者。(2)有文献报道,“燕尾征”消失也可见于多发性硬化(MS)和进行性核上性麻痹(PSP)等帕金森叠加综合征患者[11],因此,该征象可能是黑质⁃纹状体多巴胺能神经元变性的共同表现而并非原发性帕金森病的特征性表现。本研究正常对照者未经严格的神经内科医师评价,可能混有前驱期帕金森病患者[21]或其他神经变性病高危人群,如原发性快速眼动睡眠期行为障碍(RBD)[22]。(3)黑质致密部背外侧区体积较小,但本研究图像采集层厚较大(层厚2.80 mm),部分容积效应可能影响黑质致密部背外侧区MRI信号的判断。
综上所述,本研究采用QSM技术观察到大多数帕金森病患者黑质致密部背外侧区存在磁化率差异导致的MRI信号改变,即“燕尾征”消失,但仅根据“燕尾征”消失诊断帕金森病的特异性较低。本研究为回顾性研究,无法严格控制研究对象和针对性地调整MRI参数,尚待前瞻性研究采用更高分辨力的MRI扫描仪(避免部分容积效应)、更优化的MRI参数提高图像分辨力、更精确的定量分析方法提高QSM技术在帕金森病诊断中的应用价值。
[1]Zhang ZX,Roman GC,Hong Z,Wu CB,Qu QM,Huang JB,Zhou B,Geng ZP,Wu JX,Wen HB,Zhao H,Zahner GE.Parkinson's disease in China:prevalence in Beijing,Xi'an,and Shangha[iJ].Lancet,2005,365:595⁃597.
[2]Postuma RB,Berg D,Stern M,Poewe W,Olanow CW,Oertel W,Obeso J,Marek K,Litvan I,Lang AE,Halliday G,Goetz CG,Gasser T,Dubois B,Chan P,Bloem BR,Adler CH,Deuschl G.MDS clinical diagnostic criteria for Parkinson's disease[J].Mov Disord,2015,30:1591⁃1601.
[3]Adler CH,Beach TG,Hentz JG,Shill HA,Caviness JN,Driver⁃Dunckley E,Sabbagh MN,Sue LI,Jacobson SA,Belden CM,DuggerBN.Low clinicaldiagnostic accuracy ofearly vs advanced Parkinson disease: clinicopathologic study [J].Neurology,2014,83:406⁃412.
[4]RajputAH,Rozdilsky B,RajputA.Accuracy ofclinical diagnosisin parkinsonism:a prospective study[J].Can J Neurol Sci,1991,18:275⁃278.
[5]Damier P,Hirsch EC,Agid Y,Graybiel AM.The substantia nigra of the human brain.Ⅱ:patterns of loss of dopamine⁃containing neurons in Parkinson's disease[J].Brain,1999,122:1437⁃1448.
[6]Fearnley JM,Lees AJ.Ageing and Parkinson's disease:substantia nigra regional selectivity[J].Brain,1991,114:2283⁃2301.
[7]Blazejewska AI,Schwarz ST,Pitiot A,Stephenson MC,Lowe J,Bajaj N,Bowtell RW,Auer DP,Gowland PA.Visualization of nigrosome 1 and its loss in PD:pathoanatomical correlation and in vivo 7T MRI[J].Neurology,2013,81:534⁃540.
[8]Schwarz ST,Afzal M,Morgan PS,Bajaj N,Gowland PA,Auer DP.The'swallow tail'appearance of the healthy nigrosome:a new accurate test of Parkinson's disease.A case⁃control and retrospective cross⁃sectional MRI study at 3T[J].PLoS One,2014,9:E93814.
[9]Reiter E,MuellerC,Pinter B,Krismer F,Scherfler C,Esterhammer R,Kremser C,Schocke M,Wenning GK,Poewe W, Seppi K. Dorsolateral nigral hyperintensity on 3.0T susceptibility⁃weighted imaging in neurodegenerative Parkinsonism[J].Mov Disord,2015,30:1068⁃1076.
[10]He N,Ling H,Ding B,Huang J,Zhang Y,Zhang Z,Liu C,Chen K,Yan F.Region⁃specific disturbed iron distribution in early idiopathic Parkinson's disease measured by quantitative susceptibility mapping[J].Hum Brain Mapp,2015,36:4407 ⁃4420.
[11]Bae YJ,Kim JM,Kim E,Lee KM,Kang SY,Park HS,Kim KJ,Kim YE,Oh ES,Yun JY,Kim JS,Jeong HJ,Jeon B,Kim SE.Loss of nigral hyperintensity on 3 Tesla MRI of Parkinsonism:comparison with(123)I⁃FP⁃CIT SPECT[J].Mov Disord,2016,31:684⁃692.
[12]Liu C,Li W,Tong KA,Yeom KW,Kuzminski S.Susceptibility⁃weighted imaging and quantitative susceptibility mapping in the brain[J].J Magn Reson Imaging,2015,42:23⁃41.
[13]Guan X,Xuan M,Gu Q,Huang P,Liu C,Wang N,Xu X,Luo W,Zhang M.Regionally progressive accumulation of iron in Parkinson's disease as measured by quantitative susceptibility mapping[J].NMR Biomed,2017,30:E3489.
[14]Guan X,Xuan M,Gu Q,Xu X,Huang P,Wang N,Shen Z,Xu J,Luo W,Zhang M.Influence of regional iron on the motor impairments of Parkinson's disease:a quantitative susceptibility mapping study[J].J Magn Reson Imaging,2017,45:1335⁃1342.
[15]Guan X,Xu X,Zhang M.Region⁃specific iron measured by MRI as a biomarker for Parkinson's disease[J].Neurosci Bull,2017,33:561⁃567.
[16]Hughes AJ,Daniel SE,Kilford L,Lees AJ.Accuracy of clinical diagnosis of idiopathic Parkinson's disease: a clinico⁃pathologicalstudy of100 cases[J].J NeurolNeurosurg Psychiatry,1992,55:181⁃184.
[17]LiW,WangN,Yu F,Han H,CaoW,RomeroR,Tantiwongkosi B,Duong TQ,Liu C.A method for estimating and removing streaking artifacts in quantitative susceptibility mapping[J].Neuroimage,2015,108:111⁃122.
[18]Li W,Avram AV,Wu B,Xiao X,Liu C.Integrated Laplacian⁃based phase unwrapping and background phase removal for quantitative susceptibility mapping[J].NMR Biomed,2014,27:219⁃227.
[19]Martin WR,Wieler M,Gee M.Midbrain iron content in early Parkinson disease:a potential biomarker of disease status[J].Neurology,2008,70:1411⁃1417.
[20]XuX,WangQ,ZhangM.Age,gender,andhemispheric differences in iron deposition in the human brain:an in vivo MRI study[J].Neuroimage,2008,40:35⁃42.
[21]Berg D,Postuma RB,Adler CH,Bloem BR,Chan P,Dubois B,Gasser T,Goetz CG,Halliday G,Joseph L,Lang AE,Liepelt⁃Scarfone I,Litvan I,Marek K,Obeso J,Oertel W,Olanow CW,Poewe W,Stern M,Deuschl G.MDS research criteria for prodromal Parkinson's disease[J].Mov Disord,2015,30:1600⁃1611.
[22]De Marzi R,Seppi K,Hogl B,Muller C,Scherfler C,Stefani A,Iranzo A,Tolosa E,Santamaria J,Gizewski E,Schocke M,Skalla E,Kremser C,Poewe W.Loss of dorsolateral nigral hyperintensity on 3.0 tesla susceptibility⁃weighted imaging in idiopathic rapid eye movement sleep behavior disorder[J].Ann Neurol,2016,79:1026⁃1030.

