Cd2+、Cu2+与Zn2+对威氏海链藻生长生理和油脂积累的影响❋
魏鹏骥, 姜玥璐 ❋❋
(1. 清华大学深圳研究生院,广东 深圳 518055;2. 清华大学环境学院,北京 100084)
微藻是水生生态系统中的初级生产者,为全球贡献了约40%的初级生产力(Net primary productivity, NPP)[1]。其作为环境污染指示物已被广泛应用于水生生态环境检测中,利用微藻进行环境监测和修复受污染水环境成为国内外关注的热点[2-3]。
重金属污染成为近年来突出的水环境问题,重金属污染的治理方法成为全球的热点研究领域。重金属中有一部分是生物生长过程中所必需的,例如锌(Zn)、铜(Cu)、锰(Mn)、镍(Ni)和钴(Co);还有一部分对生物具有毒性且对大多数生物的生理代谢并无积极作用,例如铅(Pb)和汞(Hg)等[4]。有研究发现某些重金属离子(例如Cu2+、Zn2+等)在较低浓度下能够促进微藻生长,Cd2+在催化二氧化碳的水化反应中可以代替Zn2+作为碳酸酐酶的辅因子起积极作用[5-6],而高浓度的重金属则有效的抑制微藻的各项生理代谢[7-9]。随着重金属浓度的提高,微藻受到的胁迫不断加强,重金属的毒性取决于微藻的种类、重金属的浓度以及重金属与微藻的接触时间等多种因素[10-11]。微藻吸附回收废水中的重金属离子作为一种生物吸附手段近年来逐渐被重视,重金属对微藻生理方面的影响则是其主要研究方向之一[12]。
能源紧缺是全球关注的另一热点领域。生物柴油因其可再生性、环保性和良好的燃料性能等优良属性,近年来得到世界的广泛关注。以微藻为原料的生物柴油因其明显的优势:(1)占地面积小且不与农业生产竞争;(2)光化学效率高、产油率大;(3)生长迅速、周期短等,被认为是最有可能代替传统燃料的生物质能源之一[13]。有研究发现重金属毒性、营养不足等环境胁迫因素会对微藻体内的油脂积累有促进作用,当生长过程中遭遇不利条件时,微藻倾向于合成并积累更多的油脂[14]。有研究报道利用微藻富集废水中的重金属离子从而达到净化目的,同时制备生物柴油,可以进一步提高微藻的利用价值[15]。
威氏海链藻(Conticribraweissflogii)是海洋硅藻中分布较广的代表性物种,也是硅藻生理学研究的代表藻株,同时还是鱼虾等水生动物的重要饵料生物[16-17]。有研究发现,威氏海链藻油脂含量丰富,体内的主要脂质包括非极性脂三酰甘油(TAG),一类磷脂磷脂酰胆碱(PC),一类甜菜碱脂(DGCC)以及4种光合脂膜。在正常培养条件下,威氏海链藻体内的TAG在生长平台期末期大量积累[18]。近年来许多研究针对重金属对微藻产油方面的影响,但重金属对威氏海链藻油脂积累方面的研究并不多见。本文研究观察与比较了威氏海链藻在3种重金属离子(Cd2+、Cu2+和Zn2+)不同浓度影响下,其生长、光系统II最大光能转化效率以及油脂积累的变化,分析重金属离子对微藻生长生理的毒性以及利用重金属离子促进威氏海链藻油脂产量的可行性。
1 材料与方法
1.1 威氏海链藻的培养
实验所用的威氏海链藻由清华大学深圳研究生院近海动力环境演变重点实验室提供,所采用的培养介质为取自南海(10.0°N~22.0°N,109.0°E~116.0°E)的天然海水(南海海水样品中Cd2+、Cu2+和Zn2+的浓度远低于国家一类海水水质标准对3种重金属的要求:1、5和20 μg/L[19],与实验设定的重金属浓度相比可忽略不计),经0.22 μm的滤膜双重过滤灭菌后,用f/2营养液加富营养[20],pH为8.0,盐度值为30。实验在1L的聚碳酸酯Nalgene瓶中进行。培养实验的环境为:温度(20±1) °C,光照强度3 000 Lux,光暗比14 h∶10 h。在实验中,将处于对数生长期的威氏海链藻接种到新鲜配制的f/2培养基中(Si浓度为1.06×10-4mol/L),再分别加入不同浓度的单一重金属Cd2+、Cu2+或Zn2+进行胁迫,实验用重金属无机盐分别为CdCl2、CuSO4·5H2O和ZnSO4·H2O。Cd2+实验浓度设8个梯度,分别是0、0.1、0.2、0.5、1、2、5和10 mg/L;Cu2+实验浓度设9个梯度,分别是0、0.1、0.2、0.5、1、2、5、10和30 mg/L;Zn2+实验浓度设8个梯度,分别是0、0.5、1、2、5、10、15和30 mg/L。实验周期为7d,实验过程中每隔8 h均匀摇瓶1次。实验设置空白对照组,每个实验组设有3个生物平行样。
1.2 光密度法测量威氏海链藻的生物量变化
实验采用紫外分光光度计(UV-1780,Shimadzu, Japan)测量威氏海链藻在750 nm波长下的吸光度(OD750nm),以此反映威氏海链藻的生长,在实验中每日测1次OD750nm。威氏海链藻在接种后,经过延迟期的调整,当OD750nm值呈几何级数增加时,计算对数生长期威氏海链藻生长速率,计算公式为:
μ=ln(N2/N1)/t。
(1)
其中:N2和N1分别代表受重金属影响后的威氏海链藻在对数生长期中两个时间点的OD750nm;t是时间间隔[21-22]。另外,我们还利用Probit分析计算经过72 h后对威氏海链藻生长的半抑制浓度EC50。
1.3 光系统II最大光能转化效率Fv/Fm的测量
样品暗置20 min后,用便携式叶绿素荧光仪AP-P100 (PSI, Czech Republic)每日测量威氏海链藻的光系统II最大光能转化效率(Fv/Fm),反映藻细胞受到重金属影响后最大光合能力的变化。
1.4 尼罗红(Nile Red)染色测量威氏海链藻油脂积累的程度
采用尼罗红荧光探针对微藻油脂变化进行测定[23]。用丙酮配置的尼罗红(Sigma,USA)染剂溶液对微藻细胞进行染色,加入染剂后尼罗红的最终浓度为0.5 μg/mL,染色藻液在96孔酶标板中黑暗振荡30 min后,放入酶标仪SpextraMax i3x(Molecular Devices,USA)中测量,激发光与发射光波长分别为490与575 nm。实验结果为3个生物平行样的平均值,每个样品取200 μL,测量3次。该指标在实验周期内的第0(开实验日)、1、2、3、5和7天测量。以超纯水代替藻液作为尼罗红自发荧光背景值的参比样品,扣除未染色藻液的荧光强度即得净荧光值。净荧光值除以生物量(OD750nm光吸收值)得到标准化荧光值作为油脂指数[24]:
油脂指数(Lipid index)= 575 nm波长下的净荧光值/ OD750nm光吸收值。
(2)
1.5 数据处理与分析
实验中所有数据均取3个平行样品的平均值,误差线取自3个平行样品数据的标准偏差。利用SPSS 21.0进行统计分析,采用One-way ANOVA Analysis (p<0.05)对部分实验结果的显著性进行分析。
2 结果与分析
2.1 重金属离子Cd2+、Cu2+和Zn2+对威氏海链藻生长的影响
3种重金属Cd2+、Cu2+和Zn2+浓度对威氏海链藻生长和生长速率的影响见图1、2。3种重金属离子Cd2+(<2 mg/L)、Cu2+(<2 mg/L)和Zn2+(<1 mg/L)在低浓度下对威氏海链藻的生长并没有促进作用,其对生长速率的影响与对照组相比无显著差异(Allp>0.2)。而当重金属离子浓度较高时(Cd2+,5~10 mg/L;Cu2+,5~30 mg/L;Zn2+,10~30 mg/L)时,则
显著抑制威氏海链藻的生长(Allp<0.05)。其中,Cu2+对威氏海链藻生长抑制较大,当Cu2+>5 mg/L 时威氏海链藻生长速率下降到0.07 day-1,并随Cu2+浓度增加进一步降到负值。3种重金属离子中,Cd2+处理组生长速率最高为(0.37±0.01) d-1(Cd2+, 0.1 mg/L),Cu处理组生长速率最高为(0.44±0.03) d-1(Cu2+, 1 mg/L),Zn处理组生长速率最高为(0.46±0.01)d-1(Zn2+, 1 mg/L)。拟合3种重金属离子对生长的影响,Cu2+对威氏海链藻生长速率的半抑制浓度EC50值为3.96 mg/L,Cd2+的EC50值为8.18 mg/L,Zn2+的EC50值为 10.41 mg/L(见表1),3种重金属对威氏海链藻毒性大小顺序为Cu2+>Cd2+>Zn2+。

图1 重金属Cd2+、Cu2+和Zn2+影响下威氏海链藻OD750nm的变化Fig. 1 The OD750nm of C. weissflogii exposed to heavy metals Cd2+, Cu2+ and Zn2+
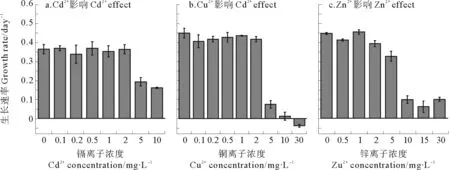
图2 不同浓度下的重金属Cd2+、Cu2+和 Zn2+对威氏海链藻对数期生长的影响Fig. 2 Effects of Cd2+, Cu2+ and Zn2+ at different concentrations on growth rate of C. weissflogii at log phase

重金属离子Heavymetalions半抑制浓度EC50/mg·L-1镉离子Cd2+8.18铜离子Cu2+3.96锌离子Zn2+10.41
2.2 重金属离子Cd2+、Cu2+和Zn2+对威氏海链藻光系统II最大光能转化效率Fv/Fm的影响
由图3可以看出,威氏海链藻的Fv/Fm随着3种重金属离子浓度的增加呈现逐渐下降的趋势。重金属Cd2+、Cu2+和Zn2+对Fv/Fm的影响大致可以分3组:(1)较低浓度的重金属离子对Fv/Fm的影响较小,Fv/Fm数值与对照组的基本相同,呈现稳定缓慢下降趋势。例如,Cu2+<0.5 mg/L(p>0.1)以及Zn2+<1 mg/L (p>0.05);(2)对Fv/Fm有显著抑制作用,但仍保有一定光合能力(Fv/Fm值在整个实验过程中>0.2)。例如Cd2+为0.1~2 mg/L,Cu2+为1~2 mg/L及Zn2+>10 mg/L (Allp<0.05);(3)高浓度的重金属离子影响下,Fv/Fm短时间内下降至~0,完全抑制细胞的光合能力。例如Cd2+或Cu2+>5 mg/L (Allp<0.01)。在3种重金属中,Zn2+对威氏海链藻的Fv/Fm影响较小,在高浓度Zn2+(30 mg/L)作用1周后Fv/Fm仍能保持(0.21±0.01),而当Cd2+和Cu2+>5 mg/L时则完全抑制威氏海链藻的光合作用效率。

图3 不同浓度重金属 Cd2+、Cu2+和 Zn2+对威氏海链藻光系统II最大光能转化效率Fv/Fm的影响Fig. 3 Effects of Cd2+、 Cu2+ and Zn2+ at different concentrations on Fv/Fm of C. weissflogii
2.3 重金属Cd2+、Cu2+和Zn2+对威氏海链藻油脂积累的影响
图4为3种重金属离子影响下威氏海链藻在实验周期7天内油脂指数的最大值。从图4可以看出,3种重金属离子Cd2+、Cu2+和Zn2+对威氏海链藻油脂含量的影响具有差异性。Cd2+离子对威氏海链藻的油脂积累并不具有促进作用,对照组的油脂指数最高。威氏海链藻中油脂含量随Cd2+浓度的升高呈现先逐渐降低,当Cd2+>2 mg/L后油脂指数又逐渐升高。在Cu2+影响下,当Cu2+为0.1~0.5 mg/L时对威氏海链藻的油脂含量没有显著影响(Allp>0.5),而当Cu2+>0.5 mg/L后,随着Cu2+浓度的升高油脂指数逐渐下降(见图4b);Zn2+在0.5 mg/L时对威氏海链藻的油脂含量有促进作用,是对照组的(1.2±0.08)倍(p<0.05)。当Zn2+>1 mg/L时,威氏海链藻的最大油脂指数受到显著抑制(All,p<0.05),而当Zn2+≥10 mg/L后,抑制程度进一步加强,油脂指数较低(p<0.01)。
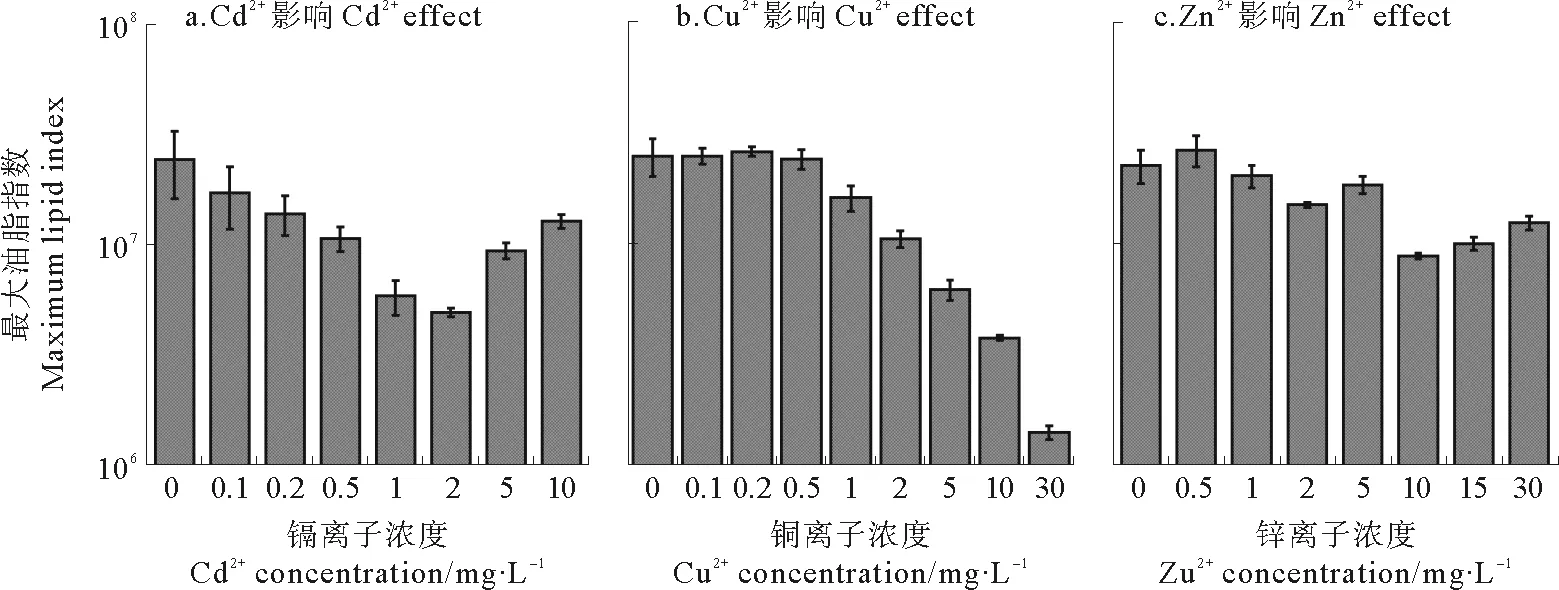
图4 不同浓度下的重金属 Cd2+、 Cu2+和 Zn2+下对威氏海链藻油脂指数的最大值Fig. 4 The maximum values of lipid index at different concentrations of Cd2+、 Cu2+ and Zn2+
3 讨论
3.1 重金属Cd2+、Cu2+和Zn2+对威氏海链藻生长和光系统II最大光能转化效率的影响
Cu和Zn是两种在微藻生长过程中所必需的微量元素,这些必需元素的限制和缺失会限制微藻的生长[8]。在本研究中,低浓度的Cu2+和Zn2+并没有显著影响威氏海链藻生长,说明这两种重金属在一定浓度范围内能够保持威氏海链藻健康生长,不是其生长过程中的限制因素。Monteiro等[7]发现,一些生物体生长所必需的重金属(例如Zn、Cu、Mn、Ni和Co等)在较低浓度时,对微藻的生长和其他生理方面影响一般不大,有时甚至有积极作用;而当其浓度过大时,重金属对生物体的抑制作用会体现在很多方面,例如细胞浓度的减少和生物量的降低等[5-7]。Cu2+及其水合物被视为是对海洋有机体毒性最强的一种重金属物质之一,当浓度过高时,Cu2+可以取代Mg2+与叶绿素分子结合,产生不稳定的激发单重态物质,这种物质激发出来的能量会随机的转移到细胞内生成活性氧化物质,进而引起细胞的过氧化损伤,破坏细胞结构,抑制生长[25-26]。Zn2+是DNA合成过程中相关酶的重要组成,但高浓度的Zn2+会严重的破坏微藻的各项生理代谢过程,例如细胞分裂、移动、总叶绿素含量、ATP以及ATPase活性等。高浓度Zn2+抑制细胞生长可以归因于大量的Zn2+与细胞中的巯基基团结合,进而改变了细胞内部蛋白质的次级结构和氧化还原状态,并影响了微藻对其它营养物质的吸收,最终抑制细胞的有丝分裂等代谢活动[27]。研究发现当对斜生栅藻Scenedesmusobliquus和四尾栅藻Scenedesmusquadricauda暴露于8 mg/L Zn2+环境下时,其生长速率便受到严重的抑制,与对照相比分别下降24%和33%[28]。而Cd并不是大多数微藻生长所必需的元素,Cd2+可以通过主动运输的方式进入细胞,并与其它二价阳离子构成竞争关系,例如生物体生理代谢所必需的Ca2+[29]。研究发现1 mg/L的Cd2+便可以使斜生栅藻的各项生理指标受到影响,且其抑制程度随着浓度的升高而增强[30]。这与本研究中Cd2+、Cu2+和Zn2+在低浓度时对威氏海链藻生长速率的影响较小,而高浓度时会对其生长造成强烈抑制的现象一致,同时也必须认识到不同种类微藻对重金属胁迫的响应和敏感程度也存在着种间差异。EC50因其能较好的反映重金属对生物细胞生理状态和代谢功能的影响,通常用于指示重金属对于生物生长的抑制作用。Zn2+对威氏海链藻的EC50要明显大于Cd2+和Cu2+,这表明威氏海链藻的生长对Zn2+有较强的耐受能力,而Cu2+的毒性作用最强,三种金属的毒性作用强弱为Cu2+>Cd2+>Zn2+。
光系统II最大光能转化效率Fv/Fm又叫做光系统II最大光化学量子产量或光系统II潜在最大量子产量,它代表的是当所有光系统II反应中心均处于开放态时的量子产量。该指标可以从量子水平反映出理论上藻类光合能力可以达到的最大程度,是评价藻类光合能力的重要指标[31]。当外界环境中出现不利条件而使光合作用受到影响时,Fv/Fm会出现显著下降,且非常敏感。研究表明光合系统中最重要的细胞器-叶绿体是Cd2+是最容易攻击的目标[32]。Leborans等(1996)发现重金属Cd2+对绿色植物的光合系统具有抑制作用,Cd2+可以通过影响光合系统II的电子传递、抑制光合色素的合成以及卡尔文循环等途径扰乱光合系统的代谢[31-33]。Ran等[34]研究发现0.2 mg/L Cd2+就可以使水华束丝藻(Aphanizomenonflosaquae),单角盘星藻(Pediastrumsimplex) 与尖针杆藻(Synedraacus)的叶绿素a荧光显著降低;而当Cd2+达到20 mg/L时,3种藻类的叶绿素a荧光被完全抑制[32-34]。本研究中当Cd2+> 5 mg/L时,威氏海链藻在4 d内其Fv/Fm就降低到接近于零,比Ran等研究中所用的3种藻类对Cd2+耐受性更低。本研究发现重金属Cd2+和Zn2+与威氏海链藻的Fv/Fm存在剂量相关关系,该指标数值随着重金属浓度的升高而逐渐下降。Cu是微藻生长所必需的元素之一,它可以影响微藻光合系统PSI在还原侧的电子传递与光合系统PSII在氧化侧(P680)的电子传递,从而降低光合系统PSII反应中心的活性[35]。Zn也是微藻生长所必需的元素之一,虽然对威氏海链藻的Fv/Fm的影响较小,但仍有许多研究发现高浓度Zn2+可以通过多种途径对微藻的光合过程产生抑制作用。Rai等[34]发现Zn2+可以破坏色素合成系统中氧化还原的平衡,进而影响光合作用效率;Novák等[25-27]也发现当Zn2+浓度达到20 mg/L以上时便可以完全抑制微藻中叶绿素a的合成。这些发现与本研究中Zn2+>10 mg/L时威氏海链藻的Fv/Fm出现了显著的抑制现象相符[33]。绝大部分微藻细胞生长的能量来源于光合作用,当光合作用酶系统受到重金属离子影响,光能转化存储能力受到抑制将最终影响藻细胞的生长和细胞组成。
3.2 重金属Cd2+、Cu2+和Zn2+对威氏海链藻油脂含量的影响
尼罗红将微藻体内的中性油脂染色后在一定的激发光下可以发出荧光,其荧光强度的变化可以反映出微藻胞内油脂含量[37]。许多研究发现,当营养充足、无外界胁迫的自然条件下时,藻细胞油脂含量通常较低,一般不超过细胞干重的20%,此时微藻各种代谢产生的能量多用于细胞生长与分裂等活动;而当受到一定程度的环境胁迫时(例如重金属胁迫以及N和P等营养物质缺乏等),微藻会倾向于转变生理代谢途径,合成较多的油脂作为贮存物质,这样有助于其在不利的环境中存活下来,而这种油脂中占绝大多数的便是中性油脂——三酰基甘油TAGs[14, 38]。而当重金属浓度过高导致胁迫强度过大时,微藻的油脂积累、生长代谢都可受影响甚至全面抑制[35]。在本研究中,3种重金属Cd2+、Cu2+和Zn2+对威氏海链藻油脂积累表现出来3种不同的特点。Cd2+的浓度在0.1~2 mg/L时对威氏海链藻的生长没有显著影响,但藻细胞的油脂含量有下降趋势;当Cd2+>2 mg/L后,随着Cd2+浓度的升高,威氏海链藻的最大油脂指数又逐渐上升,但生长率和光合效率均急剧下降。如前文所述,Cd2+不是微藻生长必需的营养元素,但Cd2+可以干扰藻类细胞一些关键的酶活性,抑制叶绿素合成进而影响光合作用和CO2固定等[39]。Cu和Zn是微藻生长所必需的元素,本研究中低浓度的Zn2+(0.5 mg/L)对藻细胞油脂积累具有促进作用,其他浓度则对油脂积累的促进作用并不明显。低浓度的Cu2+(<0.5 mg/L)对油脂含量没有显著影响,而高浓度的Cu2+不仅全面抑制威氏海链藻的生长和光合效率,对油脂积累也产生了强烈的抑制,且随浓度提高抑制增强。因此,威氏海链藻可能并不适合在吸附富集Cd2+和Cu2+过程中进行油脂积累,但可以作为治理因熔锌、冶炼等过程导致的水体Zn2+污染,并同时富集油脂生产生物柴油的的适用藻株。
4 结论
(1)重金属离子Cd2+浓度小于2 mg/L时,对威氏海链藻的生长速率没有显著抑制,而当浓度大于5 mg/L后对生长速率产生明显抑制。Cd2+在实验设计的浓度下,对威氏海链藻的光系统II最大光能转化效率Fv/Fm均有抑制作用,且抑制随着Cd2+浓度的提高而增强。实验中各个浓度的Cd2+对威氏海链藻的油脂积累均没有促进作用。
(2)重金属离子Cu2+在小于2 mg/L时,对威氏海链藻的生长速率与Fv/Fm的影响并不显著,在浓度大于2 mg/L后抑制显著且随着浓度的提高抑制逐渐增强。Cu2+在小于0.5 mg/L时,对油脂积累的影响并不显著,而当浓度大于1 mg/L后,随着浓度的增加,油脂积累受到显著抑制。
(3)重金属离子Zn2+浓度在小于1 mg/L时,对威氏海链藻的生长速率和Fv/Fm无显著影响,而当浓度大于2 mg/L后则显著抑制威氏海链藻的生长和Fv/Fm。Zn2+浓度在0.5 mg/L时,对油脂含量有显著的促进作用,而当Zn2+浓度大于10 mg/L后油脂积累则受到显著抑制。
(4)3种重金属离子对威氏海链藻生长具有毒性兴奋效应(Hormesis)。在今后的研究中,应该倾向于探索用更低浓度的重金属Cd2+、Cu2+或Zn2+以及多种重金属耦合作用来达到促进威氏海链藻油脂积累的效果。
参考文献:
[1] Perales-Vela H V, Pena-Castro J M, Canizares-Villanueva R O. Heavy metal detoxification in eukaryotic microalgae[J]. Chemosphere, 2006, 64(1): 1-10.
[2] 高政权, 孟春晓. 微藻与水环境修复[J]. 环境科学与技术, 2008, 31(3): 30-34.
Gao Z, Meng C. Microalgae and rehabilitation of water environment, China[J]. Environmental Science & Technology, 2008, 31(3): 30-34.
[3] Sabater C, Carrasco J M. Effects of pyridaphenthion on growth of five freshwater species of phytoplankton. A laboratory study[J]. Chemosphere, 2001, 44(8): 1775-1781.
[4] Gaur A, Adholeya A. Prospects of arbuscular mycorrhizal fungi in phytoremediation of heavy metal contaminated soils[J]. Current Science, 2004, 86(4): 528-534.
[5] Price N M, Morel F M M. Cadmium and cobalt substitution for zinc in a marine diatom[J]. Nature, 1990, 344(6267): 658-660.
[6] Lane T W. A biological function for cadmium in marine diatoms[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(9): 4627-4631.
[7] Monteiro C M, Fonseca S C, Castro P M L, et al. Toxicity of cadmium and zinc on two microalgae,ScenedesmusobliquusandDesmodesmuspleiomorphus, from Northern Portugal[J]. Journal of Applied Phycology, 2010, 23(1): 97-103.
[8] Magdaleno A, Velez C G, Wenzel M T, et al. Effects of cadmium, copper and zinc on growth of four isolated algae from a highly polluted Argentina river[J]. Bull Environ Contam Toxicol, 2014, 92(2): 202-207.
[9] 梁英, 王帅. 重金属对微藻胁迫的研究现状及前景[J]. 海洋湖沼通报, 2009(4): 72-82.
Liang Y, Wang S. Current status and prospect of studies on microalgae stress by heavy metals, China[J]. Transactions of Oceanology and Limnology, 2009(4): 72-82.

[11] Suarez C, Torres E, Perez-Rama M, et al. Cadmium toxicity on the freshwater microalgaChlamydomonasmoewusiiGerloff: Biosynthesis of thiol compounds[J]. Environ Toxicol Chem, 2010, 29(9): 2009-2015.
[12] Ahluwalia S S, Goyal D. Microbial and plant derived biomass for removal of heavy metals from wastewater[J]. Bioresource Technology, 2007, 98(12): 2243-2257.
[13] Chisti Y. Biodiesel from microalgae[J]. Biotechnology Advances, 2007, 25(3): 294-306.
[14] Sharma K K, Schuhmann H, Schenk P M. High lipid induction in microalgae for biodiesel production[J]. Energies, 2012, 5(12): 1532-1553.
[15] 蔡卓平, 段舜山, 朱红惠. “污水-微藻-能源”串联技术新进展[J]. 生态环境学报, 2012(7): 1380-1386.
Cai Z, Duan S, Zhu H. Recent advance on sewage-biofuel coupling technology, China[J]. Ecology and Environmental Sciences, 2012(7): 1380-1386.
[16] Frost B W. Effects of size and concentration of food particles on the feeding behavior of the marine planktonic copepodcalanuspacificus[J]. Limnology and Oceanography, 1972, 17(6): 805-815.
[17] Emmerson W D. Ingestion, growth and development ofPenaeusindicuslarvae as a function ofThalassiosiraweissflogiicell concentration[J]. Marine Biology, 1980, 58(1): 65-73.
[18] 白倩, 李艳荣, 杨帆, 等. 不同生长期威氏海链藻主要脂类成分分析[J]. 中国食品学报, 2016, 16(5): 258-267.
Bai Q, Li Y, Yang F, et al. Studies on main lipids inThalassiosiraweissflogiiat different growth phases, China[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(5): 258-267.
[19] 李景喜, 李俊飞, 郑立, 等. 南海中南部水域海水中重金属的分布特征 [J]. 中国环境监测, 2013, 29(3): 65-71.
Li J, Li J, Zheng L, et al. Distribution of heavy metals in the mid-south part of South China Sea water, China[J]. Environmental Monitoring in China, 2013, 29(3): 65-71.
[20] Guillard R R L, Ryther J H. Studies of marine planktonic diatoms[J]. Canadian Journal of Microbiology, 1962, 8: 229-239.
[21] Rangsayatorn N, Upatham E S, Kruatrachue M, et al. Phytoremediation potential ofSpirulina(Arthrospira)platensis: Biosorption and toxicity studies of cadmium[J]. Environmental Pollution, 2002, 119(1): 45-53.
[22] Radzun K A, Wolf J, Jakob G, et al. Automated nutrient screening system enables high-throughput optimisation of microalgae production conditions[J]. Biotechnol Biofuels, 2015, 8: 65.
[23] Cooksey K E, Guckert J B, Williams S A, et al. Fluorometric determination of the neutral lipid content of microalgal cells using Nile Red[J]. Journal of Microbiological Methods, 1987, 6(6): 333-345.
[24] Jiang Y, Laverty K S, Brown J, et al. Effects of fluctuating temperature and silicate supply on the growth, biochemical composition and lipid accumulation ofNitzschiasp.[J]. Bioresource Technology, 2014, 154: 336-344.
[25] Küpper H, Küpper F C, Spiller M. [Heavy metal]-chlorophylls formedinvivoduring heavy metal stress and degradation products formed during digestion, extraction and storage of plant material[J]. Advances in Photosynthesis and Respirdion, 2006, 25: 67-77.
[26] Pinto E, Sigaud-Kutner T C S, M A S L, et al. HM-induced oxidative stress in algae[J]. J Phycol, 2003, 39: 1008-1018.
[27] Novák Z, Jánószky M, V B B, et al. Zinc tolerance and zinc removal ability of living and dried biomass ofDesmodesmuscommunis[J]. Bull Environ Contam Toxicol, 2014, 93(6): 676-682.
[28] Omar H H. Bioremoval of zinc ions byScenedesmusobliquusandScenedesmusquadricaudaand its effect on growth and metabolism [J]. International Biodeterioration & Biodegradation, 2002, 50: 95-100.
[29] Welch R M, Norvell W A. Mechanisms of cadmium uptake, translocation and deposition in Plants[M]//. Mclaughlin M J, Singh B R. Cadmium in Soils and Plants. Dordrecht: Springer Netherlands, 1999: 125-150.
[30] Cain J R, Paschal D C, Hayden C M. Toxicity and bioaccumulation of cadmium in the colonial green algaScenedesmusobliquus[J]. Archives of Environmental Contamination & Toxicology, 1980, 9(1): 9-16.
[31] 韩博平. 藻类光合作用机理与模型[M]. 北京: 科学出版社, 2003.
Han B. Algal Photosynthesis: Mechanisms and Models, China[M]. Beijing: Science Press, 2003.
[32] Visviki I, Rachlin J W. Acute and chronic exposure ofDunaliellasalinaandChlamydomonasbullosato copper and cadmium: Effects of ultrastructure[J]. Archives of Environmental Contamination & Toxicology, 1994, 26(2): 149.
[33] Leborans G F, Novillo A. Toxicity and bioaccumulation of cadmium inOlisthodiscusluteus(Raphidophyceae)[J]. Water Research, 1996, 30(1): 57-62.
[34] Ran X, Liu R, Xu S, et al. Assessment of growth rate, chlorophyllafluorescence, lipid peroxidation and antioxidant enzyme activity inAphanizomenonflos-aquae,PediastrumsimplexandSynedraacusexposed to cadmium[J]. Ecotoxicology, 2015, 24(2): 468-477.
[35] Yang J, Cao J, Xing G, et al. Lipid production combined with biosorption and bioaccumulation of cadmium, copper, manganese and zinc by oleaginous microalgaeChlorellaminutissimaUTEX2341[J]. Bioresource Technology, 2015, 175: 537-544.
[36] Rai L C, Singh A K, Mallick N. Studies on photosynthesis, the associated electron transport system and some physiological variables ofChlorellavulgarisunder heavy metal stress[J]. Journal of Plant Physiology, 1991, 137(4): 419-424.
[37] Elsey D, Jameson D, Raleigh B, et al. Fluorescent measurement of microalgal neutral lipids[J]. J Microbiol Methods, 2007, 68(3): 639-642.
[38] Napan K, Teng L, Quinn J C, et al. Impact of heavy metals from flue gas integration with microalgae production[J]. Algal Research, 2015, 8: 83-88.
[39] Vymazal J. Toxicity and accumulation of cadmium with respect to algae and cyanobacteria: A review[J]. Environmental Toxicology & Water Quality, 2010, 2(4): 387-415.

