宫腔镜手术对于不同临床分型早孕期剖宫产瘢痕妊娠的治疗效果分析
左娜,张宁宁
(中国医科大学附属盛京医院妇产科,沈阳 110004)
剖宫产瘢痕妊娠(CSP)是一种特殊类型的异位妊娠,由Larsen等[1]1978年首次报道,CSP指妊娠囊着床于剖宫产切口瘢痕处。近年来,我国剖宫产率一直处于很高水平,随着二胎政策的放开,CSP现已成为妇科常见病。CSP处理不当,可以导致子宫破裂等严重的后果,危及母婴生命[2],如何为CSP患者提供安全有效的治疗方法在临床工作中具有十分重要的意义。有学者认为应该在手术前明确CSP的临床类型,并采取针对性的治疗,从而取得良好的治疗效果[3]。随着宫腔镜的技术发展,宫腔镜手术已广泛应用于多种妇科疾病治疗,其在部分CSP病例中的应用也得到较好的临床效果。以往临床多基于Vial等[4]提出的分型(内生型和外生型)进行相应处理,但现在CSP临床表现趋于多样化,此种分型已不适宜临床工作。2016年中华医学会计划生育学组在“剖宫产术后子宫瘢痕妊娠诊治专家共识”中提出了新的CSP分型方法,本研究对曾诊治过的CSP病例进行重新分型,并观察宫腔镜手术治疗不同分型CSP的手术方式及术后恢复情况,评价其应用价值。
资料与方法
一、研究对象及分组
收集中国医科大学附属盛京医院2013年1月至2016年6月因早孕期CSP住院行宫腔镜手术治疗的70例患者为研究对象,所有患者入院均行彩超及MRI检查。并依据中华医学会计划生育学分会提出的CSP分型标准[5]进行分组:Ⅰ型组(32例)、Ⅱ型组(26例)、Ⅲ型组(12例)。所有患者术前均行子宫动脉栓塞术(UAE)预防出血,手术由同一术者完成,均行超声监测下宫腔镜CSP病灶切除术。
纳入标准:(1)根据术前辅助检查等评估方式考虑为CSP;(2)停经时间为早期妊娠;(3)同意手术治疗方案。排除标准:(1)正处于全身感染或局部严重感染的患者;(2)有严重的肝肾功能损害、心肺疾病及有其它严重的基础疾病者;(3)合并子宫肌瘤、腺肌症、卵巢肿瘤等妇科疾病需同时手术处理。
二、处理方法
1. UAE:所有患者术前均行UAE,具体步骤如下:(1)取仰卧位,常规双侧腹股沟区消毒;(2)于一侧股动脉处皮下局麻,应用Seldinger技术穿刺,成功后置入动脉短鞘;(3)沿鞘送入导管,将导管送入一侧髂内动脉造影显示子宫动脉,导丝引导下将导管送至子宫动脉;(4)造影确认后,于透视下缓慢注入明胶海绵制成的细颗粒与少量造影剂的混合液;(5)血流明显减慢后停止注入;(6)同法处理对侧;(7)术毕拔管、拔鞘,于股动脉穿刺点安装压迫止血器。
2. 宫腔镜手术:按照我中心常规操作进行,逐步扩张宫颈后,宫腔镜下探查宫腔及颈管情况,使用环形电极(功率设定80 W)切除CSP病灶。术后超声检查,仍显示有少许病灶的患者,术后给予抗炎及止血治疗3~7 d后,再行二次宫腔镜手术。宫腔镜术中通过缩宫素及气囊等方法未能控制住出血,则立即中转开腹或腹腔镜手术。
3. 观察指标:比较3组患者的一般资料,包括:平均年龄、产程中剖宫产术比例(产程中剖宫产术指非择期剖宫产,患者有分娩先兆后因各种原因紧急行剖宫产术)等;宫腔镜手术情况,包括:术中出血量、手术时间、手术并发症(包括子宫穿孔、低钠血症、气体栓塞)、手术成功率等;术后门诊随访,记录血HCG下降至正常的时间、超声影像恢复正常的时间以及月经恢复情况;再次妊娠情况等。
手术成功的评价标准:单次手术成功指按照术前既定宫腔镜手术方案,单次完成,并顺利出院,后续门诊随访恢复良好,无二次手术或中转其他治疗者。
三、统计学方法
采用SPSS 20.0软件进行数据分析。组间比较采用t检验和χ2检验,P<0.05表示差异有统计学意义。
结 果
一、各组一般资料比较
各组患者的平均年龄、剖宫产次数、产程中剖宫产术比例、距离上次剖宫产时间间隔、停经天数等一般资料比较,均无显著性差异(P>0.05)(表1),各组具有可比性。
二、各组手术情况比较
3组患者手术情况比较,Ⅲ型组的手术时间显著高于Ⅰ和Ⅱ型组(P<0.05),Ⅰ型和Ⅱ型两组之间比较无显著性差异(P>0.05);Ⅰ型组患者术中出血量显著低于Ⅱ和Ⅲ型组(P<0.05),Ⅱ和Ⅲ型两组之间比较无显著性差异(P>0.05);术后阴道流血持续天数3组间比较无显著性差异(P>0.05)(表2);3组患者均无手术并发症发生。
三、各组宫腔镜手术成功率比较
Ⅰ型组单次宫腔镜手术成功31例(96.9%),Ⅱ型22例(84.6%),Ⅲ型6例(50%),Ⅰ型和Ⅱ型单次宫腔镜手术成功率显著高于Ⅲ型(P<0.05);Ⅰ型和Ⅱ型之间比较则无显著性差异(P>0.05)。Ⅰ型患者中行二次宫腔镜手术者1例(3.1%),Ⅱ型2例(7.7%),Ⅲ型4例(33.3%);中转腹腔镜或开腹手术者Ⅰ型者0例,Ⅱ型者2例(7.7%),Ⅲ型者2例(16.7%),各组间比较均无显著性差异(P>0.05)(表3)。
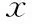
表1 各组一般资料比较 [(-±s),%]
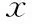
表2 各组手术情况比较(-±s)
注:与Ⅰ型组比较,*P<0.05;与Ⅱ型组比较,#P<0.05

表3 各组宫腔镜手术成功率比较 [n(%)]
注:与Ⅲ型组比较,*P<0.05
四、各组患者术后恢复情况比较
患者术后于门诊随访观察,询问月经恢复、血HCG下降及超声恢复至正常等情况。Ⅰ型患者术后月经恢复时间平均为(32.1±4.4)d,Ⅱ型为(33.4±3.6)d,Ⅲ型为(35.0±4.3)d,3组间比较无显著性差异(P>0.05);Ⅰ型患者血HCG下降至正常范围的时间平均为(30.1±5.1)d,Ⅱ型为(31.4±3.6)d,Ⅲ型为(33.5±5.3)d,3组间比较无显著性差异(P>0.05);Ⅰ型患者超声影像恢复正常时间平均为(18.9±4.2)d,Ⅱ型为(20.6±3.6)d,Ⅲ型为(42.9±5.2)d,Ⅲ型显著慢于Ⅰ、Ⅱ型(P<0.05),Ⅰ型和Ⅱ型组间比较无显著性差异(P>0.05)(表4)。
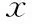
表4 各组患者术后恢复情况比较(-±s)
注:与Ⅰ型、Ⅱ型组比较,*P<0.05
五、术后再次妊娠情况比较
本研究共随访到术后妊娠患者12例,这些患者再次妊娠均无CSP发生,孕期无子宫破裂发生。Ⅰ型患者再次妊娠7例,其中2例足月后行择期剖宫产术;1例于妊娠35周因胎膜早破急诊行剖宫产术,手术过程顺利;2例生化妊娠;2例因胚胎停止发育行人工流产术。Ⅱ型患者再次妊娠4例,其中3例因早孕、胚胎停止发育行人工流产术;1例至发文时处于妊娠晚期,前期过程顺利。Ⅲ型患者再次妊娠1例,于妊娠35周因胎膜早破行急诊剖宫产术,手术过程顺利。
讨 论
CSP是剖宫产术后严重的远期并发症,国外有学者报道CSP的发病率为1/1 800,在有剖宫产史的异位妊娠人群中占6.1%[6]。其具体发病原因尚不明确,但多数学者认为可能与剖宫产瘢痕处愈合不良有关[7]。在我们之前的研究中,通过显微镜观察术后CSP标本也证实绒毛种植于剖宫产瘢痕肌层缝隙中[8]。另有研究发现产程延长、择期手术、子宫后位、再次剖宫产间隔时间<2 年、胎膜早破病史等可以导致剖宫产切口愈合不良[9],但尚无足够的证据认为剖宫产次数增加CSP风险。
CSP的临床表现无特异性,约36.8%的患者没有任何临床症状,仅仅在产检中发现,另外约38.6%的患者可能出现阴道不规则流血而就诊[10]。经阴道超声检查因其较高的诊断敏感度成为目前最常用的辅助检查手段[7]。随着技术发展,MRI逐渐成为临床中另一种常用的检查方法,其优势在于能清楚地显示子宫肌层厚度、孕囊位置及与膀胱的关系,能更好地进行病变评估[11],因此对于CSP的临床诊断及治疗具有重要指导意义。Huang等[12]学者总结了MRI和超声对于CSP的诊断准确率,两者分别为97.6%及81%,但MRI在CSP的临床分型方面有更高的准确性。本研究纳入的所有患者,为了增加临床分型的准确性,术前均行盆腔彩超及MRI检查。
CSP的临床治疗目前尚无统一、规范的标准,但如果处理不当,可能造成严重的大出血,甚至对患者的生育功能及生命造成严重影响,因此适时终止妊娠及选择合适的治疗方案显得尤为重要[13]。随着医疗技术的进步,目前CSP的处理方法主要分为药物治疗和手术治疗两种方案。药物治疗多采用甲氨蝶呤(MTX)杀胚治疗,但其临床效果目前仍存在争议,需要更充分的循证医学证据验证,因此单纯药物治疗目前并不作为CSP的首选方案[14]。手术治疗是目前最主要的治疗方案。毕建蕾等[15]认为术前准确分型CSP对于治疗方案选择具有重要指导意义。有学者比较了宫腔镜手术和腹腔镜手术在外生型CSP治疗中的应用效果,结果显示二者的成功率没有显著性差异,认为两种微创手术均能很好地治疗外生型CSP[16]。也有学者认为宫腔镜手术可能更适合于Ⅰ型CSP,腹腔镜治疗则更适合于其他的类型[17]。Litwicka等[18]认为宫腔镜治疗CSP能保留子宫,术后并发症少,恢复快,是一种创伤小的手术方式。
UAE以往用来治疗多种妇科疾病,近年来逐渐应用于CSP的治疗中,且取得了良好的治疗效果[19]。有研究表明[7],UAE可以有效预防和控制CSP大出血,但不推荐将单纯UAE作为治疗CSP手段,应该与其他治疗方式联合应用。中华医学会妇产科分会计划生育学组于2016年更新了CSP的诊治共识,认为对于Ⅱ、Ⅲ型CSP手术前应行UAE进行预处理,以减少手术过程中出血的风险[5]。Li 等[20]比较了单纯宫腔镜手术以及UAE联合宫腔镜手术对于CSP的治疗效果,发现UAE联合宫腔镜手术术中出血更少、成功率更高,因此本研究患者术前亦联合应用UAE预防出血。
本文观察了宫腔镜手术对于不同临床分型CSP的治疗效果。从术中情况来看,Ⅱ型和Ⅲ型术中出血明显多于Ⅰ型,表明Ⅱ、Ⅲ型CSP术中更易发生出血风险;手术时间方面,Ⅲ型患者用时明显多于其余两组,手术处理时间更长,提示此种类型CSP宫腔镜下处理较困难,另外CSP病灶凸向膀胱,增加了操作难度;全部CSP患者均无手术并发症发生,证明宫腔镜手术对于各种类型CSP均相对安全;Ⅰ型和Ⅱ型单次宫腔镜手术成功率显著高于Ⅲ型,说明宫腔镜手术更适用于Ⅰ、Ⅱ型患者,而Ⅲ型病例因手术成功率较低,可能并不适用于宫腔镜手术处理,对于个别生育要求迫切的患者需在术前充分交代病情,并在备好腹腔镜或开腹手术基础上,可尝试作为初始治疗方案。在术后恢复方面,Ⅲ型患者经治疗超声影像恢复正常时间显著慢于Ⅰ、Ⅱ型,因此对于Ⅲ型病例需延长随访观察时间。鲁海燕等[21]认为对于外生型CSP患者切除病灶后,为降低瘢痕妊娠再次发生的概率,需对子宫瘢痕处缺损进行修补。李康宁等[22]收集剖宫产瘢痕妊娠病例40例,分为瘢痕修补组及未修补组,利用宫腔超声造影检测治疗半年后瘢痕恢复情况,发现两组瘢痕类型无明显差异,因此其认为瘢痕修补术并未明显改善CSP患者的瘢痕形态。本文对宫腔镜治疗后妊娠结局进行调查,所有病例均无CSP及子宫破裂情况发生,说明宫腔镜手术虽然不能从根本上解决CSP患者瘢痕薄弱状态,但并没有增加再次CSP及子宫破裂发生风险,但因目前随访病例数较少,可能对研究结论带来一定影响,后续工作中会进一步扩大病例样本量后进行探讨,以期得到更科学的结论。
综上所述,宫腔镜手术对于不同临床分型的CSP患者均有一定的治疗作用,其中Ⅰ型及绝大部分Ⅱ型病例成功率较高,而对于Ⅲ型患者需充分交代风险并准备好应急方案后可酌情实施;同时,我们更应该注重对CSP的预防,因此把握好剖宫产指征,控制剖宫产率才是根本。
【参考文献】
[1] Larsen JV,Solomon MH. Pregnancy in a uterine scar sacculus--an unusual cause of postobortal haemorrhage. A case report[J].S Afr Med J,1978,53:142-143.
[2] Cok T,Kalayci H,Ozdemir H,et al. Transvaginal ultrasound-guided local methotrexate administration as the first-line treatment for cesarean scar pregnancy: follow-up of 18 cases[J]. J Obstet Gynaecol Res,2015,41:803-808.
[3] Yang Q,Piao S,Wang G,et al. Hysteroscopic surgery for ectopic pregnancy in the cesarean scar[J].J Minim Invasive Gynecol,2009,16:432-436.
[4] Vial Y,Petignat P,Hohlfeld P.Pregnancy in a cesarean scar[J].Ultrasound Obstet Gynecol,2000,16:592-593.
[5] 中华医学会妇产科学分会计划生育学组.剖宫产术后子宫瘢痕妊娠诊治专家共识[J].中华妇产科杂志,2016,51:5-9.
[6] Jurkovic D,Hillaby K,Woelfer B,et al. First-trimester diagnosis and management of pregnancies implanted into the lower uterine segment cesarean section scar[J].Ultrasound Obstet Gynecol,2003,21:220-227.
[7] Timor-Tritsch IE,Monteagudo A,Cali G,et al. Cesarean scar pregnancy and early placenta accrete share common histology[J]. Ultrasound Obstet Gynecol,2014,43:383-395.
[8] 张宁宁,杨清.早孕期剖宫产瘢痕妊娠的临床及病理特点分析[J].中国医科大学学报,2011,40:458-461.
[9] 苏冠男,王武亮,袁博,等. 子宫切口瘢痕憩室形成的相关因素研究[J].中国全科医学,2015,18:421-424.
[10] Rotas MA,Haberman S,Levgur M. Cesarean scar ectopic pregnancies: etiology,diagnosis,and management[J]. Obstet Gynecol,2006,107:1373-1381.
[11] 石华亮,庞倩芸,卢再鸣. 剖宫产瘢痕妊娠的MRI特点及MRI对其诊治指导价值[J]. 中国临床医学影像杂志,2011,22: 51-54.
[12] Huang Q,Zhang M,Zhai RY. Comparison of gadolinium-enhanced magnetic resonance imaging with ultrasound in evaluation of cesarean scar pregnancy[J].J Obstet Gynaecol Res,2014,40:1890-1893.
[13] 林蓉,韦娟冰,王金华. 29例子宫切口瘢痕妊娠治疗方法的临床观察[J].生殖医学杂志,2017,26:486-489.
[14] American College of Obstetricians and Gynecologists. ACOG Practice Bulletin No. 94: Medical management of ectopic pregnancy[J]. Obstet Gynecol,2008,111:1479-1485.
[15] 毕建蕾,杨清,毕芳芳. 剖宫产瘢痕妊娠的临床特点及不同临床类型治疗结果的回顾性分析[J].中国医科大学学报,2012,41:465-468.
[16] 张青,姜丽,曹云桂. 剖宫产瘢痕妊娠的术式选择[J].中国微创外科杂志,2015,15:1025-1027.
[17] de Vaate AJ,Brölmann HA,van der Slikke JW,et al. Therapeutic options of caesarean scar pregnancy:case series and literature review[J]. J Clin Ultrasound,2010,38:75-84.
[18] Litwicka K,Greco E. Caesarean scar pregnancy:a review of management options[J]. Curr Opin Obstet Gynecol,2011,23:415-421.
[19] Yin X,Su S,Dong B,et al. Angiographic uterine artery chemoembolization followed by vacuum aspiration:an efficient and safe treatment for managing complicated cesarean scar pregnancy[J]. Arch Gynecol Obstet,2012,285:1313-1318.
[20] Li YR,Xiao SS,Wan YJ,et al. Analysis of the efficacy of three treatment options for cesarean scar pregnancy management[J].J Obstet Gynaecol Res,2014,40:2146-2151.
[21] 鲁海燕,张文华,单君,等. 经阴道手术治疗剖宫产术后子宫瘢痕妊娠31例临床分析[J].中华妇产科杂志,2011,46:917-922.
[22] 李康宁,姜玉新,刘真真,等.宫腔超声造影对剖宫产瘢痕妊娠治疗后的远期随访评估[J].中国医学影像技术,2016,32:411-415.

