525例伴血脂异常IgA肾病患者的临床病理分析
王宇, 古炀晖, 程小红, 刘旭生, 邹川
(1.广州中医药大学第二临床医学院,广东 广州510405;2.深圳市中医院心内科,广东深圳518033;3.陕西省中医医院肾病科,陕西 西安710003;4.广东省中医院肾病科,广东广州510120)
IgA肾病(IgA nephropathy,IgAN)是目前世界范围内最常见的原发性肾小球肾炎之一[1],占我国原发性肾小球肾炎的 45.2% ~58.2%[2-3].30%以上IgA肾病患者在20年内可进展至终末期肾病[3].有研究表明代谢综合征与IgA肾病预后,包括高脂血症、肥胖、高血压等组成的代谢综合症是IgA肾病进入终末期肾病的危险因素,从改善预后的角度出发,必须重视IgA肾病患者的血脂异常情况[4].根据2007年《中国成人血脂异常防治指南》[5],临床上将不同血脂成分的异常分成4个临床分型:高甘油三酯血症、高胆固醇血症、混合型高脂血症、低高密度脂蛋白血症.不同血脂成分的异常对人体产生不同的影响,日本学者对2 283例IgA肾病患者的预后因素进行分析,发现性别、年龄、血压、尿蛋白、血清白蛋白、尿红细胞计数、eGFR、病理病变严重程度等因素对IgA肾病患者的预后具有重要影响[6],并在此基础上建立了IgA的预后相关模型,经Bjorneklett等[7]验证,该模型同样可用于丹麦患者,可认为是IgA肾病患者的重要观察指标.Katafuchi积分系统[8]是一个用于IgA肾病病理诊断的半定量积分工具,可量化不同病变的程度,尤其对于亚洲人适用.
本研究借助katafuchi病理积分系统,对500余例不同血脂类型的IgA肾病患者预后相关的临床、病理指标进行比较,旨在更全面的了解血脂代谢异常与IgA肾病的相关性,为降脂治疗延缓IgA肾病提供初步实验依据.
1 资料与方法
1.1 研究对象
2011年1月至2014年12月在广东省中医院、陕西省中医医院住院经肾穿刺活检术诊断IgA肾病的患者.该课题已通过广东省中医院伦理委员会批准,已对被调查者解释研究的目的并获得同意,并签署知情同意书.
1.2 方法
1.2.1 纳入和排除标准
(1)纳入标准:①符合2012年KDIGO肾小球肾炎指南中IgA的诊断标准;②肾穿刺组织活检病理诊断为IgA肾病.
(2)排除标准:①存在各种原因引起的急性肾损伤;②合并其他继发性肾小球肾炎,如系统性红斑狼疮、过敏性紫癜、乙型肝炎等;③资料严重不全者.
1.2.2 资料采集
(1)人口学资料:患者姓名、性别、基线年龄;(2)临床资料:基线病程、尿沉渣红细胞计数、血肌酐、尿酸、肾小球滤过率估计值(estimated glomerular filtration rate,eGFR,使用 CKD-EPI公式计算)、24 h尿蛋白定量、血清白蛋白、血脂.(3)肾穿资料:请2位病理科医师重新对每例肾活检组织标本阅片,病变使用Katafuchi积分系统包括小球积分、小管-间质积分、血管积分进行评定.
1.2.3 血脂异常的定义
根据文献[7]对血脂类型进行划分,高甘油三酯血症:TG浓度≥2.26 mmol/L,高胆固醇血症:TG浓度≥2.26 mmol/L,混合型高脂血症:TG浓度≥2.26mmol/L且 TG浓度≥2.26 mmol/L,低高密度脂蛋白血症:HDL-C浓度<1.04mmol/L.
1.3 统计分析
采用SPSS 20.0统计学软件进行统计分析,计量资料中呈正态分布者以(均数±标准差)表示,非正态分布者使用中位数(四分位数间距)表示,计数资料使用频数(百分比)表示;符合正态分布的计量资料通过t检验或方差分析进行比较.
等级资料及不符合正态分布的计量资料使用秩和检验进行比较;非等级计数资料率的比较使用卡方检验.多组间构成比的比较使用卡方检验/Fisher确切概率法,如存在统计学差异,则进一步行组间两两比较,并校正检验水准(α′=α/n,其中α′为校正后的检验水准,α=0.05,n=两两比较的次数).
多组间计量资料的比较,如不符合正态分布,则用秩和检验进行统计分析,如存在统计学差异,则进一步行两两比较,使用bonferroni法校正P值.多组间等级资料的比较,用秩和检验进行统计分析,如存在统计学差异,则进一步行两两比较,使用bonferroni法校正P值.两两比较的结果均在在图中体现.以上统计方法均使用双侧检验,取检验水准α=0.05.
2 结果
2.1 一般资料
本研究共纳入684例经肾穿诊断为IgA肾病患者,剔除符合排除标准159例后,共525例进入统计分析,男265例,女260例,平均年龄35.1岁按血脂进行分组,血脂正常者273例(52.0%),血脂代谢异常者252例(48%),高胆固醇血症48例(9.1%),高甘油三酯血症83例(15.8%),混合型高脂血症35例(6.7%),低高密度脂蛋白血症86例(16.4%).
2.2 按血脂代谢是否异常分组比较
血脂正常与血脂代谢异常患者的临床指标比较(表1).血脂代谢异常的IgA肾病患者男性比例较高(P=0.010),年龄较大(P=0.002),伴随高血压的比例较大(P<0.001),eGFR水平较低(P=0.001),尿酸水平更高(P<0.001),24h尿蛋白排泄量更大(P<0.001)且血清白蛋白水平相对较低(P<0.001).
两组患者的病程和尿红细胞计数,无统计学差异.病理损害方面(表2),525例患者的katafuchi积分为0~21分,平均为8.6分,其中小球积分为0~10分,平均为4.5分,小管-间质积分为0~9分,平均为3.1分,血管积分为0~4分,平均为1.0分.血脂代谢异常组的Katafuchi总分较高(P=0.022),进一步细分,小球损害方面,虽然两组小球积分无明显差异,但血脂代谢异常组的节段损害积分更高(P=0.046),血脂代谢异常组的小管间质积分显著高于血脂正常组,主要在于间质纤维化(P=0.003)和小管萎缩更重(P=0.006),血管积分未发现统计学差异.故两组的病理损害差别主要在于血脂代谢异常患者的小球节段损害更重、间质纤维化和小管萎缩更加明显.

表1 血脂正常与血脂代谢异常IgA肾病患者的临床指标比较Table 1 Comparison of clinical parameters between normal blood lipid and abnormal lipid metabolism in patientsw ith IgA nephropathy
2.3 按血脂类型分组比较
将血脂代谢异常的IgA肾病患者,进一步分组:高甘油三酯血症组、高胆固醇血症组、混合型高脂血症组、低高密度脂蛋白血症组.临床指标方面比较(表3),由于数据均不符合正态分布,经秩和检验得出,不同类型血脂代谢异常患者的性别比例(P=0.010)、病程(P=0.020)、高血压伴发率(P=0.007)、血尿酸(P=0.020)、尿蛋白定量(P<0.001)、血清白蛋白(P<0.001)存在统计学差异.低高密度脂蛋白血症患者的女性比例高于高胆固醇血症组(P=0.001),高甘油三脂血症患者的病程(P=0.014)、伴有高血压的比例(P=0.001),尿酸水平(P=0.047)高于高甘油三酯血症组;高胆固醇血症组和混合型高脂血症组的血清白蛋白水平低于高甘油三酯和低高密度脂蛋白血症组,而前两者的尿蛋白水平高于后两者.病理指标方面相比(表4),通过秩和检验统计分析,各组的 Katafuchi总积分,无统计学差异(P=0.153),小管间质损害无明显差异;小球积分虽差异不明显,但高甘油三酯血症组小球增殖积分低于高胆固醇血症组(P=0.030),血管积分存在差异,高甘油三酯血症组的血管壁增厚程度明显高于高胆固醇血症组(P=0.010).

表2 血脂正常与血脂代谢异常IgA肾病患者的病理指标比较Table 2 Comparison of pathological parameters between normal blood lipid and abnormal lipid metabolism in patientsw ith IgA nephropathy
表3 不同类型血脂代谢异常患者的临床指标Table 3 Clinical parameters of patientsw ith different types of dyslipidem ia

表4 不同类型血脂代谢异常患者的病理指标Table 4 pathological parameters of patients w ith different types of dyslipidem ia
2.4 分组两两比较

图1 性别Fig.1 Gender

图2 年龄Fig.2 Age

图3 病程Fig.3 Course of disease
不同血脂类型IgA患者的临床指标差异,低高密度脂蛋白血症患者的男性比例较血脂正常和高胆固醇血症患者的比例高(图1);高甘油三酯血症和混合型高脂血症患者的年龄较血脂正常组大(图2);病程,高甘油三酯血症组较高胆固醇血症组的病程长(图3);将有高血压病史、基线收缩压≥140 mmHg和/或基线舒张压≤90 mmHg,定义为伴有高血压,则高甘油三酯血症组较血脂正常组、高胆固醇血症组的高血压比例高(图4);各组患者的eGFR无统计学差异,(图5);血尿酸浓度,高甘油三酯血症组较血脂正常组、高胆固醇血症组高,低高密度脂蛋白血症组较高胆固醇血症组高(图6);血清白蛋白,(血脂正常组、高甘油三酯血症组、低高密度脂蛋白血症组)>(高胆固醇血症、混合型高脂血症组)(图7);24 h尿蛋白排泄量,混合型高脂血症组>高胆固醇组>高甘油三酯血症组>(血脂正常组、第高密度脂蛋白血症组)(图8).

图4 高血压Fig.4 Hypertension
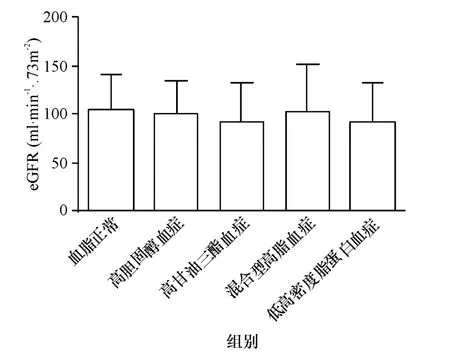
图5 估算肾小球滤过率Fig.5 eGFR

图6 血尿酸Fig.6 Serum uric acid

图7 血清白蛋白Fig.7 Serum albumin
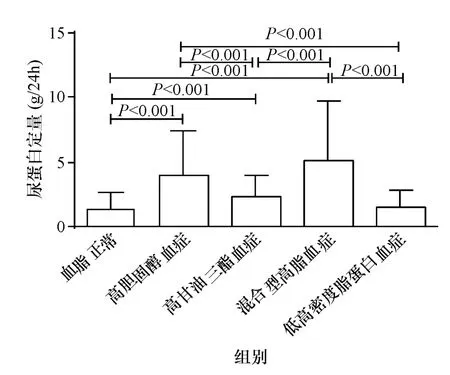
图8 24 h尿蛋白Fig.8 Urinary protein/24 h
病理方面比较,高甘油三脂血症组的间质纤维化积分、小管萎缩积分、小管间质积分、血管壁增厚积分、血管积分、katafuchi总积分高于血脂正常组(图9,图11~图15);高甘油三脂血症组的小球增殖积分低于高胆固醇血症组(图10),血管积分、血管壁增厚积分高于高胆固醇血症组(图14,图15).混合型高脂血症同时合并了高胆固醇血症和高甘油三酯血症,结果却显示混合型高脂血症患者的病理损害程度并不突出,可能与该型样本量较少导致统计效能较低有关.
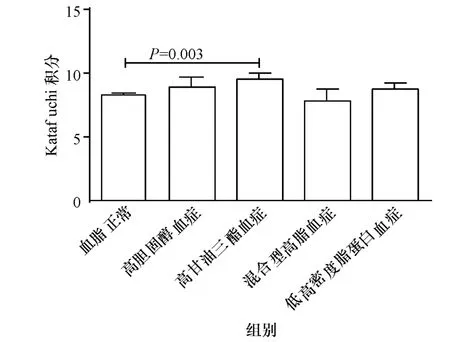
图9 Katafuchi积分Fig.9 Katafuchi score

图10 小球增殖积分Fig.10 Glomerular proliferation score

图11 小管间质积分Fig.11 Tubulointerstitial score

图12 间质纤维化积分Fig.12 Interstitial fibrosis score

图13 小管萎缩积分Fig.13 Tubular atrophy score

图14 血管积分Fig.14 Vascular score

图15 血管增厚积分Fig.15 Vessel wall thickening
3 讨论
本研究结果提示,不同类型血脂异常的IgA肾病患者,分别在多个不同的临床病理指标与血脂正常患者存在差异.临床指标方面,低高密度脂蛋白组的男性比例较高;混合型高脂血症组和高甘油三酯血症组年龄较大;高甘油三酯血症组病程较长、合并高血压患者比例高;高甘油三酯血症和低高密度脂蛋白组尿酸较高;混合型高脂血症组、高胆固醇血症组、高甘油三酯血症组的尿蛋白排泄量较大,其中混合型高脂血症组、高胆固醇血症组的血清蛋白相对更低.病理方面,高甘油三酯血症组的Katafuchi积分高于血脂正常组,更细致地划分,显示Katafuchi总积分的差异在于小管间质积分和血管积分,小管间质积分的差异在于间质纤维化积分和小管萎缩积分,血管积分的差异在于血管壁增厚积分.据此推测,血脂异常中,高甘油三酯血症是血脂代谢异常加重IgA肾病患者肾脏损害的主因,其病理改变可能主要在肾小动脉,其次在肾小管-肾间质.
沈姗等[9]将70例IgA肾病患者分为高脂血症组、非高脂血症组,发现高脂血症组血肌酐、尿素氮、血尿酸和24 h尿蛋白定量高于非高脂血症组;而年龄、收缩压、舒张压、血浆白蛋白、血尿程度与非高脂血症组相比较,无统计学差异;高脂血症组的肾小球硬化、肾小管间质病变程度和血管病变发生率较高、较重.秦菊等[10]对116例 IgA肾病患者进行类似研究,发现与血脂正常组相比,血脂升高组血肌酐、血尿酸、血尿素氮、24 h尿蛋白定量均增高,eGFR降低,肾小管/间质萎缩较严重.李瑜祯等[11]、刘擘等[12]的研究与上述研究基本一致.本研究中,将血脂异常按照临床类型作进一步划分,不同类型高脂血症的IgA肾病患者的临床和病理面貌展示得更为细致,旨在研究不同高脂血脂类型与肾小球不同部件及不同程度病理损伤之间的联系.
日本的研究结果提示男性是IgA肾病10年内进入透析或死亡的危险因素,而低高密度脂蛋白血症患者的男性比例高于血脂正常和高胆固醇血症组,肝脂肪酶可以分解高密度脂蛋白胆固醇,其活性对高密度脂蛋白影响较大,Carr等[13]发现肝脂肪酶在男性身上的活性较高,提示低高密度脂蛋白血症患者明显以男性居多的原因.既往已有多个研究发现,随着年龄增长,高甘油三酯血症的发生率逐渐增高[14-16],导致高甘油三酯血症组和混合型高脂血症组的年龄较血脂正常组大.凝集素样氧化型低密度脂蛋白受体1与内皮型一氧化氮合酶、肾素-血管紧张素-醛固酮系统、内皮素1、内皮素转化酶1相互作用,共同促进高血压的发生发展[17],凝集素样氧化型低密度脂蛋白受体通过凝集素样氧化型低密度脂蛋白受体1增强血管渗透性,导致甘油三酯再沉积[17-19],高血压、高甘油三酯血症通过凝集素样氧化型低密度脂蛋白受体1互相促进彼此的病理生理进程,因此高甘油三酯血症患者更容易伴随高血压病.
各组患者的eGFR未见明显差异,但病理结果提示,高甘油三酯血症患者的肾损害较血脂正常组为重.脂代谢异常患者更容易伴有摄入能量过多,使得嘌呤合成增加,也更容易出现脂肪酸分解产生酮体,从而阻碍尿酸的排出,脂代谢异常者更容易伴有胰岛素抵抗,引起高胰岛素血症,过多的胰岛素不仅可以干扰脂质代谢,还能促进肾小管对尿酸的重吸收[20],既往的研究已经证实血尿酸水平与甘油三酯水平呈正相关,而与高密度脂蛋白水平呈负相关[21].蛋白尿的大量排泄,可直接使血清白蛋白下降,故尿蛋白排泄量大者,血清白蛋白较低,而血清中蛋白的下降可以引起继发性脂蛋白合成增加及分解代谢下降[22],造成总胆固醇明显上升,故高胆固醇血症和混合型高脂血症患者的尿蛋白较多和低血清白蛋白浓度较低.
血脂代谢异常尤其是高甘油三酯血症可以促进肾内大血管和微血管硬化,甘油三酯可以通过促进血管内皮下的低密度脂蛋白沉积和氧化应激,使血管壁增厚,张国莹等[23]认为甘油三酯可经过非受体介导途径造成血管内皮损伤,Murano等[24]发现富含TG的脂质存在apo E,其可以通过与内皮细胞结合,增加脂质在内皮细胞下的沉积,加剧血管壁硬化增厚.毛细血管内皮损伤增加血管通透性的同时,也可加重和促进肾脏纤维化的进程,血液中的血浆脂蛋白沉积于血管壁的内膜,导致肾脏血管平滑肌细胞增生形成斑块,逐步发展呈肾动脉硬化,肾脏缺血缺氧、肾脏内固有细胞纤维化病变,最终导致肾间质纤维化增生[25].Bolton等[26]发现 IL-6、TNFα、内皮依赖血管舒张因子等反应血管内皮功能损伤的炎症活性因子,其水平与甘油三酯呈正相关,甘油三酯与血管内皮损伤及炎性因子释放关系密切,可加重血管病变,或导致累积肾小球、肾小管间质的一系列变化.Moorhead等[27]认为持续的血脂代谢异常可以促进和加重肾内的纤维化,引起大量脂蛋白沉积于肾小管,激活循环内的单核细胞向小球浸润,进一步加重肾脏炎症反应,加重小管间质损害.吴剑敏等[28]发现甘油三酯可以分解成游离脂肪酸,产生脂毒性作用,参与肾小管上皮细胞损害,直接或间接参与肾小管间质的慢性进行性病变.
临床研究显示,血脂代谢异常不仅可以增加慢性肾脏病患者的心血管并发症,还可能加重IgA肾病患者的肾脏损害,加速IgA肾病向终末期肾病进展,是重要的预后因子[29].Syrjänen[30]等对224例IgA肾病患者进行了中位随访时间为10年的随访,发现基线甘油三酯增高是IgA肾病的进展的重要危险因素;IgA肾病患者使用他汀类药物可以稳定肾功能,进一步证实调控血脂可改善IgA肾病预后[31].本研究结果显示高甘油三酯血症患者肾穿时Katafuchi积分中有多项高于血脂正常组,提示其可以加重肾间质纤维化、肾小管萎缩、肾血管硬化,从而加速IgA肾病的进展.
结合本研究结果,初步认为各种血脂异常的主要临床指标并不完全相同,更明确的是不同类型血脂异常对IgA肾病的肾脏病变严重程度的影响可能并不一致,主要在于高甘油三酯血症可以加重IgA肾病患者的肾血管硬化、肾间质纤维化和肾小管萎缩,但高甘油三酯血症是否通过血管硬化加重小管间质病变,还是可以直接通过脂质肾毒性加重小管间质病变,根据现有的数据,还无法得出确切的结论,有待以后的进一步研究.本研究表明高胆固醇血症与肾脏病理改变无相关性,与徐安平[12]的研究一致.之前著名的“STOP IgAN”研究[32]在强化支持治疗中对患者脂代谢异常进行纠正,发现严格的血压控制联合代谢紊乱各方面的纠正能够显著延缓IgA肾病患者肾功能下降速度.
综上所述,早期高甘油三酯血症即可以加重IgA肾病病变,尤其是对小管间质和血管的损伤,并由此增加IgA肾病进展的风险.提示临床上对IgA患者的血脂管理应更加关注甘油三酯的异常增高,积极纠正甘油三酯代谢异常可能有助于改善IgA肾病患者的预后.
[参考文献]
[1]DONDIO JV,GRANDE J P.IgA nephropathy[J].N Engl JMed,2002,347(10):738-748.
[2]LI L S,LIU Z H.Epidemiologic data of renal diseases from a single unit in China:analysis based on 13,519 renal biopsies[J].Kidney Int,2004,66(3):920-923.
[3]ZHOU F D,ZHAO MH,ZOU W Z,et al.The changing spectrum of primary glomerular diseases within 15 years:a survey of 3331 patients in a single Chinese centre[J].Nephrol Dial Transplant,2009,24(3):870-876.
[4]KOVACST,VAS T,KOVESDY C P,et al.Metabolic syndrome and other cardiovascular risk factors associated with the progression of IgA nephropathy[J].Clinical Kidney Journal,2013,6(4):395-401.
[5]中国成人血脂异常防治指南制订联合委员会.中国成人血脂异常防治指南[J].中华心血管病杂志,2007,35(5):390-419.Joint Committee on the development of guidelines for the prevention and treatment of dyslipidemia in Chinese adults.Guidelines for the prevention and treatment of dyslipidemia in Chinese adults[J].Chinese Journal of Cardiology,2007,35(5):390-419.
[6]GOTO M,KAWAMURA T,WAKAI K,et al.Risk stratification for progression of IgA nephropathy using a decision tree induction algorithm[J].Nephrol Dial Transplant,2009,24(4):1242-1247.
[7]BJORNEKLETT R,VIKSE B E,BOSTAD L,et al.Long-term risk of ESRD in IgAN;validation of Japanese prognostic model in a Norwegian cohort[J].Nephrol Dial Transplant,2012,27(4):1485-1491.
[8]KATAFUCHIR,KIYOSHIY,OH Y,et al.Glomerular score as a prognosticator in IgA nephropathy:its usefulness and limitation[J].Clin Nephrol,1998,49(1):1-8.
[9]沈姗,柴华旗.高脂血症与IgA肾病临床病理的相关性分析[J].中国血液流变学杂志,2013,(2):268-270,273.SHEN S,CHAI H Q.Hyperlipidemia and IgA nephropathy clinical pathological correlation analysis[J].Chinese Blood Rheology Magazine,2013,(2):268-270,273.
[10]秦菊,李璐,廖蕴华.高脂血症对原发性IgA肾病的临床及病理影响[J].微创医学,2015,10(3):287-289.QIN J,LI L,LIAO Y H.Clinical and pathological effects of hyperlipidemia on primary IgA nephropathy[J].Minimally Invasive Medicine,2015,10(3):287-289.
[11]李瑜祯,贾汝汉,刘红燕.伴有高脂血症的IgA肾病临床和病理分析[J].临床肾脏病杂志,2011,11(4):157-159.Li Y Z,JIA R H,LIU H Y.Clinical and pathological analysis of IgA nephropathy associated with hyperlipidemia[J].Journal of Clinical Nephrology,2011,11(4):157-159.
[12]刘擘,曾玉纯,李劲高,等.伴血脂异常的 IgA肾病的临床及病理特征[J].中华临床医师杂志(电子版),2015,(14):2669-2672.LIU B,ZENG Y C,LI J G,et al.Clinical and pathological features of IgA nephropathy with dyslipidemia[J].Chinese Journal of Clinicians(Electronic Edition),2015(14):2669-2672.
[13]CARR MC,HOKANSON JE,ZAMBON A,et al.The contribution of intraabdominal fat to gender differences in hepatic lipase activity and low/high density lipoprotein heterogeneity[J].J Clin Endocrinol Metab,2001,86(6):2831-2837.
[14]YAMAGUCHIM,IGARASHIA,UCHIYAMA S,et al.Hyperlipidemia is induced in regucalcin transgenic rats with increasing age[J].Int JMol Med,2004,14(4):647-651.
[15]常永超,江涛,李维,等.不同年龄成年体检者血糖和血脂的变化特点[J].河南科技大学学报(医学版),2009,27(2):146-147.CHANG Y C,JIANG T,LIW,et al.Characteristics of blood glucose and blood lipids in adults of different ages[J].Journal of Henan University of Science and Technology(Medical Edition),2009,27(2):146-147.
[16]刘小平,徐薇.不同年龄组人群血脂水平的观察与对比[J].南京铁道医学院学报,1999,(3):186-187.LIU X P,XU W.Observation and comparison of blood lipid levels in different age groups[J].Journal of Nanjing Railway Medical College,1999,(3):186-187.
[17]郑礼杰,何凤屏.LOX-1与高血压、高脂血症的相关性研究进展[J].分子诊断与治疗杂志,2012,4(1):54-58.ZHENG L J, HE F P.LOX-1 and hypertension,hyperlipidemia correlation research progress[J].Molecular Diagnosis and Treatment Journal,2012,4(1):54-58.
[18]NAKANO A,INOUE N,SATO Y,et al.LOX-1 mediates vascular lipid retention under hypertensive state[J].JHypertens,2010,28(6):1273-1280.
[19]殷玥琪,杨立刚,孙桂菊.高脂血症与高血压相关性及其代谢异常研究进展[J].中国老年学杂志,2014,34(5):1414-1417.YIN Y Q,YANG L G,SUN G J.Hyperlipidemia and hypertension and abnormalmetabolism research progress of[J].Chinese Journal of Gerontology,2014,34(5):1414-1417.
[20]卢光娅,张玲.高尿酸血症与代谢综合征的相互影响及研究进展[J].重庆医学,2011,40(15):1542-1543.LU G Y,ZHANG L.Interaction and research progress of hyperuricemia and metabolic syndrome[J].Chongqing Medical Sciences,2011,40(15):1542-1543.
[21]TSOULISG,LIBEROPOULOSi E N,MIKHAILIDISD P,et al.Elevated serum uric acid levels in metabolic syndrome:an active component or an innocent bystander?[J].Metabolism,2006,55(10):1293-1301.
[22]MYLES J L.Diagnostic atlas of renal pathology:a companion to Brenner&Rector′s the kidney,9th edition[M].Elsevier/Saunders,2012:923.
[23]张国莹,傅鹏,袁伟杰.甘油三酯“肾毒性”研究进展[J].国外医学(泌尿系统分册),2003,23(3):322-325.ZHANG G Y,FU P,YUANW J.Progress in the study of renal toxicity of triglycerides[J].Foreign Medicine(urinary tract fascicle),2003,23(3):322-325.
[24]MURANO T,MATSUMURA R,MISAWA Y,et al.Interaction of endothelial cells and triglyceride-rich lipoproteins with apolipoprotein E(Arg-->Cys)from a patient with lipoprotein glomerulopathy[J].Metabolism,2002,51(2):201-205.
[25]VAZIRIN D.Dyslipidemia of chronic renal failure:the nature,mechanisms,and potential consequences[J].Am J Physiol Renal Physiol,2006,290(2):F262-F272.
[26]BOLTON C H,DOWNS L G,VICTORY JG,et al.Endothelial dysfunction in chronic renal failure:roles of lipoprotein oxidation and pro-inflammatory cytokines[J].Nephrol Dial Transplant,2001,16(6):1189-1197.
[27]MOORHEAD JF,CHAN MK,EL-NAHASM,et al.Lipid nephrotoxicity in chronic progressive glomerular and tubulo-interstitial disease[J].Lancet,1982,2(8311):1309-1311.
[28]吴剑敏,吴可贵,陈纯娴,等.代谢综合征早期肾损害[J].中外健康文摘,2010,7(15):7-8.WU JM,WU K G,CHEN C X,et al.Early renal damage ofmetabolic syndrome[J].Chinese and Foreign Health Abstracts,2010,7(15):7-8.
[29]MYLLYMAKI J,SYRJANEN J,HELIN H,et al.Vascular diseases and their risk factors in IgA nephropathy[J].Nephrol Dial Transplant,2006,21(7):1876-1882.
[30]SYRJANEN J, MUSTONEN J, PASTERNACK A.Hypertriglyceridaemia and hyperuricaemia are risk factors for progression of IgA nephropathy[J].Nephrol Dial Transplant,2000,15(1):34-42.
[31]MORIYAMA T,OSHIMA Y,TANAKA K,etal.Statins stabilize the renal function of IgA nephropathy[J].Ren Fail,2014,36(3):356-360.
[32]RAUEN T,EITNER F,FITZNER C,et al.Intensive Supportive Care plus Immunosuppression in IgA Nephropathy[J].N Engl JMed,2015,373(23):2225-2236.

