“培土生金法”早期干预改善支气管哮喘模型幼鼠气道炎症反应的机制
梁丹丹, 刘华, 欧阳学认, 周娟, 张芹欣, 黄丽,钟如帆, 刘媛, 宋文才, 孙少丹, 陈晓刚
(1.广州中医药大学第一临床医学院,广东广州510405;2.广州中医药大学第一附属医院,广东 广州510405)
支气管哮喘(简称哮喘)是儿童期最常见的呼吸道疾病之一,以慢性气道炎症和气道高反应性为特征.近年来,婴幼儿期的哮喘发病率呈显著上升趋势,且较年长儿更难诊断鉴别与预防控制,所以受到越来越多的重视[1].吸入糖皮质激素(inhaled corticosteroid,ICS)、白三烯受体拮抗剂(leukotriene receptor antagonists,LTRAs)等治疗,虽然有助于控制儿童哮喘的症状发作及改善肺功能,但并不能改变疾病的自然病程.尤其需要注意的是,对于婴幼儿期反复喘息的患儿,ICS及LTRAs的具体使用方法仍存在较大争议[2-3].因此,如何更有效地早期防治婴幼儿哮喘,是目前儿科临床的热点和难题.本实验在中医“肺脾相关”理论的指导下,通过动物实验,研究“培土生金”法的代表方剂—异功散早期干预以改善哮喘模型幼鼠气道炎症反应的作用,以探索中医药防治儿童哮喘的药理机制.
1 材料与方法
1.1 实验动物
SPF级BALB/c雌性幼鼠,7日龄,购自广州中医药大学实验动物中心,许可证标号:SYXK(粤)2013-0092.喂养条件保持室温21~25℃,相对湿度50%~70%.喂养过程中幼鼠自行摄食及饮水.
1.2 药物及主要试剂
鸡卵清蛋白(ovalbumin,OVA),购自于美国Sigma公司.白细胞介素 10(interleukin 10,IL-10)、转化生长因子-β1(transforming growth factorbeta1,TGF-β1)及白细胞介素-17(interleukin 17,IL-17)的酶联免疫吸附(ELISA)实验试剂盒,均购自于森贝伽(南京)生物科技有限公司.异功散由人参(Panax ginseng C.A.Mey)、白术(Atractylodes macrocephala Koidz.)、茯苓(Poria cocos(Schw.)Wolf)、广陈皮(Citrus reticulata Blanco)、甘草(Glycyrrhiza uralensis Fisch)按1∶1∶1∶1∶1比例配成,由广州中医药大学第一附属医院中药房提供,制成水煎剂,并配成含生药质量浓度为1 g/mL的溶液.常乐康胶囊(酪酸梭状芽孢杆菌/婴儿型双歧杆菌二联活菌)由山东科兴生物制品有限公司提供.
1.3 主要仪器
C28-NSET8 C型简易雾化器,欧姆龙(大连)有限公司;自制20 cm×20 cm×30 cm的密闭容器;AE-200电子分析天平,梅特勒-托利多仪器(上海)有限公司;3K30低温高速离心机,美国sigma公司;电热恒温水温箱,上海跃进医疗器械厂;Multiskan MK3酶标仪,美国 Thermo公司;LEICA RM2255切片机,德国 LEICA公司;BX50F-3型OLYMPUS显微镜,日本奥林巴斯公司;YABO200漂烘片机,常州市雅博电子设备有限公司;LEICA AUTO STAINER XL全自动染片机,德国LEICA公司;CMIAS系列多功能真彩分析系统(北京麦克奥迪图像技术有限公司).
1.4 分组、造模及给药
幼鼠适应性饲养3 d后,按简单随机分配法分为6组:正常对照组、模型对照组、异功散高剂量组、异功散中剂量组、异功散低剂量组及益生菌组,每组各10只.造模过程由致敏和激发两个阶段组成:致敏阶段,所有幼鼠于第1天和第13天行腹腔注射,除健康对照组注射生理盐水0.2 mL外,其余幼鼠均注射致敏液0.2 mL(质量分数为10%OVA溶液0.1 mL与等体积佐剂液态铝混合);激发阶段,于第19~24天将致敏小鼠置于20 cm×20 cm×30 cm密闭容器内雾化吸入20 min,除正常对照组雾化吸入生理盐水外,其余幼鼠均雾化吸入质量分数为3%的OVA溶液,每日1次.激发后幼鼠出现烦躁不安或安静少动、喷嚏频繁、抓鼻、弓背、前肢缩抬、呼吸急促、喘息及腹部内凹等,视为哮喘造模成功.
各组均自造模当天起,以1次/d连续经口灌药至造模结束,共24 d;其中异功散高、中、低剂量组按《实验药理方法学》[4]动物与人药物剂量换算方式分别以人剂量的2倍、1倍、0.5倍给予每只每次 20 g/kg、10 g/kg、5 g/kg的异功散水煎液,益生菌组每只每次以常乐康菌粉420 mg(含婴儿双歧杆菌活菌数不低于1.0×106CFU/g,酪氨酸梭状芽孢杆菌不低于 1.0×107CFU/g),均稀释为25 mL/kg后,用新生儿留置针经口灌服,模型对照组与正常对照组则灌服等量生理盐水.
1.5 标本采集与指标检测
(1)标本采集:末次激发24 h后麻醉处死幼鼠,取仰卧位,打开胸腔,暴露气管及肺组织,分离肺组织,结扎右侧主支气管,用留置针行气管插管,用0.3 mL生理盐水灌洗左肺3次,支气管肺泡灌洗液(BALF)3 000 r/min离心 5 min,取上清液装于EP管中,-80℃保存,待测细胞因子.
(2)肺组织病理观察:取未灌洗的右侧肺组织用体积分数为4%多聚甲醛固定常规脱水包埋,切片后行苏木精-伊红染色法(hematoxylineosin staining,HE)染色,在镜下观察肺组织病理学变化,并根据Underwood标准进行评分[5](表1).

表1 Underwood组织病理学评分标准Table 1 Underwood histopathological criteria
(3)BALF中细胞因子 IL-10、TGF-β1、IL-17的检测:采用ELISA法测定,具体操作按试剂盒说明书进行.
1.6 统计学方法
采用SPSS 23.0软件进行统计分析,计量资料以(均数±标准差)(±s)表示.符合正态分布用单因素方差分析(One-way ANOVA),组间两两比较,方差齐性用LSD方法;不符合正态分布者用秩和检验进行.以P<0.05为差异具有统计学意义.
2 结果
2.1 一般情况
正常对照组幼鼠活动、饮食及大便均正常,背毛光亮,体质量增长迅速.其余各组幼鼠则出现不同程度的烦躁不安或安静少动、抓耳挠鼻、前肢抬缩、弓背、呼吸加快、喘息、腹部内凹、腹泻、背毛稀疏不光泽及体质量增长较正常组减慢等表现.实验结束后,共剩余51只幼鼠.其中正常对照组平均体质量(17.87±0.71)g、异功散低剂量组平均体质量(14.89±1.44)g及益生菌组平均体质量(16.47±3.31)g,分别死亡1只;模型对照组平均体质量(15.95±1.39)g、异功散高剂量组平均体质量(15.99±1.97)g及异功散中剂量组平均体质量(15.45±1.41)g,则分别死亡2只.
2.2 肺组织病理变化
正常对照组仅见个别细支气管周围少量慢性炎症细胞浸润,未见明显组织损伤及显著水肿,支气管上皮细胞完整,未见脱落.模型对照组则可观察到细支气管周围及肺间质内重度炎症细胞浸润,浸润细胞包括淋巴细胞、浆细胞及中性粒细胞,并见小脓肿形成,组织坏死,局灶区域肺泡腔内可见粉染液体渗出,支气管上皮粘液细胞增多和管腔内可见粘液样分泌物.异功散高、中、低剂量组的的炎症细胞浸润、组织损伤、水肿及上皮细胞脱落程度等,则较模型对照组依次减轻,见图1.
模型对照组的Underwood评分显著高于正常对照组(P<0.01),而益生菌组及异功散高、中、低剂量组则均显著低于模型对照组(P<0.01),见表2.

图1 各组肺组织病理变化Fig.1 Pathological changes of lung tissue in each group
表2 各组肺组织HE染色的Underwood评分Table 2 Underwood score of HE staining in lung tissues of each group (±s)
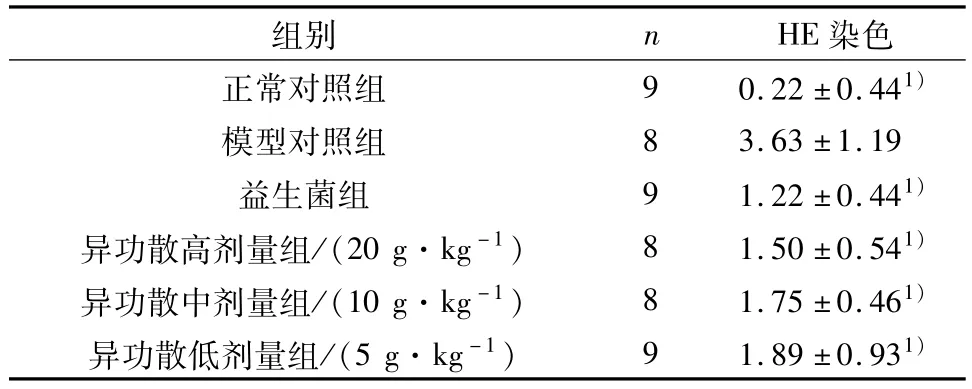
表2 各组肺组织HE染色的Underwood评分Table 2 Underwood score of HE staining in lung tissues of each group (±s)
与模型对照组比较:1)P<0.01.
组别 n HE染色正常对照组 9 0.22±0.441)模型对照组 8 3.63±1.19益生菌组 9 1.22±0.441)异功散高剂量组/(20 g·kg-1) 8 1.50±0.541)异功散中剂量组/(10 g·kg-1) 8 1.75±0.461)异功散低剂量组/(5 g·kg-1) 9 1.89±0.931)
2.3 BALF中细胞因子 IL-10、TGF-β1、IL-17含量的比较
模型对照组BALF中的IL-10含量显著低于正常对照组(P<0.01),而 TGF-β1含量虽低于正常对照组,IL-17含量高于正常对照组,但均无统计学差异.益生菌组与异功散高、中、低剂量组BALF中的IL-10含量均显著高于模型对照组(P<0.01,P<0.05).益生菌组与异功散高、中、低剂量组BALF中的TGF-β1含量均高于模型对照组,其中益生菌组与异功散高、低剂量组有统计学差异(P<0.01,P<0.05).益生菌组与异功散高、中、低剂量组BALF中的IL-17含量均低于模型对照组,但均无统计学差异(P>0.05),表3.
表3 各组BALF中细胞因子的质量浓度Table 3 Concentration of cytokine in each group of BALF(±s)/(pg·mL-1)

表3 各组BALF中细胞因子的质量浓度Table 3 Concentration of cytokine in each group of BALF(±s)/(pg·mL-1)
与模型对照组比较:1)P<0.01,2)P<0.05.
组别 n ρ(IL-10) ρ(TGF-β1) ρ(IL-17)正常对照组 9 2.58±0.371)2.52±0.52 2.03±0.29 2.54±0.42模型对照组 8 1.97±0.15 1.73±0.19 2.63±0.45益生菌组 9 2.72±0.451) 2.16±0.432) 2.50±0.51异功散高剂量组 8 2.35±0.232) 2.22±0.471) 2.21±0.47异功散中剂量组 8 2.40±0.312) 1.94±0.29 2.33±0.39异功散低剂量组 9 2.53±0.401) 2.15±0.312)
3 讨论
中医药治疗哮喘有其独特的优势.中医学认为伏痰留饮是哮喘发作的关键病理因素,然其形成与脾脏关系密切.肺脾两经同属“太阴”,在气血津液的生成、气机调畅及水液代谢方面呈现出相互依赖、相互协调的关系,《医方集解·补养之剂第一》载“脾者,万物之母也,肺者,气之母也,脾胃一虚,肺气先绝”.因此“肺脾相关”理论对肺系疾病的诊断及治疗有重要的指导意义.小儿具有“脏腑娇嫩,形气未充”的生理特点,临床所见小儿哮喘单纯肾虚者较少,而其“肺常不足”、“脾常虚”的生理、病理特点更显突出.因此,“培土生金法”也相应成为防治儿童哮喘的重要治法,广泛用于哮喘缓解期的治疗.异功散是北宋儿科名医钱乙在补气基本方—四君子汤基础上加陈皮而成,补气而不壅滞,尤其符合小儿“脾常不足”的特点,故自创制以来,一直被推崇为调理小儿脾胃的经典方剂,各地儿科名家更大量应用于哮喘的防治[6-7],但其药理作用机制迄今尚未明确.
对于支气管哮喘的发病机制,传统的辅助性T淋巴细胞1型(Th1)/辅助性T淋巴细胞2型(Th2)平衡失调的理论已难以完整解释,近年来的研究则证实CD4+CD25+Foxp3+调节性T细胞(Treg)和辅助性T细胞17型(Th17)也与之密切相关[8].作为机体免疫反应程序中关键的调节因素,Treg细胞能通过各种机制诱导机体对自身抗原和过敏原产生免疫耐受,例如其分泌的细胞因子 IL-10和 TGF-β,可抑制 T细胞的增殖及Th1、Th2的细胞因子反应[9].Th17细胞则可分泌IL-17,刺激上皮细胞分泌趋化因子,促进中性粒细胞浸润,加重气道炎症反应,使气道反应性增高[10].因此,Treg/Th17的免疫失调是导致哮喘等过敏性疾病发生的重要机制.另一方面,生命早期的微生物则能直接影响Treg和Th17细胞的发育,对机体建立正常的肠道菌群—黏膜免疫至关重要[11].研究发现,双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)等共生菌则能上调体内Treg的水平,纠正失衡的 Treg/Th17[12-13],甚至防治模型小鼠的哮喘[14].
本研究小组推测“培土生金法”及其代表方剂—异功散防治哮喘的作用,可能与其通过影响肠道菌群—黏膜免疫,进而调节Treg/Th17细胞的功能相关.本研究发现,与益生菌类似,异功散的早期干预,减轻了哮喘模型幼鼠的气道炎症反应,且其疗效呈现出剂量相关性的差异,提示异功散可有效防治哮喘的过敏性炎症.研究结果还表明,异功散的早期干预提高了模型幼鼠肺泡灌洗液中相关细胞因子IL-10的含量,提示上述防治作用可能与其影响Treg细胞的功能有关.然而,由于异功散对Treg细胞相关细胞因子的作用并未呈现出剂量差异;另一方面,异功散各剂量组与正常对照组,较模型对照组的IL-17也未发现明显差异,故异功散影响Treg/Th17平衡的具体途径,仍有待进一步研究.
[参考文献]
[1]QU CX,ZHANG ZK.Current views of pediatric asthma[J].Eur Rev Med Pharmacol Sci,2017,21(4 Suppl):106-108.
[2]ABRAMS E M,SZEFLER S J,BECKER A B.Does inhaled steroid therapy help emerging asthma in early childhood?[J]. The Lancet Respiratory Medicine,2017,5(10):827-834.
[3]RAISSY H H,KELLY H W.Benefits and risks of longterm asthma management in children:where are we heading?[J].Drug Saf,2017,40(3):201-210.
[4]魏伟.实验药理方法学[M].第4版.北京:人民卫生出版社,2010:1698.WEI W.Experimental Methodology of Pharmacology[M].4th ed.Beijing:People's Medical Publishing House,2010:1698.
[5]UNDERWOOD S,FOSTER M,RAEBURN D.Timecurse of antigen-induced airway inflammation in the Guinea pig and its relationship to airway hyperresponsiveness[J].Eur Rrespir J,1995,8(12):2104-2113
[6]王明明.汪受传教授治疗小儿肺系疾病经验[J].中华中医药杂志,2011,26(11):2602-2604.WANG MM.Professor WANG Shou-chuan's experience in treating pediatric lung system diseases[J].China Journal of Traditional Chinese Medicine and Pharmacy,2011,26(11):2602-2604.
[7]谭惠元.吴曙粤教授治疗小儿哮喘的经验介绍[J].广西中医药,2015,38(3):42-43.TAN H Y.Professor Wu Shuyue's experience in treating childhood asthma[J].Guangxi Journal of Traditional Chinese Medicine,2015,38(3):42-43.
[8]覃雪军,银维谋,谭毅.调节性T淋巴细胞与Th17细胞在哮喘气道炎症中的作用[J].中国临床新医学,2015,8(10):996-1000.QIN X J,YIN W M,TAN Y.Treg/Th17 Paradigm in asthmatic airway inflammation[J].Chinese Journal of New Clinical Medicine,2015,8(10):996-1000.
[9]NOVALRIVASM,CHATILA TA.Regulatory T cells in allergic diseases[J].JAllergy Clin Immunol,2016,138(3):639-652.
[10]COSMI L, LIOTTA F, ANNUNZIATO F. Th17 regulating lower airway disease[J].Curr Opin Allergy Clin Immunol,2016,16(1):1-6.
[11]MCLOUGHLIN R M,MILLS K H. Influence of gastrointestinal commensal bacteria on the immune responses thatmediate allergy and asthma[J].JAllergy Clin Immunol,2011,127(5):1097-1107.
[12]KONIECZNA P,GROEGER D,ZIEGLER M,et al.Bifidobacterium infantis 35624 administration induces Foxp3 T regulatory cells in human peripheral blood:potential role formyeloid and plasmacytoid dendritic cells[J].Gut,2012,61(3):354-366.
[13]de ROOCK S,van ELK M,van DIJK ME,et al.Lactic acid bacteria differ in their ability to induce functional regulatory T cells in humans[J].Clin Exp Allergy,2010,40(1):103-110
[14]刘梦昀,郑跃杰,黄建琼,等.婴儿型双歧杆菌对哮喘小鼠气道炎症的作用研究[J].中国微生态学杂志,2015,27(8):881-885.LIU MY,ZHENG Y J,HUANG J,Q,et al.The effects of Bifidobacterium in fantis on the airway in flammation in murine models of asthma[J].Chinese Journal of Microecology,2015,27(8):881-885.

