合并脑微出血急性缺血性脑卒中患者静脉溶栓治疗的风险评估及安全性研究
张玉显, 张佩兰
在全世界范围内,缺血性脑卒中是造成残疾的主要原因,也是导致死亡的第2大原因[1]。缺血性卒中起因于动脉闭塞,随后局部脑血流量减少。目前急性缺血性卒中动脉闭塞干预措施是血管再通,从而恢复脑血流并改善神经功能预后。这些疗法中研究最多的是静脉内应用(IV)组织型纤溶酶原激活剂(tPA)[2]。尽管静脉溶栓用于急性缺血性卒中治疗持续改善(IVT)患者神经功能预后,仍存在7%~10.5%的患者出现颅内出血(ICH),从而导致其病情恶化[3]。通过早期检查识别出血风险高的患者,可以降低溶栓后颅内出血的风险。脑微出血(CMB)是由于血液通过受到损害的微小血管壁漏出,而形成以脑实质含铁血黄素沉积为主要特征的亚临床损害。一些研究表明影像上存在微出血是静脉溶栓治疗后发生颅内出血的危险因素;然而,部分研究显示两者无相关关系[4]。MRI发现含铁血黄素沉积取决于其对含铁化合物的高敏感性。脑微出血是否增加了颅内出血(ICH)的风险,以及这些患者是否接受溶栓治疗仍存在争议。我们研究的目的是既往微量出血是否增加静脉溶栓治疗脑出血的风险。
1 资料与方法
1.1 临床资料 2015年7月-2016年7月期间天津市环湖医院神经内科四病区发病4.5 h内接受阿替普酶(recombinant tissue plasminogen activator,rtPA)急性缺血性脑卒中患者206例进行回顾性研究。静脉溶栓的纳入标准和排除标准详见既往的研究[5,6]。所有招募的患者均进行了MRI(T2*、T1、T2、DWI序列)扫描。DWI、T2序列评估缺血性病变的位置。T2*加权GRE序列评估CMB的位置以及早期出血性转化。由于各种原因(如幽闭恐惧症和起搏器插入等)无法进行MRI检查的患者被排除在外。本研究经天津市环湖医院伦理委员会批准,所有患者及家属均签署知情同意书。急性缺血性卒中患者发病4.5 h内接受阿替普酶(商品名为爱立通)静脉溶栓治疗,剂量为0.9 mg/kg,最大剂量≤90 mg。总药量10% 1 min静脉推注,余剂量90%在1 h内静脉滴入。
1.2 颅内静脉微出血的评价标准 Tanaka[7]等研究发现CMB在T2*加权梯度回波(GRE)或磁敏度加权成像MRI上通常直径为2~5 mm,有时直径可达10 mm,圆形的低信号。脑微出血也称含铁血黄素沉积,其诊断标准[3,8]:存在晕染效应(blooming effect),SWI与自旋回波序列相比病灶更大;管状或者线状低信号,考虑梗死或者血管影像,基底节区钙化或者铁沉积出现对称性低信号,不考虑为CMB;至少病灶一半被脑实质包绕;SWI低密度病变伴有典型海绵体畸形或静脉异常,则不被认为是CMB。根据微出血解剖学评价量表[8](Mierobleed Anatomical Rating Scale,MARS),将微出血等级分为3级:数量0无微出血;1~2代表少量微出血;数目≥3代表多发微出血。
1.3 神经功能预后评价标准 根据ECASS Ⅱ[9]试验,30 d患者良好预后定义为MRS评分0~2分。症状性颅内出血(sICH)根据阿替普酶急性脑卒中溶栓安全应用的监测研究(SITI-MOST)[10]定义为颅内实质性出血,且与出血相关NIHSS评分较基线水平增加≥4分[11]。

2 结 果
2.1 一般情况 2015年7月-2016年7月本研究共纳入206例接受静脉溶栓治疗的患者,所有患者溶栓前后均进行头部MRI检查(DWI、T2、T2*GRE序列)。含铁血黄素沉积(CBM)的MRI表现(见图1);脑出血在头部CT表现(见图2)。其中含铁血黄素沉积组与无含铁血黄素组在性别比例、基线NISS评分、发病到溶栓治疗时间以及既往病史,差异无统计学意义(见表1)。
2.2 风险及预后评估 含铁血黄素沉积组症状性脑出血共2例(2.2%),与无含铁血黄素沉积组3例(2.6%)相比,两组间差异无统计学意义(P=0.874)。含铁血黄素沉积组非症状性脑出血共4例(4.5%),与无含铁血黄素沉积组2例(1.7%)相比,两组间差异无统计学意义。3个月神经功能获得良好预后,含铁血黄素组共计41例(46.1%),无含铁血黄素组62例(52.9%),两组间差异无统计学意义(P=0.325)。含铁血黄素沉积组3个月生存率92.1%;无含铁血黄素沉积组为95.7%,两组间差异无统计学意义(见表2)。
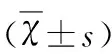
表1 发病≤4.5 h内接受静脉溶栓治疗的两组患者基本资料

表2 发病≤4.5 h内接受静脉溶栓治疗的两组患者临床预后的比较[±,n(%)]

图1 MRI T2*显示含铁血黄素沉积;图2 头部CT显示颅内出血
3 讨 论
含铁血黄素沉积常见于缺血性卒中、脑淀粉样血管病、痴呆及一些正常老年人群中。高血压及脑淀粉样血管病(CAA)是脑微出血常见病因和发病机制[12]。组织病理学分析显示脑微出血(CMBs)是由于脑小血管中红细胞渗漏导致含铁血黄素沉积。
Shoamanesh[4]研究发现既往脑微出血与症状性颅内出血转化存在相关性,但是Charidimou[13]等研究共纳入800例患者,其中脑微出血组与无脑微出血组在接受溶栓治疗后,脑出血的发生率,差别无显著统计学意义。本研究结果显示脑微出血组与无脑微出血组在脑出血的发生率,差别无显著统计学意义(P=0.016)。Gratz[3]等研究发现溶栓前SWI序列上存在CBMs接受静脉溶栓治疗后并未增加症状性或者非症状性颅内出血的风险。本研究发现既往脑微出血接受静脉溶栓后并未增加症状脑出血(P=2.2%)或者非症状性颅内出血(P=4.5%)风险的结果一致。根据SITS-MOST标准溶栓后症状性脑出血率,本研究接受静脉溶栓治疗后出血转化与其他先前一项关于静脉溶栓治疗的Meta分析的结论(1.6%~7.7%)一致[4]。
目前存在较少关于脑微出血及3个月临床预后的研究。国外报道的3项研究[3,14,15]报告中显示,在多变量分析中,溶栓前MR支持CBMs与溶栓后长期预后没有发现存在关联。与本研究发现结果相一致(P=0.325)。但目前尚未有研究制定长期临床预后指标,目前仍不清楚既往脑出血是否会导致不良结局独立因素。
本研究发现,急性缺血性脑卒中患者合并脑微出血(CMB)与静脉溶栓治疗后出血性转化无显著相关。但本研究存在局限性,需要更多研究进一步评估这种关联及对其长期功能预后及出血转化的影响。
[参考文献]
[1]Wang S,Lv Y,Zheng X,et al.The impact of cerebral microbleeds on intracerebral hemorrhage and poor functional outcome of acute ischemic stroke patients treated with intravenous thrombolysis:a systematic review and meta-analysis[J].J Neurol,2017,264(7):1309-1319.
[2]Calleja AI,Cortjo E,Garcia-Bernehi P,et al.Collateral circulation on perfusion-computed tomography-source images predicts the response to stroke intravenous thrombolysis[J].Eur J Neurol,2013,20(5):795-802.
[3]Gratz PP,EI-Koussy M,Hsieh K,et al.Preexisting cerebral microbleeds on susceptibility-weighted magnetic resonance imaging and post-thrombolysis bleeding risk in 392 patients[J].Stroke,2014,45(6):1684-1688.
[4]Shoamanesh A,Kwok CS,Lim PA,et al.Postthrombolysis intracranial hemorrhage risk of cerebral microbleeds in acute stroke patients:a systematic review and meta-analysis[J].Int J Stroke,2013,8(5):348-356.
[5]Sandercock P,Lindley R,Wardlaw J,et al.Update on the third international stroke trial (IST-3) of thrombolysis for acute ischaemic stroke and baseline features of the 3035 patients recruited[J].Trials ,2011,12(1):1-10.
[6]Sandercock P,Lindley R,Wardlaw J,et al.Statistical analysis plan for the third International Stroke Trial (IST-3);part of a thread of reports of the trial[J].Int J Stroke,2012,7(3):186-187.
[7]Tanaka A,Ueno Y,Nakayama Y,et al.Small chronic hemorrhages and ischemic lesions in association with spontaneous intracerebral hematomas[J].Stroke,1999,30(8):1637-1642.
[8]Gregoire SM,Chaudhary UJ,Brown MM,et al.The Microbleed Anatomical Rating Scale (MARS): reliability of a tool to map brain microbleeds[J].Neurology,2009,73(21):1759-1766.
[9]Hacke W,Kaste M,Fieschi C,et al.Randomised double-blind placebo-controlled trial of thrombolytic therapy with intravenous alteplase in acute ischaemic stroke (ECASS II).Second European-Australasian Acute Stroke Study Investigators[J].Lancet,1998,352(9136):1245-1251.
[10]Rha JH,Shrivastavs VP,Wang Y,et al.Thrombolysis for acute ischaemic stroke with alteplase in an Asian population:results of the multicenter,multinational Safe Implementation of Thrombolysis in Stroke-Non-European Union World (SITS-NEW)[J].Int J Stroke,2014,9(Suppl A100):93-101.
[11]Aoki J,Sakamoto Y,Kimura K,et al.Intravenous thrombolysis increases the rate of dramatic recovery in patients with acute stroke with an unknown onset time and negative FLAIR MRI[J].J Neuroimaging,2016,26(4):414-419.
[12]Greenberg SM,Vernooij MW,Cordonnier C,et al.Cerebral microbleeds:a guide to detection and interpretation[J].The Lancet Neurology,2009,8(2):165-174.
[13]Charidimou A,Kakar P,Fox Z,et al.Cerebral microbleeds and the risk of intracerebral haemorrhage after thrombolysis for acute ischaemic stroke:systematic review and meta-analysis[J].J Neurol Neurosurg Psychiatry,2013,84(3):277-280.
[14]Dannenberg S,Scheitz JF,Rozanski M,et al.Number of cerebral microbleeds and risk of intracerebral hemorrhage after intravenous thrombolysis[J].Stroke,2014,45(10):2900-2905.
[15]Charidimou A,Turc G,Oppenheim C,et al.Microbleeds,cerebral hemorrhage,and functional outcome after stroke thrombolysis:Individual patient data Meta-analysis[J].Stroke,2017,48(8):2084-2090.

