尾侧入路法腹腔镜右半结肠癌根治性切除术的临床体会
叶进军,辛 乐,刘继东,蓝一周,阎玉矿
(深圳市龙岗中心医院,广东 深圳,518116)
结肠癌是消化道的常见恶性肿瘤,在欧美国家,结肠癌位列全部恶性肿瘤死因的第3位。根据相关统计数据,目前,全球每年约有140万例新发结肠癌病例,同时约70万人死于结肠癌[1-3]。手术是目前治疗结肠癌的主要手段,随着外科技术的进步与发展,腹腔镜手术已成为对于具有应用指征患者的常规术式[4-5],采用腹腔镜微创手术治疗结肠癌已成为重要方法[6]。目前经典中间入路法腹腔镜右半结肠癌根治术是主流[7],但这种中间入路对术者技术水平要求较高,容易走错手术层面,体质指数(body mass index,BMI)较大、系膜水肿严重的患者明显增加难度,打击了部分术者的自信心,尤其临床手术经验不丰富时。近年关于腹腔镜下右半结肠癌根治术手术入路的问题已成为焦点,有的研究提示尾侧入路具有一定优势,国内有专家提出采用尾侧入路[8],既安全可行又符合肿瘤根治原则,尤其利于年轻初学者掌握、缩短学习曲线平台期,明显降低了手术难度,术中出血量少,更加安全高效,促进患者康复。但目前缺乏相关比较研究,基于这一研究现状,自2014年开始深圳市龙岗中心医院普通外科施行尾侧入路腹腔镜右半结肠癌根治切除术,现对比分析尾侧入路与中间入路行腹腔镜右半结肠癌根治性切除术的临床疗效。
1 资料与方法
1.1 临床资料 选取2014年1月至2017年6月深圳市龙岗中心医院普通外科收治的、符合本研究纳入标准的81例右半结肠癌患者作为研究对象,均于腹腔镜下行右半结肠癌根治性切除术,根据手术入路分为观察组(采用尾侧入路,n=42)与对照组(采用中间入路,n=39),两组患者年龄、性别、BMI、腹部手术史、Dukes病理分期见表1。纳入标准:均经影像学检查及术前、术后病理检查证实为右半结肠癌,术前美国麻醉师协会(American society of anesthesiologists,ASA)分级均为Ⅰ~Ⅲ级。排除标准:合并肝肾功能不全、血液疾病、其他部位恶性肿瘤,术前辅助检查发现肿瘤远处转移,具有腹腔镜手术应用禁忌。
表1 两组患者临床资料的比较(n)
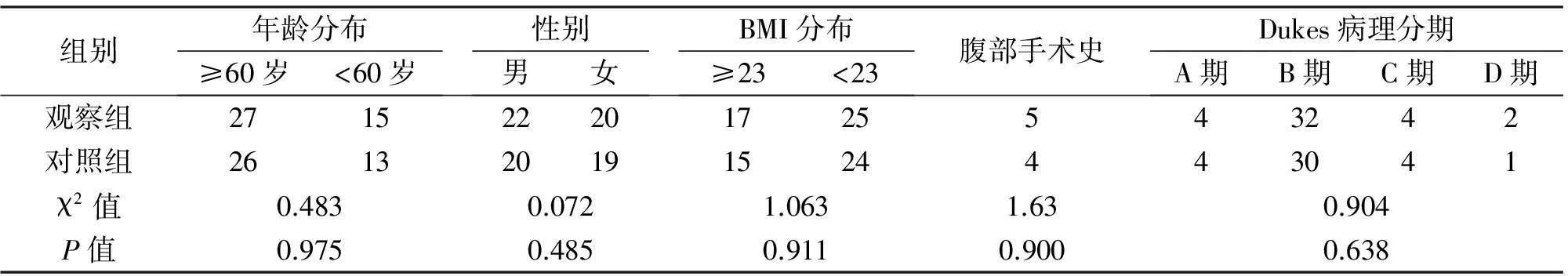
组别年龄分布≥60岁<60岁性别男女BMI分布≥23<23腹部手术史Dukes病理分期A期B期C期D期观察组271522201725543242对照组261320191524443041χ2值0.4830.0721.0631.630.904P值0.9750.4850.9110.9000.638
1.2 手术方法 观察组患者采用尾侧入路行右半结肠癌根治性切除术,麻醉后患者取人字位,术者常规立于患者左侧,第一助手立于右侧,持镜手立于两腿间。脐下做长1.2 cm的纵切口,穿刺12 mm Trocar,置入腹腔镜为观察孔,建立气腹,左侧锁骨中线肋缘下3.5 cm处做12 mm切口为主操作孔,左侧反麦氏点5 mm切口为副操作孔,助手操作孔分别与左侧对称,气腹压力维持在13~14 mmHg(图1)。首先常规探查腹腔肝胆、肠管、腹壁,确定病灶及手术范围。将患者置于头低足高约30°,并向左侧倾斜,使腹腔内容物移至左上腹,显露小肠系膜与后腹膜黄白交界线的膜桥,右侧髂血管上方约2 cm处切开膜桥进入Toldt间隙并拓展(图2),右侧至升结肠旁沟系膜,左侧至肠系膜上静脉左侧,上至胰头及十二指肠降部上段(图3),保护好右侧输尿管及性腺血管,手术分离层面放置一块纱块,为下一步手术操作形成标识。放下右结肠、小肠系膜,在结肠与小肠系膜中间膜桥切开进入刚拓展的Toldt间隙,与之会师(图4),以回结肠动静脉、肠系膜上静脉作为位置参考标志切开肠系膜,依次游离、结扎并于根部离断回结肠血管,进一步解剖外科干,沿肠系膜上静脉左侧向头侧解剖其属支,分别结扎手术范围相应血管(图5、图6)。将手术场景转向横结肠上方,于胃大弯侧血管弓外(扩大右半结肠癌根治术时在弓内)切断胃结肠韧带(图7),进入小网膜囊,找到结肠与肠系膜间隙并分离,与右结肠后间隙会师,继续离断肝结肠韧带,升结肠外侧韧带,裸化横结肠,最后完成右半结肠及系膜游离(图8)。取上腹部正中约5 cm切口(视肿瘤直径大小及肥胖程度决定),保护手术切口,注意无瘤原则,取出游离肠管,在预定范围内切除肠管肿瘤,用直线切割闭合器行回肠、横结肠侧侧吻合,肠管回纳腹腔,将吻合肠管放置右上腹,关闭肠系膜裂孔,右侧肝肾隐窝放置引流管并固定在腹壁外。对照组患者体位、术者站位同观察组,于回结肠动脉投影下方切开肠系膜进入Toldt间隙并拓展,提起结肠系膜后经右结肠后间隙依次分离升结肠、结肠肝曲及横结肠,自尾侧向头侧沿肠系膜上静(动)脉解剖结肠血管及胃结肠血管共同干,并清扫相应的淋巴结,自结肠肝曲方向依次切开胃结肠韧带、肝结肠韧带,直至回盲部并会合中间入路。距回盲部10~15 cm处切断回肠,于脐上方做长约5 cm纵切口,取出游离肠段并切除右半结肠,行横结肠、回肠端吻合后将肠管向腹腔内回纳,最终关闭切口并于右结肠旁沟处留置胶管引流。其他淋巴结清扫范围及切除肠管长度同观察组。
1.3 观察指标 对比两组术中出血量、手术时间、肠系膜上静脉出血例数、中转开腹例数、清扫淋巴结数量及术后排气时间、住院时间、并发症发生率等指标。
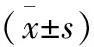
2 结 果
观察组术中出血量、手术时间显著少于对照组,差异有统计学意义(P<0.05);两组肠系膜上静脉出血例数、中转开腹例数、清扫淋巴结数量、术后排气时间、术后住院时间差异均无统计学意义(P>0.05)。两组均未发生切口感染、吻合口瘘、腹腔脓肿等术后并发症。见表2。
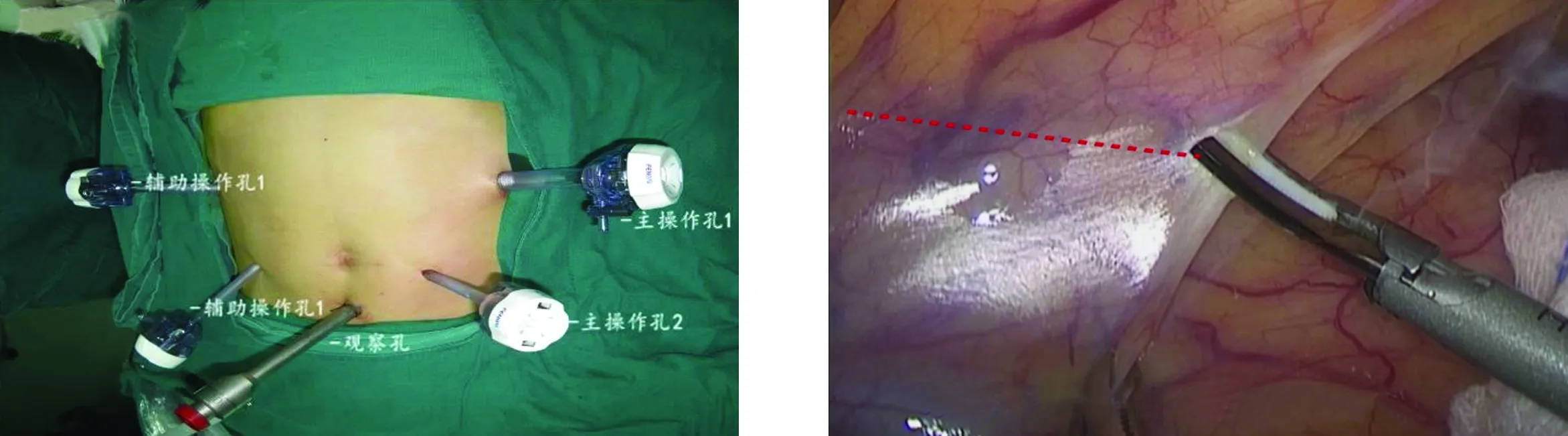
图1 戳卡布局图2 尾侧入路切开肠系膜膜桥
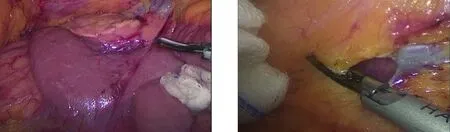
图3 手术场景腹膜后展示图4 切开膜桥与腹膜后间隙会师
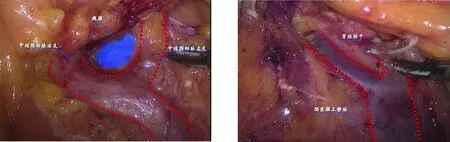
图5 解剖中结肠动脉左右支 图6 解剖胃结肠干

图7 血管弓外离断胃结肠韧带图8 手术后场景展示
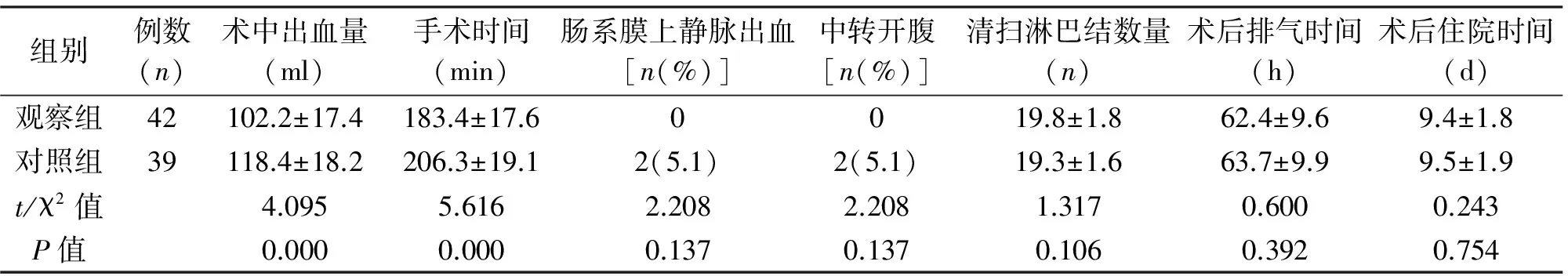
组别例数(n)术中出血量(ml)手术时间(min)肠系膜上静脉出血[n(%)]中转开腹[n(%)]清扫淋巴结数量(n)术后排气时间(h)术后住院时间(d)观察组42102.2±17.4183.4±17.60019.8±1.862.4±9.69.4±1.8对照组39118.4±18.2206.3±19.12(5.1)2(5.1)19.3±1.663.7±9.99.5±1.9t/χ2值4.0955.6162.2082.2081.3170.6000.243P值0.0000.0000.1370.1370.1060.3920.754
3 讨 论
2017年最新版的美国国立综合癌症网络临床指南指出,腹腔镜结肠癌根治术可应用于大部分的结肠癌。目前,针对右半结肠癌的腹腔镜手术方式已包括了全腹腔镜手术、手辅助腹腔镜手术、经脐单孔腹腔镜手术、经自然腔道内镜外科手术及达芬奇机器人等多种手术方式,虽然新型手术技术、器械设备层出不穷,但如何根据患者情况选择合理的手术方式仍是令人困惑的临床问题。完整结肠系膜切除、D3淋巴结清扫是右半结肠癌手术的技术核心,由于右半结肠癌根治术涉及脏器多、手术风险高、技术难度大,尤其肥胖、系膜充血水肿患者操作尤为困难,因而临床外科医生必须衡量自身的腹腔镜技术水平、医院的设备情况、患者的基本病情及经济状况等多方面因素选择合理的右半结肠腹腔镜手术方式[9]。
本研究结果显示,与中间入路相比,腹腔镜右半结肠癌根治切除术中采用尾侧入路,能减少术中出血量、缩短手术时间,利于降低手术创伤,促进患者康复。传统开腹手术中一般采用外侧入路,因而20世纪时腹腔镜手术多采用中间入路。进入21世纪,微创外科得到了不断发展,2001年,学者首次提出在腹腔镜下应用尾侧中间入路(腹侧)行右半结肠癌根治术的观点;2013年,有学者首次描述了经尾侧回盲部背侧中间入路行腹腔镜右半结肠切除术[10]。通过多年腹腔镜结肠癌手术的临床实践及对右半结肠解剖、组织结构的研究,学者们提出了尾侧入路的方案,即将小肠系膜与后腹膜愈着的“黄白交界线”作为入路,采取“搭帐篷式”的手术方式率先对肠系膜上静脉后方、胰十二指肠前筋膜前方所在的右结肠后间隙融合筋膜间隙进行解剖,从两侧同时清扫中央组淋巴结,最后对升结肠后方的右结肠后间隙及侧腹膜手术入路进行游离[8]。近年研究中,邹瞭南等[11-12]对尾侧入路法在腹腔镜右半结肠癌根治性切除术中的应用效果进行了分析,结果显示,术后并发症发生率约为10%,主要是肺部感染、泌尿系感染、切口感染、炎性肠梗阻及淋巴瘘等,手术时间平均约为150 min,术中失血量平均70 ml,术后平均住院7 d,平均淋巴结清扫数量30枚,淋巴结阳性数量4枚,表明尾侧入路法腹腔镜右半结肠癌根治性切除术是安全、可行的,符合肿瘤学根治原则。上述研究中比较了尾侧入路法与中间入路法,本研究结果亦提示尾侧入路法可能在减少手术创面出血方面优于中间入路法,但其他方面的优势并不明显。事实上,除了针对手术入路的改良,研究者一直尝试优化腹腔镜下右半结肠癌切除术的术式与技术,近年研究报道了改良右半肠切除术、3D高清腹腔镜等的应用研究,均取得了提高肿瘤根治率、降低并发症发生率、实现精确操作、提供清晰视野等效果[13-14],综合应用新的研究成果提高腹腔镜下右半结肠癌切除术的根治效果、降低手术创伤、减少术后并发症已成为共同努力的方向,也为进一步的研究开辟了视野。
综上所述,与中间入路法相比,在腹腔镜下右半结肠癌根治切除术中采用尾侧入路是安全、可行的,降低了手术风险,是比较容易掌握的手术方式,同时能减少术中出血量、缩短手术时间,利于患者的康复。
参考文献:
[1] Ratnapradipa KL,Lian M,Jeffe DB,et al.Patient,Hospital,and Geographic Disparities in Laparoscopic Surgery Use Among Surveillance,Epidemiology,and End Results-Medicare Patients With Colon Cancer[J].Dis Colon Rectum,2017,60(9):905-913.
[2] Banerjee A,Pathak S,Subramanium VD,et al.Strategies for targeted drug delivery in treatment of colon cancer:current trends and future perspectives[J].Drug Discov Today,2017,22(8):1224-1232.
[3] Kotelevets L,Chastre E,Desmaёle D,et al.Nanotechnologies for the treatment of colon cancer:From old drugs to new hope[J].Int J Pharm,2016,514(1):24-40.
[4] Franklin BR,McNally MP.Laparoscopy for Colon Cancer[J].Clin Colon Rectal Surg,2017,30(2):99-103.
[5] Fabozzi M,Cirillo P,Corcione F.Surgical approach to right colon cancer:From open technique to robot.State of art[J].World J Gastrointest Surg,2016,8(8):564-573.
[6] 郑民华.腹腔镜手术-结直肠癌根治性手术金标准[J].中国实用外科杂志,2012,32(9):731-733.
[7] 严俊,应敏刚,周东,等.腹腔镜右半结肠切除中间入路与侧方入路的前瞻性随机对照研究[J].中华胃肠外科杂志,2010,13(6):403-405.
[8] 邹瞭南,郑蓓诗,卢新泉,等.腹腔镜尾侧入路法根治性右半结肠切除术[J/CD].中华结直肠疾病电子杂志,2017,6(2):170-173.
[9] 靖昌庆.右半结肠癌微创术式的选择[J].中华胃肠外科杂志,2017,20(5):504-506.
[10] 肖毅.腹腔镜右半结肠癌根治手术入路的选择:选择尾侧入路[J].中华胃肠外科杂志,2016,19(8):875-877.
[11] 邹瞭南,李洪明,万进.腹腔镜尾侧入路右半结肠癌根治性切除的安全性、可行性及临床应用价值[J/CD].中华结直肠疾病电子杂志,2016,5(3):238-243.
[12] 邹瞭南,熊文俊,李洪明,等.尾侧入路腹腔镜右半结肠癌根治术疗效分析[J].中华胃肠外科杂志,2015,18(11):1124-1127.
[13] 王宝磊.传统手术与改良右半肠切除术治疗结肠癌的临床效果研究[J].中国农村卫生,2017,5(14):27-28.
[14] 陶国全,钱燕,于仁,等.3D腹腔镜在右半结肠癌根治术中的应用[J].中国微创外科杂志,2017,17(7):609-611,626.

