XELOX方案新辅助化疗治疗局部进展期胃癌的临床研究
崔 杰 杨秋敏
胃癌是常见的消化道恶性肿瘤,发病率和病死率均居我国恶性肿瘤首位,严重威胁人民的健康[1-2]。目前治疗胃癌的主要手段是行根治性手术,但是由于胃癌在发病早期缺乏特异性表现,很难被临床发现确诊,所以患者往往错失手术的最佳时机,而对于进展期胃癌,只能进行姑息性手术,预后不佳。研究显示[3],对患者术前行辅助化疗能够降低肿瘤分期,并提高进展期胃癌的手术切除率。为此2015年1月至2016年1月我院采用XELOX方案新辅助对局部进展期胃癌进行治疗,并与FOLFOX4进行比较,现将结果报告如下。
1 资料与方法
1.1 研究对象
2015年1月至2016年1月在我院治疗的进展期胃癌患者86例,术前分期Ⅲ、Ⅳ期且无远处转移,Karnofsky评分≥60分,肝肾功能正常,均为初治患者,随机分为两组,观察组49例,年龄35~72岁,平均(55.4±13.9)岁,男性26例,女性23例,Ⅲa期23例,Ⅲb期21例,Ⅳ期5例;对照组37例,年龄36~74岁,平均(57.1±14.6)岁,男性20例,女性17例,Ⅲa期19例,Ⅲb期15例,Ⅳ期3例,两组年龄、性别、分期比较差异无统计学意义(P>0.05)。
1.2 方法
观察组采用XELOX方案,化疗前半小时静脉注射格拉斯琼3 mg,持续静脉滴入奥沙利铂3 h,第1天;饭后半小时口服卡培他滨,早晚2次,每日共2.5 g/m2,第1~14天;停用1周,3周为1个疗程。对照组采用FOLFOX4方案,续静脉滴入奥沙利铂3 h,第1天;静脉滴入亚叶酸钙2 h 0.2 g/m2,第1、2天;静脉推注5-氟尿嘧啶400 mg/m2,第1、2天,然后静脉滴入600 mg/m2维持22 h;2周为1个疗程。化疗期间均嘱患者禁冷食、冷饮,监测血常规,肝、肾功能变化,2个疗程后评价疗效。
1.3 疗效判定
按实体瘤疗效评价标准(RECIST)进行客观疗效评价[4]:完全缓解(CR):至少4周所有肿瘤完全消失;部分缓解(PR):至少4周肿瘤体积缩小50%以上;无变化(NC):至少4周病灶缩小<50%,或增大<25%;进展(PD):出现新病灶或病灶增大超过25%。有效率=(CR+PR)/总例数×100%。毒性评价依据美国国家癌症中心毒性分级标准分为:0、Ⅰ、Ⅱ、Ⅲ和Ⅳ度[3]。
1.4 统计学处理
应用SPSS 17.0软件包对数据进行统计分析,计数资料用率表示,行χ2检验法,P<0.05为有统计学意义。
2 结果
2.1 两组患者疗效比较
治疗两个疗程后,观察组总有效率为53.1%,略高于对照组的43.2%,但两组比较差异无统计学意义(P>0.05),见表1。

表1 两组患者疗效比较/例
2.2 两组不良反应情况比较
经过2个疗程的治疗后,观察组恶心呕吐、粒细胞减少、乏力和贫血发生率分别为42.9%、30.6%、57.1%、20.4%,明显低于对照组78.4%、62.2%、86.5%、45.9%,差异有统计学意义(P<0.05),两组外周神经毒性发生率比较,差异无统计学意义(P>0.05),见表2。
3 讨论
胃癌是我国常见的恶性肿瘤之一,由于其早期发现较为困难,50%~60%发现时已达到Ⅲ、Ⅳ期,这些患者手术切除率低、疗效差、5年生存率较低,不适宜进行根治性切除[5-6]。如何提高手术切除率,已成为改善胃癌患者预后的关键因素[7]。近几年有研究发现[8],新辅助化疗能够缩小肿瘤大小,降低临床分期,从而提高手术切除率,得到广泛应用。同时由于新辅助化疗能够迅速缓解梗阻、疼痛等肿瘤相关症状,同时可消除隐匿性的微转移灶,减少术后发生复发的概率,并且对指导术后合理的治疗方式也具有重要意义。当然,新辅助化疗也存在延缓手术治疗时机,导致疾病进展,产生的毒性反应可能增加手术的并发症和死亡率[9-10]。
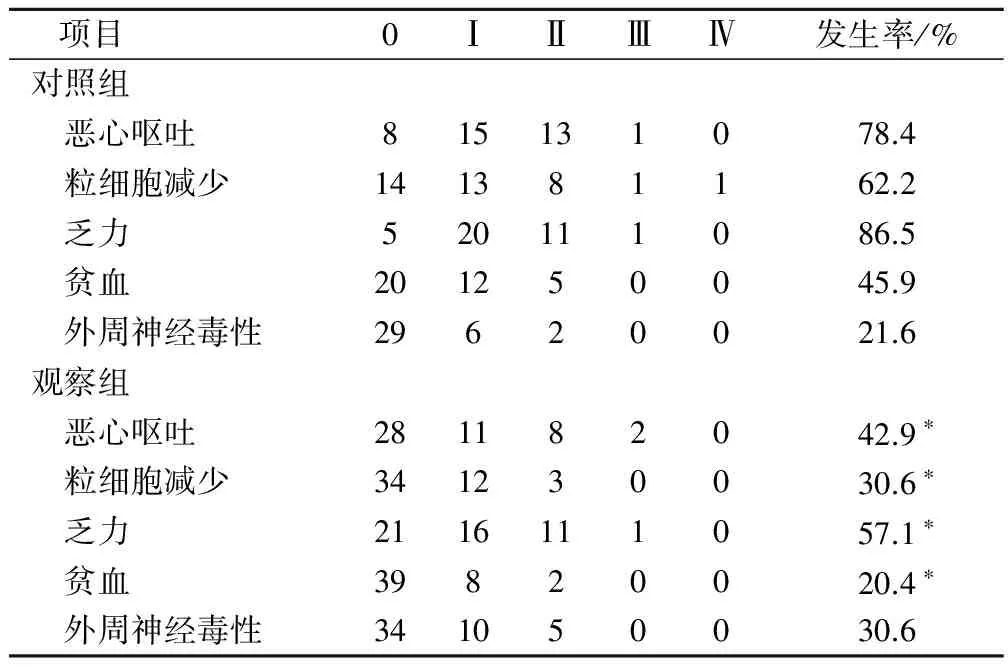
表2 两组不良反应情况比较/例
注:与对照组比较,*为P<0.05。
胃癌是1种对化疗相对敏感的肿瘤,现在对于胃癌患者进行围手术期化疗已等同于手术治疗,而不再处于从属地位,由于患者个体差异,对不同化疗方案的敏感性与耐受性不尽相同,选择合适自己的化疗方案,能够提高治疗效果,减少不良反应的发生显得尤为重要[11-12]。奥沙利铂属环己二胺类化合物,为第三代铂类抗肿瘤药物,其具有周期性非特异性的特点,与顺铂相比,能够以DNA为作用靶点增强了对DNA的抑制作用,活性更高;同时其抗肿瘤谱更广,与顺铂、卡铂等无交叉耐药性;并且,骨髓抑制作用较轻。研究发现,奥沙利铂可上调肿瘤组织内胸苷磷酸化酶的表达水平,使卡培他滨的抗肿瘤活性得以增强,发挥良好的协同效应[13]。卡培他滨为5-氟尿嘧啶前体,口服后在肝脏组织内胞嘧啶脱氨酰酶、经羧酸酯酶转化为脱氟胞嘧啶,最后经胸苷磷酸化酶作用下产生5-氟尿嘧啶,能够在体内模拟5-氟尿嘧啶持续静脉输注,口服后生物利用度较高,可经小肠被完整吸收,同时避免了胃肠外给药的屏障,给卡培他滨在胃癌化疗中的最佳使用提供了基础。陈国平等[14]统计了2010年5月~2011年5月37例采用XELOX方案实施新辅助化疗的局部进展期胃癌病例的临床资料,发现化疗有效率51.3%,所有患者均在两周期化疗后的2~3周内行手术治疗,行根治性切除术32例,结果有30例(81.1%)达到R0根治,姑息性切除5例,而副反应主要表现为周围神经毒性及手足综合征,多为Ⅰ~Ⅱ级。郭继红等[15]对经病理证实的64例进展期胃癌患者,术前行XELOX方案化疗,有效率达57.8%,患者的耐受性和依从性较好,可提高进展期胃癌患者的R0切除率。本研究结果显示,观察组总有效率为53.1%,略高于对照组的43.2%,但两组比较差异无统计学意义(P>0.05),但观察组恶心呕吐、粒细胞减少、乏力和贫血发生率明显低于对照组,差异有统计学意义(P<0.05)。这说明两组患者在临床疗效方面差异虽然不大,但是在多项不良反应中,观察组明显低于对照组。
综上所述,XELOX方案新辅助化疗治疗局部进展期胃癌疗效确切,不良反应少,是1种良好的新辅助化疗方案。
[1] 周江华,魏 蓉.XELOX方案和FOLFOX4方案治疗晚期胃癌的疗效和毒副作用的临床观察〔J〕.中外医学研究,2012,10(31):11-12.
[2] 刘 超,毛伟征,宋延强,等.进展期胃癌患者FOLFOX4与XELOX新辅助化疗的临床观察〔J〕.中国现代普通外科进展,2012,13(12):960-963.
[3] 张小田.新辅助治疗完全缓解后的胃癌治疗何去何从〔J〕.中华胃肠外科杂志,2014,17(2):185-187.
[4] 孙 燕,石远凯.临床肿瘤内科手册〔M〕.北京:人民卫生出版社,2007:476-491.
[5] 孙宝信,白 璐,李青山,等.替吉奥联合奥沙利铂与FOLFOX6方案治疗晚期胃癌的疗效对比〔J〕.中国老年学杂志,2013,33(14):3306-3308.
[6] 王会丰,张永利,崔 洁.XELOX与DF方案治疗晚期胃癌临床疗效比较〔J〕.中国现代医药杂志,2012,14(5):42-44.
[7] 钟俊勇,郭予武,吴志海,等.XELOX方案治疗晚期胃癌的临床疗效观察〔J〕.广东医学院学报,2012,30(4):407-408.
[8] 华 萍.XELOX化疗方案对胃癌患者免疫功能与治疗疗效的影响〔J〕.吉林医学,2012,33(26):5687.
[9] Kline CL,Schiccitano A,Zhu J,et al.personalized dosing via pharmacokinetic monitoring of 5-fluorouracil might reduce toxicity in early-or late-stage colorectal cancer patients treated with infusional 5-fluorouracil-based chemo therapy regimens〔J〕.Clin Colorectal Cancer,2014,13(2):119-126.
[10] Bekaii-Saab T,Wu C.Seeing the forest through the trees:A systematic review of the safety and efficacy of combination chemotherapies used in the treatment of metastatic colorectal cancer〔J〕.Crit Rev Oncol Hematol,2014,91(1):9-34.
[11] 邱守田,任杰远,戴学虎,等.替吉奥胶囊联合奥沙利铂新辅助化疗治疗进展期胃癌的疗效观察〔J〕.中国基层医药,2016,23(3):400-404.
[12] 赵 庆.奥沙利铂联合卡培他滨新辅助化疗治疗进展期胃癌的临床观察〔J〕.医药前沿,2016,6(12):103-104.
[13] Tatsushima Y,Egashira N,Narishige Y,et al.Calcium cha-nnel blockers reduce oxaliplatin-induced acute neuropathy:a retrospective study of 69 male patients receiving modified FOLFOX6 therapy〔J〕.Biomed Pharmacother,2013,67(1):39-42.
[14] 陈国平,王群伟,段文斌.局部进展期胃癌应用XELOX方案新辅助化疗的疗效分析〔J〕.中国现代医学杂志,2011,21(29):3710-3714.
[15] 郭继红,闫志峰.XELOX新辅助化疗方案治疗进展期胃癌的疗效观察〔J〕.临床合理用药,2012,5(1):54-55.

