罗格列酮对肝癌HepG2细胞周期和凋亡的影响
康 燕 魏 玲 王永霞 王立云
肝细胞癌(hepatocellular carcinoma,HCC)是1种全球范围内最常见的恶性肿瘤,我国的HCC发病率占全球HCC人数的40%~45%,死亡率占我国恶性肿瘤死亡人数的18.8%,其发病率与死亡率均高,且预后较差[1-2]。临床上,急需一种新型药物或治疗方法来提高其生存率,延长HCC患者的生存期。过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)在许多癌症细胞中均有所表达,是一类由配体[如罗格列酮(ciglitazone)、吡格列酮(pioglitazone)、环格列酮(ciglitazone)等]激活的核转录因子,其中一些配体已经被作为抗糖尿病的一类新药在临床上加以应用[3]。随着医学及生物学研究的不断进步,有研究发现该类药物还能够激活PPARγ受体从而调控肿瘤细胞的生长,具有加速肿瘤细胞凋亡,抑制血管生成等的作用[4]。因此,本研究通过检测不同浓度罗格列酮对肝癌HepG2细胞周期及凋亡率的影响,为罗格列酮应用于HCC的临床治疗提供依据。
1 材料与方法
1.1 材料
本研究采用天津葛兰素史克有限公司生产的罗格列酮(商品名:文迪雅,批号:05060018);上海细胞资源中心提供的人肝癌细胞株HepG2和Bel-7404;Gibco公司生产的胎牛血清、RPMI1640培养基及胰酶;Sigma公司生产的四甲基偶氮唑蓝(MTT)及二甲基亚砜(DMSO);北京索莱宝科技有限公司生产的PBS缓冲液(1×)、胰酶-EDTA混合液、青链霉素混合液(100×);南京晶美生物技术公司生产的碘化丙啶(PI)。
1.2 仪器
日本三洋工业株式会社提供的SHEL-LAB2300 CO2培养箱;苏州净化集团安泰公司生产的SW-CJ医用超净台;美国Beckman-Coulter公司生产的Epics-XLⅡ型流式细胞仪;美国伯乐公司生产的Bio-RAD550全自动酶标读数仪;日本Olympus公司生产的OLYMPUS倒置相差显微镜;Eppendorf公司生产低温台式离心机。
1.3 实验方法
1.3.1 细胞培养方法 人肝癌细胞株HepG2培养方法是将含有10%胎牛血清、1%青霉素及100 μg/ml链霉素的RPMI1640培养于常规培养基中,在37 ℃恒温,饱和湿度5% CO2的条件下培养孵育,以0.25%胰蛋白酶消化细胞,在细胞呈单层贴壁生长后,每1~2天更换1次培养基,然后取对数生长期的细胞用于本次研究。
1.3.2 分组 罗格列酮共设4个浓度组(10、25、50、100 μg/ml),每孔加入相应浓度的罗格列酮,然后用2‰ DMSO溶解。实验组为:培养液+细胞+不同浓度药物;阴性对照组为:培养液+细胞。作用时间为12 h、24 h、48 h、72 h、96 h。
1.3.3 细胞增殖的检测 采用MTT 法检测细胞增殖。取对数生长期肝癌细胞HepG2以0.25%胰酶消化后配制成浓度是5×104/mL的细胞液,并接种于96孔培养板中,体积为100 μl/孔,正常培养贴壁后加药处理,每个浓度设5复孔,阴性对照组加入等体积培养液和细胞液。孵育12 h、24 h、48 h、72 h、96 h后,在每孔中加入0.5% MTT 20 μl,然后继续孵育4 h后弃上清,再在每孔中加入DMSO 150 μl,并振荡混匀,采用酶标仪测定每孔在570 nm处的吸光度(OD),依据OD值来判定药物对细胞增殖的影响程度。细胞生长抑制率(IR)计算公式为[5]:IR=(1-实验组OD值/对照组OD值)×100%,并计算出IC50。
1.3.4 细胞周期与凋亡检测 不同浓度罗格列酮处理HepG2细胞,同时设培养液+细胞为阴性对照组,于24 h后PBS洗涤后收集细胞,加入冰预冷的70%的乙醇于4 ℃固定1 h,离心弃固定液,PBS重悬5 min。300目筛网过滤1次,1 000 r/min离心5 min,弃去PBS。用5 mg/mL RNA酶100 μL消化,100 μg/mL碘化丙啶避光染色30 min,上流式细胞仪检测,Listmode软件分析凋亡及细胞周期分布。
1.4 统计学方法
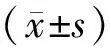
2 结果
2.1 罗格列酮对肝癌HepG2细胞增殖的影响
表1、图1显示,不同剂量的罗格列酮作用不同时间均对肝癌HepG2细胞有很强的抑制作用,罗格列酮处理12 h、24 h、48 h、72 h及96 h时对肝癌HepG2细胞的半数抑制浓度(IC50)分别是53.9 μg/ml、73.8 μg/ml、41.6 μg/ml、91.4 μg/ml及104.9 μg/ml。因此,罗格列酮对肝癌HepG2细胞有较强的体外毒性,肝癌HepG2细胞活性随着罗格列酮剂量和作用时间的增加而不断下降,出现剂量-效应和时间-效应的关系。

图1 不同浓度罗格列酮作用后对肝癌HepG2细胞生长的影响
2.2 罗格列酮对肝癌HepG2细胞周期与凋亡的影响
罗格列酮作用48 h后,肝癌HepG2细胞群分布于细胞的各个期,从表2看出,肝癌HepG2细胞G0/G1期比例明显增高,S期细胞比例有所下降,到G2/M期时细胞的比例明显下降,并呈显著的剂量依赖性。因此,罗格列酮对HepG2细胞作用48 h后能够诱导肿瘤细胞发生凋亡,且随着罗格列酮浓度的升高凋亡率增多,对剂量产生一定的依赖性。
3 讨论
细胞周期进程是受到细胞自身精密调节的。细胞周期分为G0/G1期﹑S期﹑G2期﹑M期4期。细胞在完成G1→S→G2→M的一次增殖过程中,在各期中存在着功能不同的检测点,细胞周期检查点对细胞周期按序正常进行起着重要作用,G0/G1和G2/M期检查点是其中非常关键的检查点[6-7]。本研究通过对细胞周期的分析结果显示,罗格列酮作用48 h后,肝癌HepG2细胞群分布于细胞的各个期,肝癌HepG2细胞G0/G1期比例明显增高,S期细胞比例有所下降,到G2/M期时细胞的比例明显下降,并呈显著的剂量依赖性。说明罗格列酮可导致肝癌HepG2细胞滞留在G0/G1期,对细胞向G2/M期移行有一定的抑制作用。
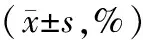
表1 罗格列酮对肝癌HepG2细胞的增殖抑制和毒性作用影响
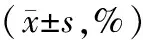
表2 罗格列酮对肝癌HepG2细胞周期与凋亡的影响
注:*为与阴性对照组比较,P<0.05。
细胞凋亡是指受基因调控的程序性死亡过程,在维持机体环境稳定时,多种基因控制细胞发生自主的、有序的死亡过程,因此也被称为细胞程序死亡[8]。所以细胞凋亡过程涉及一系列的基因激活、表达及调控等,是一种机体为更好地适应自身的生存环境而积极发生的争取死亡的过程[9]。但是在恶性肿瘤的发生和发展过程中,细胞凋亡减少与肿瘤细胞的过度增殖和异常分化有关。因此细胞凋亡调控异常在恶性肿瘤的发生和发展过程中扮演着举足轻重的作用。肿瘤防治的关键点就是抑制细胞的增殖和(或)促进细胞发生的凋亡[10-11]。而能否诱导细胞凋亡与诱导细胞凋亡的程度是评价抗肿瘤药的重要关键性指标。本研究结果显示,罗格列酮对肝癌HepG2细胞引起了明显的细胞凋亡,并且因为药物浓度的不同,细胞的凋亡率从13.4%到67.6%,同时呈时间依赖性及剂量依赖性。肝癌HepG2细胞的凋亡率可以随罗格列酮浓度的增加而升高,因此,推测罗格列酮是通过改变细胞周期来诱导细胞发生凋亡的。
本研究采用MTT检测罗格列酮对肝癌HepG2细胞生长及毒性的作用,结果显示,不同浓度的罗格列酮处理对肝癌HepG2细胞不同时间的贴壁细胞有很强的毒性作用,在作用48 h后罗格列酮对肝癌HepG2细胞作用的IC50值均小于50.0 μg/ml。根据南美抗肿瘤药物研发办公室颁布的有关植物提取物抗肿瘤成分标准(体外实验IC50< 50 mg/L的植物提取成分确定为有效抗肿瘤成分)[12],显示罗格列酮有较强的体外细胞毒性。本研究的结果表明肝癌HepG2细胞活性随着罗格列酮剂量和作用时间的增加而下降,表明罗格列酮能明显抑制肝癌HepG2细胞的生长,其作用具有时间和浓度依赖性。
综上所述,罗格列酮能抑制肝癌HepG2细胞生长并促进其凋亡,这显示了罗格列酮的潜在价值。
[1] 张 萌,彭 利,乔治斌,等.罗格列酮激活p38MAPK通路调控p53及p21影响人肝癌HepG2细胞周期〔J〕.第三军医大学学报,2014,36(3):240-243.
[2] 张 萌,彭 利,乔治斌,等.罗格列酮通过PI3K/PTEN/Akt通路抑制人肝癌HepG2细胞增殖〔J〕.细胞与分子免疫学杂志,2014,30(2):147-150
[3] 张 萌,彭 利,乔治斌,等.罗格列酮诱导人肝癌HepG2细胞凋亡中p38MAPK通路的作用〔J〕.肿瘤防治研究,2014,41(11):1181-1185.
[4] 葛元勋,巩 丽,朱少君,等.HOXA9基因抑制肝癌细胞HepG2迁移与侵袭能力的实验研究〔J〕.现代肿瘤医学,2017,25(1):29-33.
[5] 张 萌,彭 利,乔治斌,等.罗格列酮对人肝癌细胞HepG2裸鼠移植瘤的影响及机制〔J〕.中国老年学杂志,2015,35(8):2191-2194.
[6] J,Wu L-J,Yang D-J,et al.Rosiglitazone attenuates tumor necrosis factor-α-induced protein-tyrosine phosphatase-1B production in HepG2 cells〔J〕.J Endocrinol Invest,2012,35(1):28-34.
[7] Shumin,Yang Ting,Luo Huang,et al.Rosiglitazone inhibits expression and secretion of PEDF in adipose tissue and liver of male SD rats via a PPAR-γ independent mechanism〔J〕.Endocrinology,2014,155(3):941-950.
[8] Enkhzaya,Davaa Jeong-Sook,Park.Formulation parameters influencing the physicochemical characteristics of rosiglitazone-loaded cationic lipid emulsion〔J〕.Arch Pharm Res,2012,35(7):1205-1213.
[9] Meng,Zhang Li,Peng Zhibin,et al.Rosiglitazone inhibits human HepG2 cell proliferation via PI3K/PTEN/Akt signaling pathway〔J〕.Xi bao yu fen zi mian yi xue za zhi = Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2014,30(2):147-50.
[10] Enkhzaya,Davaa Bong-Seok,Kang Joo-Hui,et al.Combined delivery of the adiponectin gene and rosiglitazone using cationic lipid emulsions〔J〕.Int J Pharm,2015,483(1-2):124-130.
[11] Jae Hoon,Moon Hyung Jun,Kim Hyun Min,et al.Upregulation of hepatic LRP1 by rosiglitazone:a possible novel mechanism of the beneficial effect of thiazolidinediones on atherogenic dyslipidemia〔J〕.J Mol Endocrinol,2012,49(3):165-741.
[12] F,Bogazzi G,Rossi M,et al.Effect of rosiglitazone on serum IGF-I concentrations in uncontrolled acromegalic patients under conventional medical therapy:results from a pilot phase 2 study〔J〕.J Endocrinol Invest,2011,34(2):e43-51.

