小鼠lewis肺癌原位移植瘤和异位皮下移植瘤模型的对比研究
马雪曼 王笑民 于明薇 张甘霖 杨国旺 于 洁
肺癌作为第二大最普遍的恶性肿瘤,其死亡率在世界范围内仍然居高不下。据统计,非小细胞肺癌则占据了肺癌总病例的85%,其中包括鳞状细胞癌、腺癌和大细胞癌[1]。在目前的治疗方式下非小细胞肺癌的5年存活率仅为15%[2],更安全有效的治疗方式被迫切需要。在肺癌的新型治疗方法的研究中1个主要的障碍是缺乏简便易行的、可重复的、临床相似度更高的动物模型。原位移植瘤和异位移植瘤相比,其优点在于肿瘤细胞生长的微环境与肺癌临床情况相符合。在曾经常用的皮下移植瘤模型中,一些抗转移的药物缺乏响应,使得原位移植瘤模型更受到药物试验的推崇[3]。已经有很多种肺原位移植瘤模型的建立方法被报道,最常用的方法包括经气管细胞注射法和经胸壁细胞注射法[4]。然而,由于这些肺原位移植瘤模型的建立方法缺乏简便性和可重复性,原位移植瘤的实时监测对实验条件、实验仪器有较高的依赖性,其成瘤性不稳定,手术创伤大,荷瘤鼠生存时间短等局限性,大多数实验研究依然沿用皮下移植瘤模型。本研究中,我们同时建立了生物发光的肺癌原位移植瘤模型和异位皮下移植瘤模型,对这两种模型小鼠进行观察,对比它们的一般情况、成瘤情况、转移情况,并对比两种模型的病理学差异。
1 材料与方法
1.1 试剂与仪器
小鼠ll2-luc-m38肺癌细胞株( ATCC细胞库,美国),10%胎牛血清、高糖DMEM培养基、0.25%胰酶(均为Hyclone公司产品,美国),异氟烷,河北一品制药有限公司。一抗 VEGF(ab46154)购自Abcam Biotechnology公司。荧光素(D-Luciferin)购自美国GOLD BIOTECHNOLOGY公司,用PBS溶解稀释为15 mg/ml的溶液,0.22 μm滤器过滤后避光保存。电子游标卡尺:上海申韩量具有限公司;小动物活体成像系统(In-vivo imagingsystem,IVIS):美国Caliper公司;CO2培养箱:日本三洋公司;微量移液器:eppendorff公司;离心机:北京白洋医疗器械有限公司。细胞培养箱、超净台、电子称等均由首都医科大学附属北京中医医院中心实验室提供。
1.2 实验动物
SPF级 C57BL/6纯系小鼠,6~8周龄,雄性,体重19~21 g,购于北京维通利华实验动物技术有限公司,饲养在首都医科大学附属北京中医医院实验动物中心无特定病原体(specificpathogen free,SPF)的饲养间,并进行无菌接种,所有实验操作程序均经过首都医科大学附属北京中医医院实验动物中心批准,并按实验动物使用的3R原则给予人道的关怀。
1.3 方法
1.3.1 细胞培养及处理 将小鼠Lewis肺癌细胞置于含10%胎牛血清及高糖DMEM的完全培养基中,置于37 ℃5%CO2培养箱中培养,每1d更换培养液1次,每2 d用0.25%胰酶消化传代一次,细胞汇合率达90%时,收集细胞,离心去上清,加入生理盐水吹打,使细胞悬浮于生理盐水中,台盼蓝染色细胞活力测定大于95%,并进行细胞计数,调整细胞浓度为1×107/ml、2×107/ml的细胞悬液备用。
1.3.2 注射前 Matrigel 的准备 将-20 ℃长期保存的Matrigel置于4 ℃冰箱中过夜融化,将已融化的Matrigel和2 × 107/ml 浓度的细胞悬液按 1∶ 1混匀,所有操作在冰浴中进行。
1.3.3 分组 小鼠共40 只,其中20只建立肺癌原位移植瘤模型,20只建立皮下移植瘤模型。每组10只用于观察移植瘤的生长情况和转移情况,另外10只用于生存曲线的测定。
1.3.4 原位肺癌动物模型的建立 麻醉:氧气与异氟烷按比例混合对小鼠进行呼吸麻醉。 接种:将小鼠麻醉后,右侧卧位置于操作台上,对小鼠腋下剪毛并用乙醇消毒,在左腋前线肋弓上约1.5 cm处作一个5 mm大小的切口,分离皮肤及皮下组织,暴露胸壁,至能看到肺叶随呼吸上下活动为止,将 50 μl混有Matrigel的细胞悬液用微量进样器在室温下放置2 min后,再注射至左肺上,进针深度约3 mm,注射后停针数秒,拔针后缝合切口[5]。
1.3.5 肺癌皮下移植瘤动物模型的建立 小鼠注射部位用75%酒精消毒,无菌注射器吸取细胞悬液,右侧腋后线下2 cm处斜行入针,刺入皮下,每只注射0.1 ml的1×107/ml细胞悬液,形成圆形小皮丘,注射完按压入针点,出针。
1.4 小鼠体重及一般情况
每周两次使用电子天平称量小鼠体重,观察小鼠进食、饮水、皮毛光泽度和脱落等情况。每组随机抽取10只小鼠观察生存时间并记录。
1.5 小动物活体成像系统检测肿瘤生长和转移情况
小动物活体成像仪每7天检测1次荷瘤小鼠移植瘤及转移灶肿瘤光子数。小鼠背部皮下注射200 μL底物荧光素10 min后应用小动物活体成像系统检测皮下移植瘤生物发光及转移情况。具体原理为:ll2-luc-m38是能稳定表达荧光素酶(luciferase,luc)的细胞株,当外源性给予底物荧光素(luciferin)时,荧光素酶催化荧光素的氧化反应,即可在体内产生发光现象,发光强度可以用小动物活体成像仪器(IVIS)进行检测。
1.6 解剖学和病理学检测
接种后第21天脱颈椎处死小鼠,或将已经死亡的小鼠,进行详细的解剖并取材,检查肺转移及其他器官转移情况。取出皮下移植瘤及小鼠肺脏,用10%中性甲醛固定,经脱水透明石蜡包埋,切片,HE染色及二步法免疫组化染色(VEGF),封片,光镜下观察拍照。
2 结果
2.1 小鼠体重及一般情况
每周2次用电子天平称量小鼠体重,绘制小鼠体重变化曲线(图1)。皮下移植瘤模型组小鼠体重逐渐上升;原位移植瘤模型组小鼠体重逐渐增加,在肿瘤接种后第14天达到最高体重,随着肺原位移植瘤的进一步增大,体重逐渐下降。两组小鼠在接种两周后均出现进食进水量减少,活动减少,皮毛失去光泽,有卷曲脱落的现象。

图1 小鼠体重变化曲线
2.2 肿瘤形成和转移情况
每7天用小动物成像仪检测小鼠移植瘤生物发光强度。成瘤时间:肺原位移植瘤和皮下移植瘤的两组小鼠均在接种当天检测到微弱的生物发光,随时间延长生物发光强度逐渐增强。皮下移植瘤和肺原位移植瘤的成瘤率均为100%。接种后第14天,肺原位移植瘤组小鼠检测到对侧胸部出现肿瘤生物发光,接种后第21天,皮下移植瘤组小鼠检测到皮下移植瘤(右腋下)同侧或对侧胸部出现肿瘤生物发光。接种后第21天对小鼠进行解剖观察:肺原位移植瘤组小鼠左肺(接种部位)可见肿瘤结节形成,部分小鼠对侧肺脏亦可见肿瘤结节,同时部分小鼠出现了胸膜转移、心包转移、胸骨柄转移,其中1只小鼠出现了肾脏转移,转移率为100%;皮下移植瘤组小鼠右侧腋下(接种部位)形成一个体积较大、类圆形的肿瘤,部分小鼠肺部出现转移灶,转移率为70%。
2.3 病理检测结果
皮下移植瘤呈囊实性,随肿瘤体积增大瘤体中央可出现破溃出血,坏死、脱落。肺原位肿瘤周围看到肺泡受压萎缩,肺周围组织遭受浸润,肺泡壁增厚,炎性细胞增多。肺原位移植瘤和皮下移植瘤均表现出腺癌的病理特征,细胞形成大小不等,形状不一,排列不规则的癌巢,细胞分化差,核大,深染,核质比增大,核分裂相多见[6]。免疫组化染色结果示,肺原位移植瘤VEGF表达高于异位皮下移植瘤。
2.4 小鼠生存情况
接种后持续观察40天,皮下移植瘤组小鼠接种后第21天死亡1只,第28天死亡3只,第35天死亡2只,40天观察结束时4只存活。肺原位移植瘤组小鼠接种后第14天死亡1只,第19天死亡2只,第21天死亡1只,第22天死亡1只,第23天死亡2只,第24天死亡1只,第28天死亡2只,观察至此荷瘤小鼠全部死亡。两组荷瘤小鼠生存曲线,见图2。
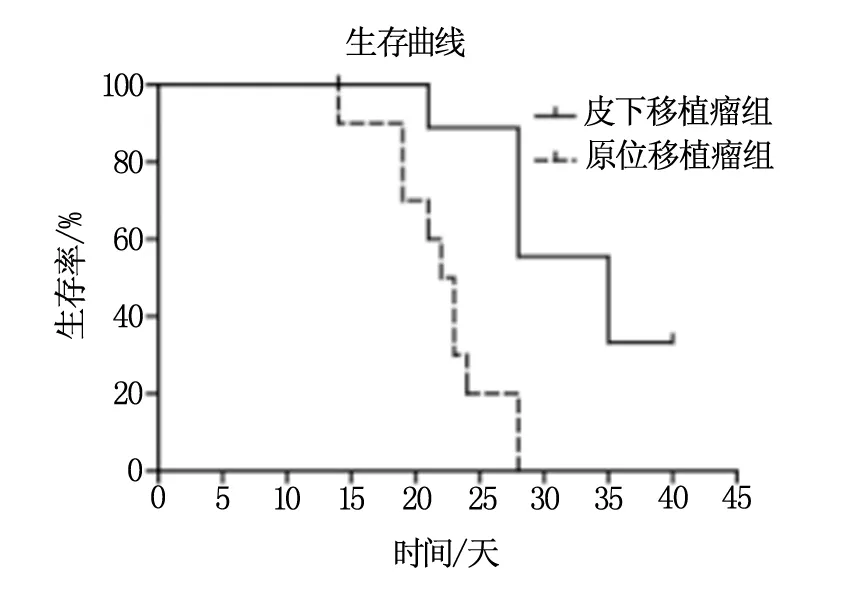
图2 小鼠生存曲线
3 讨论
在肺癌的实验研究中,由于异位移植法操作简单,一直作为首选方法,但“种子和土壤学说”已经证实了肿瘤原发器官微环境会影响肿瘤细胞的生物学特征[7],因此学者们认为异位移植瘤脱离了原发组织的微环境,其发生发展与临床相去甚远,同时该模型对药物反应性差、转移发生率较低、生存曲线数据与临床脱节[8]。原位移植瘤模型在规避了以上不足的同时亦存在其自身的缺点,如操作复杂,有手术死亡风险,生存期短,肿瘤发生发展不易被直观地观察到等。本研究中,我们同时建立了生物发光的肺原位移植瘤模型和异位皮下移植瘤模型,对这两种模型小鼠进行观察,对比它们的一般情况、成瘤情况、转移情况,并对比两种模型的病理学差异。在非小细胞肺癌的实验研究中,为研究者选择合适的动物模型提供多角度的、更为可靠的依据。
3.1 造模方法的对比
第一,注射部位的对比。异位皮下移植瘤模型的建立中,注射部位是动物体表皮下,可选择部位较为广泛,国内外研究中常用的部位有背部皮下、上肢腋窝皮下、腹股沟皮下等。本研究中根据既往的预实验选用了左上肢腋窝皮下。肺原位移植瘤模型中,其注射部位必须是肺脏,文献中左肺注射和右肺注射均有报道。
第二,注射方法的对比。异位皮下移植瘤模型的建立采用皮下注射的方法,即无菌注射刺入皮下,注射细胞悬液后形成圆形小皮丘。肺原位移植瘤模型的注射方法有经气管细胞注射法和经胸壁细胞注射法,前者需要小动物CT的辅助,操作相对复杂,因此本研究选用了经胸壁细胞注射法。即先将小鼠麻醉后消毒备皮,将注射部位的皮肤切开1个小口,暴露胸壁至能看到肺叶,用无菌注射器将细胞悬液注射至左肺。原位移植瘤模型的注射方法与皮下移植瘤模型对比,操作相对复杂,具有创伤性。
第三,注射物的对比。异位皮下移植瘤模型注射的细胞用无菌生理盐水重悬,终浓度为1×107个/ml,体积为100 μl。肺原位移植瘤模型注射的细胞用混有 Matrigel的生理盐水重悬,细胞悬液终浓度也是1×107个/ml,然而注射体积较小,为50 μl。由于小鼠肺脏本身体积较小,不宜注射体积较大的细胞悬液。同时肺脏有许多肺泡,并且不间断的进行着呼吸运动,用Matrigel胶与肿瘤细胞相混有利于固定注射物在肺脏中的位置。并且 Matrigel胶中含有各种蛋白及生长因子,均为肿瘤的形成提供不可或缺的营养成分,有益于肿瘤细胞的快速生长[9]。
3.2 两种模型的生物学对比
第一,荷瘤小鼠的一般状况和生存情况对比。皮下移植瘤模型组小鼠在观察的28天内体重逐渐上升,观察至第40天仍有40%的荷瘤小鼠存活,考虑到皮下瘤对小鼠内脏并未产生较大的影响,因此体重持续上升,直至接种后期皮下肿瘤长势迅猛,部分小鼠出现了肺脏转移,因而后期才出现了恶病质。原位移植瘤模型组小鼠前14天体重逐渐增加,随后体重逐渐下降,观察至第28天荷瘤小鼠无一存活,可能原因是肿瘤直接接种在肺部,随后出现全身各部位的转移,小鼠肿瘤负荷较重,故而体重下降,并伴有较重的恶病质,小鼠生存期较短。
第二,成瘤情况和转移情况对比。两组模型小鼠成瘤率均为100%。皮下移植瘤模型部分小鼠出现了肺部转移,原位移植瘤小鼠几乎全部出现了转移,转移部位包括双肺、胸壁、肾脏。皮下组织相对独立,瘤组织被皮肤包绕,血供不足,不易出现转移。肺原位移植瘤转移较多,因为肺脏本身是1个血供丰富、氧气充足、不断进行呼吸运动的器官,肿瘤细胞很容易发生血性转移、播种转移。
第三,解剖和病理学对比。异位皮下移植瘤模型组的肿瘤位于皮下组织,肺原位移植瘤模型的肿瘤位于肺脏,后者肺癌细胞生长条件更符合临床。HE染色和免疫组化染色结果亦表明,原位肿瘤组织中VEGF的表达明显较高,符合肺部血供丰富、氧气充足的肿瘤微环境。
综上所述,本研究同时建立了两种非小细胞肺癌模型,即以往常用的异位皮下移植瘤模型和临床相符的肺原位移植瘤模型,同时利用小动物活体成像系统中的生物发光技术对比监测两种荷瘤小鼠肿瘤形成及转移情况。利用Matrigel建立的Lewis非小细胞肺癌原位移植瘤模型,虽然操作相对复杂,但操作方法具有可重复性,成瘤性和转移性较好,手术死亡率为零。病理检测结果表明肺原位移植瘤能更好的模拟人肺癌病理特征,与该疾病临床发生发展相一致,为深入研究肺癌奠定了基础。为确定肺原位移植瘤模型的推展价值,我们希望继续从肿瘤微环境的角度进一步研究。
[1] Siegel R,Naishadham D,Jemal A.Cancer statistics,2012〔J〕.CA Cancer J Clin,2012,62:10-29.
[2] Rhea DJ,Lockwood S.Adults surviving lung cancer two or more years:A systematic review〔J〕.JBI Libr Syst Rev,2012,10(34):2297-2349.
[3] Onn A,Isobe T,Itasaka S,et al.Development of an orthotopic model to study the biology and therapy of primary human lung cancer in nude mice〔J〕.Clin Cancer Res,2003,9(15):5532-5539.
[4] Nakajima T,Anayama T,Matsuda Y,et al.Orthotopic lung cancer murine model by nonoperative transbronchial approach〔J〕.Ann Thorac Surg,2014,97(5):1771-1775.
[5] Peng L,Feng L,Yuan H,et al.Development of novel orthotopic non-small cell lung cancer model and therapeutic benefit of 2'-(2-bromohexadecanoyl)-docetaxel conjugate nanoparticlese〔J〕.Nanomedicin,2014,10(7):1497-1506.
[6] Konopka KE.Diagnostic Pathology of Lung Cancer〔J〕.Se min Respir Crit Care Med,2016,37(5):681-688.
[7] Wilmanns C.Orthotopic and ectopic organ environments differentially influence the sensitivity of murine colon carcinoma cells to doxorubicin and 5-fluorouracil〔J〕.Int J Cancer,1992,52(1):98-104.
[8] Shibuya K,Komaki R,Shintani T,et al.Targeted therapy against VEGFR and EGFR with ZD6474 enhances the therapeutic ef cacy of irradiation in an orthotopic model of human non-small-cell lung cancer〔J〕.Int J Radiat Oncol Biol Phys,2007,69(5):1534-1543.
[9] Mordant P,Loriot Y,Lahon B,et al.Biolu minescent orthotopic mouse models of human localized non-small cell lung cancer:feasibility and identi cation of circulating tumour cells〔J〕.PLoS One,2011,6(10):e26073.

