胃癌患者化疗前后血清VEGF、CA199水平的变化及临床价值
鲍 慧
胃癌在我国其发病率居各类肿瘤的首位,在我国恶性肿瘤中位居死因第二位,大部分胃癌患者确诊时已经处于中晚期,手术切除率极低,复发率高,5年生存率仅20%~50%[1]。现阶段,胃癌化疗后客观疗效评价是通过CT肿瘤体积测量、MRI的ADC值、PET的SUV值等,而胃是空腔脏器,这些疗效评价方法单独应用准确性欠佳,联合应用费用较高,临床缺乏1种简单易行且准确性较高的方法有效评价胃癌化疗效果[2]。本研究探讨了胃癌患者化疗前后血清VEGF、CA199水平的变化及临床价值,现报告如下。
1 材料与方法
1.1 一般资料
选取我院2014年5月至2016年5月收治的胃癌患者40例,纳入标准:所有患者均经CT腹部平扫、胃镜及病理学检查等确诊为胃癌,均无法接受手术治疗或拒绝接受手术治疗,均知情同意;排除标准:将有心肝肾等重要脏器疾病、肿瘤病史等患者排除在外。其中男性患者26例,女性患者14例,年龄28~78岁,平均(58.2±10.2)岁。病理类型:27例为胃体癌,13例为贲门癌;病理分期:21例为Ⅲ期,19例为Ⅳ期。将这些患者作为胃癌组,另选取我院同期接收的40例健康体检人员为健康组,其中男性25例,女性15例,年龄29~78岁,平均(59.1±10.3)岁。两组患者的一般资料比较差异均不显著(P>0.05),具有可比性。
1.2 方法
胃癌组患者采用FP化疗方案化疗,具体操作为:给予患者静脉滴注15 mg/kg替加氟(0.2 g/5 ml,生产厂家:修正药业集团长春高新制药有限公司,批准文号:国药准字H22022854),每天1次,5 d为1个疗程,同时给予患者静脉滴注90 mg/m2顺铂(30 mg/支,生产厂家:南京制药厂有限公司,批准文号:国药准字H20103216),每4周1次,共治疗8周。化疗前后分别将其5 ml清晨空腹静脉血采集下来,健康组人员只1次将其空腹静脉血采集下来,然后对其进行抗凝,在此过程中将2%乙二胺四乙酸充分利用起来,在冰盒中放置,第一时间向实验室输送。以3 000 r/min的速率对其进行10 min的离心,将血浆分离出来,将其保存在-70 ℃的温度中待测。采用上海史瑞可生物科技有限公司生产的试剂盒,应用酶联免疫法(ELISA)对两组人员的血清血管内皮生长因子(VEGF)、糖抗原199(CA199)水平进行测定。
1.3 疗效评定标准
依据世界卫生组织(WHO)肿瘤治疗疗效评价指标,如果治疗后患者的肿瘤病灶最大直径之和缩小了至少80%,则评定为完全缓解(CR);如果治疗后患者的肿瘤病灶最大直径之和缩小了至少50%,则评定为部分缓解(PR);如果治疗后患者的肿瘤各病灶最大直径之和增大了25%以下或缩小了50%以下,则评定为无变化(NC);如果治疗后患者的肿瘤各病灶最大直径之和增大了25%以上,或有新病灶出现,或有腹腔积液出现,则评定为进展(PD)[3]。
1.4 观察指标
将两组血清VEGF、CA199水平详细记录下来并对其进行比较。同时,对胃癌组不同治疗效果患者化疗前后的血清VEGF、CA199水平进行统计分析。
1.5 统计学分析
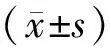
2 结果
2.1 两组患者的一般资料比较
两组患者的一般资料比较差异均不显著(P>0.05),具体见表1。

表1 两组患者的一般资料比较(例,%)
2.2 两组血清VEGF、CA199水平比较
胃癌组患者的血清VEGF、CA199水平均显著高于健康组(P<0.05),具体见表2。

表2 两组血清VEGF、CA199水平比较
2.3 胃癌组不同治疗效果患者化疗前后的血清VEGF、CA199水平比较
胃癌组40例患者中,CR 12例,PR 13例,NC 10例,PD 5例,总缓解率为62.5%(25/40),所有患者化疗后的血清VEGF、CA199水平均显著低于化疗前(P<0.05);化疗前CR+PR、NC患者的血清VEGF、CA199水平均显著低于PD患者(P<0.05),但CR+PR与NC患者的血清VEGF、CA199水平化疗前的差异均不显著(P>0.05),化疗后CR+PR、NC患者的血清VEGF、CA199水平均显著低于PD患者(P<0.05),而CR+PR患者的血清VEGF、CA199水平又均显著低于NC患者(P<0.05),具体见表3。
3 讨论
现阶段,胃癌化疗后客观疗效评价是通过CT肿瘤体积测量、MRI的ADC值、PET的SUV值等,而胃是空腔脏器,这些疗效评价方法单独应用准确性欠佳,联合应用费用较高,临床缺乏1种简单易行且准确性较高的方法有效评价胃癌化疗效果。VEGF属于1种外分泌二聚体糖蛋白,基因在人类染色体6p21.3上定位,在极大程度上调节着血管及胚胎发育,在淋巴管及新生血管形成中占有极为重要的地位[4]。相关医学研究表明[5],和早期胃癌相比,中晚期胃癌组织中具有明显较高的VEGF及微血管密度(MVD),而和不伴血管浸润或淋巴结转移的胃癌相比,伴血管浸润或淋巴结转移的胃癌组织具有明显较高的VEGF及MVD,从这里我们可以看出,在胃癌生物学行为及侵袭转移能力的判断中,VEGF可以作为1项重要标志物。相关医学研究表明[6],和癌旁组织及正常组织相比,胃癌组织中具有显著较高的VEGF表达,同时肿瘤的生长、侵袭、转移等生物学行为对其造成直接而深刻的影响,在肿瘤患者预后的评定中可以作为1项重要参考指标,肿瘤患者也具有显著较高的血清VEGF水平。相关医学研究表明[7],在对患者的病情进行了解、对患者的预后进行判断、对临床治疗进行指导的过程中,有效测定VEGF均具有重要的临床意义。

表3 胃癌不同治疗效果患者化疗前后的血清VEGF、CA199水平变化情况比较
注:与同组化疗前比较,#为P<0.05;与NC患者比较,*为P<0.05;与PD患者比较,&为P<0.05。
本研究结果表明,胃癌组患者的血清VEGF水平显著高于健康组(P<0.05),40例患者中,CR 12例,PR 13例,NC 10例,PD 5例,总缓解率为62.5%(25/40),所有患者化疗后的血清VEGF水平均显著低于化疗前(P<0.05);化疗前后CR+PR、NC患者的血清VEGF水平均显著低于PD患者(P<0.05),而化疗后CR+PR患者的血清VEGF水平又显著低于NC患者(P<0.05),和上述相关医学研究结果一致。现阶段,在胃肠道肿瘤的诊断中,CA199是临床通常采用的标志物,其具有较高的敏感性及特异性[8]。相关医学研究表明[9],胃癌治疗后可以将CA199作为观测指标,肿瘤进展随着其水平的提升而加快,随着其水平的降低而减慢,二者呈显著的正相关关系。本研究结果表明,胃癌组患者的血清CA199水平显著高于健康组(P<0.05),所有患者化疗后的血清CA199水平均显著低于化疗前(P<0.05);化疗前后CR+PR、NC患者的血清CA199水平均显著低于PD患者(P<0.05),而化疗后CR+PR患者的血清CA199水平又显著低于NC患者(P<0.05),说明在胃癌患者化疗效果及预后的判断及评价中,对血清CA199水平进行检测能够将有效依据提供给临床。
总之,胃癌患者化疗前后血清VEGF、CA199水平的变化能够将有效依据提供给治疗效果的评定,同时简单、费用低、随时监测、临床推广容易,可以作为旧方法的很好的补充。
[1] 吴江涛.CA199 与CEA 在胃癌诊断和临床病理分期中的临床应用〔J〕.河北医药,2013,35(21):3272-327.
[2] 王友春,马建党,韩宏锋,等.胃癌化疗前后循环血浆VEGF、IL-8 变化的临床意义〔J〕.胃肠病学和肝病学杂志,2008,17(3):226-227.
[3] 薛洪燕,陈丽荣.子宫颈鳞状细胞癌VEGF-C及其受体vEGFR-3 的表达及其临床意义〔J〕.实用肿瘤杂志,2008,23(1):24-27.
[4] 彭文新,雷凤生.胃癌中P53、PTEN 与VEGF 蛋白表达意义〔J〕.中国医药指南,2013,11(30):163-164.
[5] 倪 效,燕 敏.VEGF受体功能研究进展〔J〕.生命科学,2008,20(1):120-124.
[6] 施 怡,李 勇.陈石伟.Ang-2、VEGF 在进展期胃癌中的表达及与淋巴管生成的相关性分析〔J〕.实用癌症杂志,2013,28(6):611-613.
[7] 周永清,陈 旭,丁海斌.胃癌患者中TRAP1、Ki67、AFP的表达及其联合预测胃癌肝转移的价值〔J〕.实用癌症杂志,2016,14(9):1412-1413.
[8] Jun-Eul Hwang,Ji-Yun Hong,Ji Eun Kim,et al.Prognostic significance of the concomitant existence of lymphovascular and perineural invasion in locally advanced gastric cancer patients who underwent curative gastrectomy and adjuvant chemotherapy〔J〕.Jpn J Clin Oncol,2015,45(6):541-546.
[9] Novin Nikbakhsh,Mohsen Sadeghi,Elham Ramzani,etal.Efficacy of olanzapine in symptom relief and quality of life in gastric cancer patients receiving chemotherapy〔J〕.J Res Med Sci,2016,21(1):88-88.

