沉默CACUL1表达对食管癌细胞增殖的影响及其机制
马海琳,车少敏,王晓丽,张晓智,党诚学
(1西安交通大学第一附属医院肿瘤放射治疗科,西安 710061;2西安交通大学第一附属医院肿瘤外科;*通讯作者,E-mail:dangchengxue@aliyun.com)
食管癌(esophageal carcinoma,EC)发病率为全球恶性肿瘤第8位[1];食管鳞癌(esophageal squamous cell carcinoma,ESCC)多发于欧洲东部和亚洲,食管腺癌(esophageal adenocarcinoma,EAC)多发于美国北部及大部分西方国家,男性多见[2]。我国是EC高发国家,2015年中国癌症统计数据显示,EC为第4位常见恶性肿瘤,其中ESCC约占90%以上,全球ESCC约53%的病例来自中国[3]。目前,食管癌的治疗仍以手术、放疗和化疗等传统手段为主。近年来,生物免疫治疗在其他恶性肿瘤的应用可改善生存,但在食管癌疗效甚微。
CACUL1(CDK2-associated cullin domain1)在多种恶性肿瘤中高表达,并参与细胞周期调控、抑制细胞凋亡。因此,本研究应用siRNA沉默CACUL1基因表达,分析对人食管癌EC109细胞增殖的影响,观察细胞周期调节蛋白CDK2-Cyclin A/E表达的变化,探讨CACUL1影响食管癌细胞增殖的分子机制,为食管癌的基因治疗提供实验依据。
1 材料和方法
1.1 细胞株及主要试剂
食管癌EC109细胞由西安交通大学医学部教育部环境与基因相关疾病重点实验室提供。RPMI1640培养基和胎牛血清(GIBCO,USA),SYBRR Premix Ex TaqTMkit(TaKaRa,中国),Annexin Ⅴ-FITC apoptosis detdction kit(BD Bioscience,USA),ECL化学发光底物试剂盒(Pierce,USA),HRP标记抗小鼠IgG(KPL,USA),Mouse monoclonal anti-CACUL1(Santa Cruz,CA,USA),Mouse monoclonal anti-β-Actin(Santa Cruz,CA,USA),甲基噻唑基四唑/MTT、碘化丙啶/PI、二甲基亚砜/DMSO、RNaseA(均购自Sigma,USA)。
1.2 主要仪器
二氧化碳培养箱Galaxy S(英国RS Biotech),FASCalibar流式细胞仪(FALS CALIBAR BD),高通量多功能微板测试系统(德国MG Labtechnologies),倒置相差显微镜(OLYMPUS,Japan),PCR仪(PTC-100)(MJ Research,USA),iQ5 Multicolor Real-Time PCR Detection System(BioRad,USA),湿法蛋白电转印系统DYCZ-40D(北京六一仪器厂)。
1.3 细胞培养
常规复苏食管癌细胞系EC109,含10%胎牛血清及双抗(链霉素、青霉素)的RPMI1640培养基,37 ℃、5% CO2培养;在细胞密度为70%-80%,处于对数生长期时进行传代;每2 d更换培养液1次,逐日观察细胞生长情况变化;细胞处于对数生长期、细胞状态良好时进行实验。
1.4 siRNA的设计、合成及转染
siRNA由上海吉玛制药技术有限公司的设计与合成。序列见表1。
表1CACUL1siRNA序列
Table1SequencesofCACUL1siRNA

siRNA 序列 CACUL1siRNAsense:5′-GGAUGGUGCCAUAGAUCAATT-3′antisense:5′-UUGAUCUAUGGCACCAUCCTT-3′ negativesiRNAsense:5′-UUCUCCGAACGUGUCACGUTT-3′antisense:5′-ACGUGACACGUUCGGAGAATT-3′
在siRNA转染前,先将Lipofectamine2000与相应剂量的基础培养液混合,室温孵育5 min;再将siRNA与相应剂量的基础培养液混合,室温孵育5 min;然后将前两步混合液进一步混合,室温孵育15 min,将siRNA-Lipofectamine2000混合物加入培养板进行转染,培养至收获时间。
1.5 MTT比色法检测CACUL1 siRNA对EC109细胞增殖的影响
实验分阴性对照(negative siRNA)组和siRNA组。细胞转染后继续分别培养24,48,72 h,每孔加入20 μl 5 mg/ml的MTT溶液,继续孵箱中培养4 h;弃上清液,向培养板中加入DMSO(150 μl/孔),水平震荡10 min,促结紫色晶充分溶解;利用微板测试仪(POLARstar+OPTIMA)检测光吸收值。检测波长为490 nm,以只加培养液者为空白对照组;以光吸收值为纵轴,时间为横轴绘制肿瘤增殖活力的变化。
1.6 流式细胞仪检测CACUL1 siRNA对EC109细胞周期的影响
转染48 h时收集各组单细胞悬液,用4 ℃预冷的PBS洗涤2次,再200g离心5 min,弃上清;向每个样品加入250 μl 4 ℃预冷的PBS以重悬细胞,重悬完全后逐滴加入750 μl 4 ℃预冷无水乙醇,使其终浓度为75%,4 ℃放置过夜固定;将过夜固定的样品于离心机中300g室温离心2 min,弃上清液,再用PBS洗涤2次;向洗涤完毕的样品中加入浓度为100 μg/ml的RNaseA 0.5 ml,并且重悬细胞,37 ℃水浴30 min;向加入RNase且水浴完毕的样品中加入浓度为100 μg/ml PI染液0.5 ml,室温下避光孵育20 min;流式细胞仪检测分析。
1.7 流式细胞仪检测CACUL1 siRNA对EC109细胞凋亡的影响
细胞处理后培养、制备成浓度为1×105个/ml的悬浮细胞,向5 ml流式管中加入100 μl的细胞悬液,再向每管加入5 μl Annexin Ⅴ/FITC和5 μl 20 μg/ml的碘化丙锭,混匀后避光反应15 min;向避光反应完毕的样品中加入400 μl PBS。将处理完毕的样品,用FASCalibar流式细胞仪检测。
1.8 免疫蛋白印迹分析CACUL1 siRNA对CDK2-Cyclin A/E表达的影响
细胞转染48 h时,RIPA裂解液裂解细胞,SDS-PAGE电泳完毕后,将蛋白转膜至PVDF膜,放入封闭缓冲液中室温封闭1 h,Mouse monoclonal anti-CACUL1、Mouse monoclonal anti-β-Actin一抗4 ℃孵育过夜,弃一抗、TBST轻摇洗膜3次,加入HRP标记抗小鼠IgG,室温孵育2 h,弃二抗、TBST轻摇洗膜3次,ECL发光显色检测目的蛋白,实验以β-Actin为内参。
1.9 统计学方法
各组数据以均数±标准误表示,应用SPSS 16.0统计学软件进行数据统计分析,用单因素方差分析(One-Way ANOVA)进行显著性检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 转染CACUL1 siRNA后EC109细胞中CACUL1 mRNA表达下调
实时定量PCR结果显示,转染CACUL1 siRNA实验组与阴性对照组比较,CACUL1 mRNA表达量显著降低至(23.2±3.9)%,结果具有统计学差异(P<0.01,见图1)。
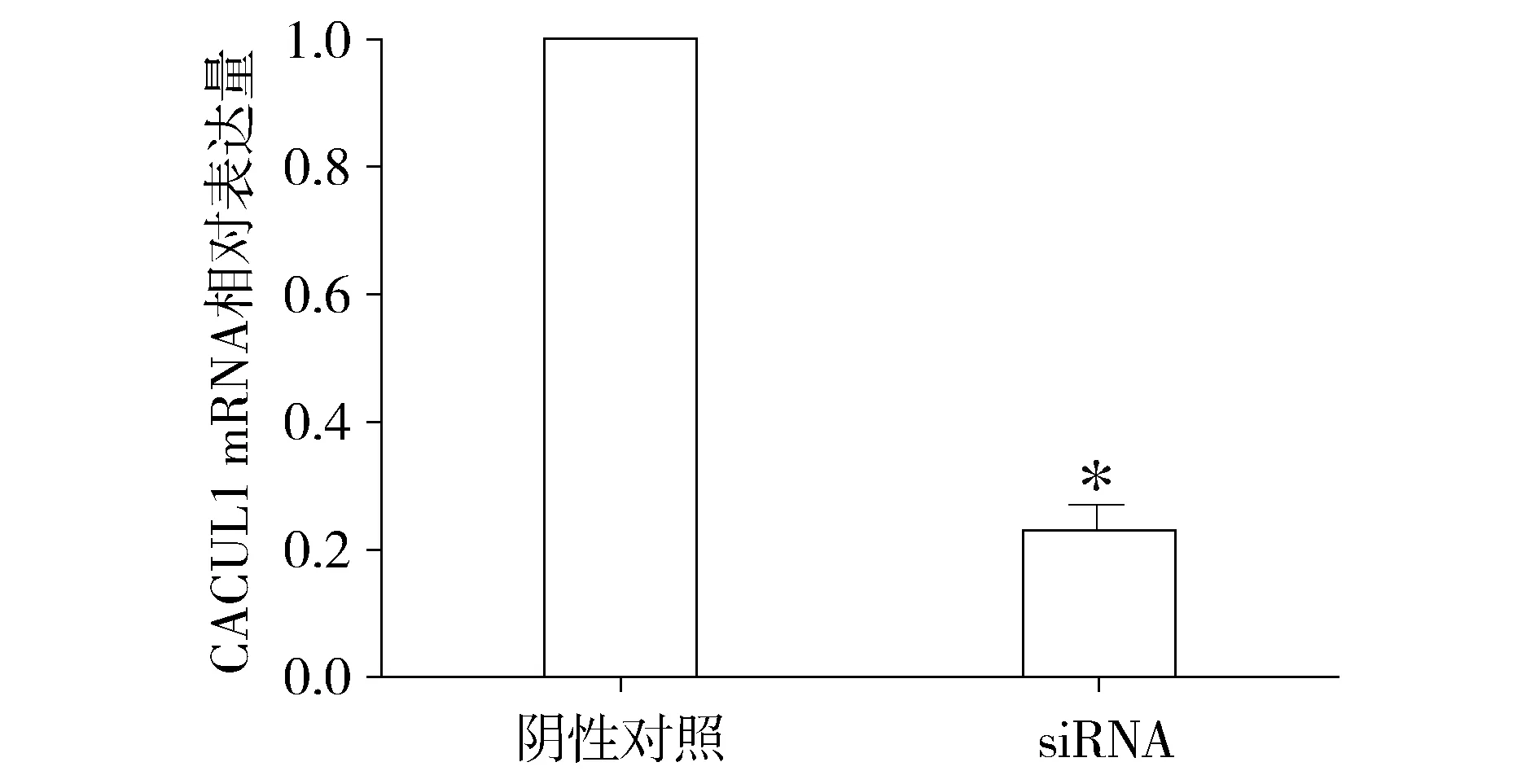
与阴性对照组比较,*P<0.01图1 转染CACUL1 siRNA后食管癌EC109细胞中CACUL1 mRNA表达变化Figure 1 Changes of CACUL1 mRNA expression in EC109 cells after transcription CACUL1 siRNA
2.2 沉默CACUL1对食管癌EC109细胞增殖的影响
MTT实验结果显示,与阴性对照组比较,沉默CACUL1 24,48,72 h时EC109细胞的增殖能力均显著降低,分别为(75.1±5.9)%,(63.6±5.2)%,(71.2±4.5)%(P<0.01,见图2)。细胞克隆实验结果显示,沉默CACUL1抑制了EC109细胞的增殖(见图3)。
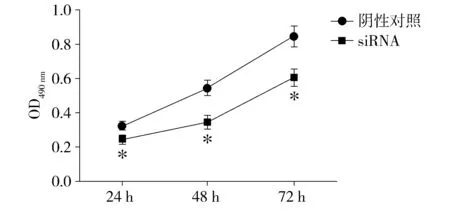
与阴性对照组相比,*P<0.01图2 MTT比色分析沉默CACUL1对食管癌EC109细胞增殖的影响Figure 2 Effect of CACUL1 silencing on EC109 cell proliferation by MTT assay
2.3 沉默CACUL1对食管癌EC109细胞周期的影响
流式细胞技术检测细胞周期实验结果显示,沉默CACUL1实验组与阴性对照组比较,G0/G1期细胞数量显著增加(P<0.01),S期细胞数量显著减少(P<0.01),而G2/M期细胞数量也显著减少(P<0.01,见图4,5)。证明沉默CACUL1使食管癌EC109细胞阻滞在G0/G1期,抑制细胞进入S期和G2/M期进行分裂。
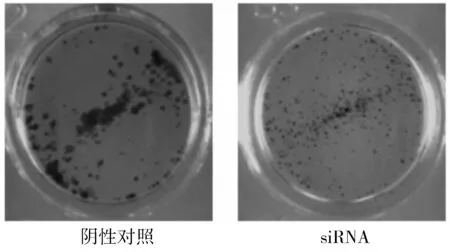
图3 沉默CACUL1对食管癌EC109细胞克隆形成的影响Figure 3 Effect of CACUL1 silencing on EC109 cell colony formation

图4 流式细胞仪检测沉默CACUL1对食管癌EC109细胞周期的影响Figure 4 Effect of CACUL1 silencing on EC109 cell cycle by flow cytometery
2.4 沉默CACUL1对食管EC109细胞凋亡的影响
流式细胞技术检测细胞凋亡实验结果显示,阴性对照组早期凋亡细胞为(2.31±0.93)%;晚期凋亡细胞为(1.58±0.75)%。与阴性对照组相比,siRNA组早期凋亡细胞显著增加(P<0.01),为(13.16±1.56)%,晚期凋亡细胞也增加(P<0.01),为(6.13±1.21)%(见图6,7)。
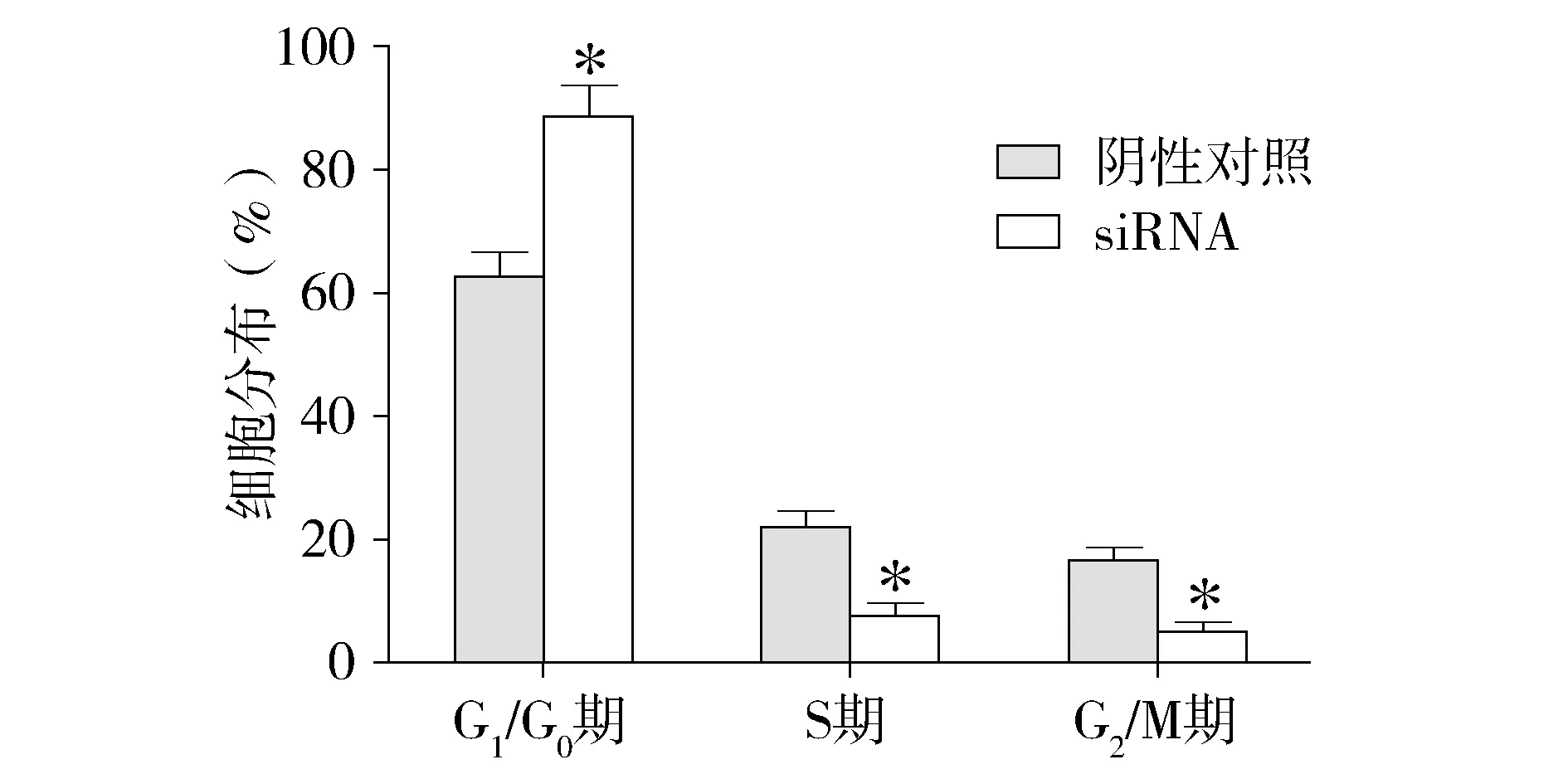
与阴性对照组相比,*P<0.01图5 沉默CACUL1对食管癌EC109细胞周期的影响Figure 5 Effect of CACUL1 silencing on cell cycle of EC109 cells

图6 流式细胞仪检测沉默CACUL1对食管癌EC109细胞凋亡的影响Figure 6 Effect of CACUL1 silencing on EC109 cell apoptosis by flow cytometery
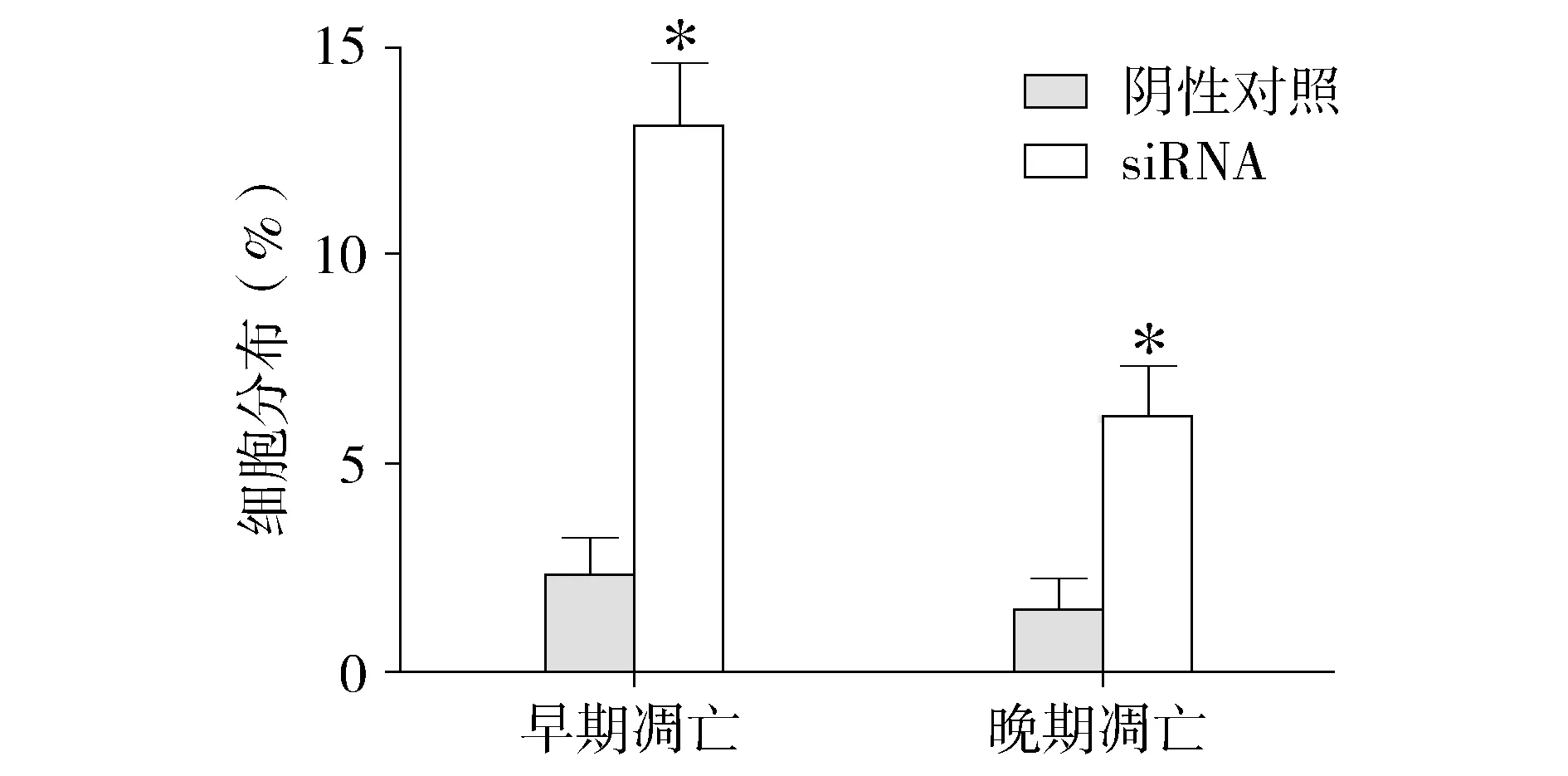
与阴性对照组相比,*P<0.01图7 沉默CACUL1对食管癌EC109细胞凋亡的影响Figure 7 Effect of CACUL1 silencing on cell apoptosis of EC109 cells
2.5 沉默CACUL1对CDK2-Cyclin A/E表达的影响
Western blot实验结果显示,沉默CACUL1后,CDK2-Cyclin A/E蛋白表达量均下调(见图8)。
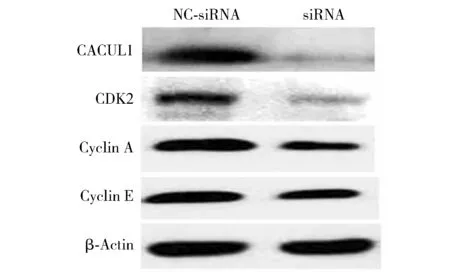
图8 沉默CACUL1对食管癌细胞中CDK2-Cyclin A/E表达的影响Figure 8 Effect of CACUL1 silencing on CDK2-Cyclin A/E expression of EC109 cells
3 讨论
Cullin蛋白家族成员作为支架在蛋白泛素化过程中发挥非常重要的作用,以Skp-Cullin-F-boxprotein(SCF)复合体形式存在,发挥生物学功能[4]。近年研究表明,Cullin蛋白家族成员的异常表达与恶性肿瘤的发生、发展、转移及复发等密切相关[5-12]。Chen等[13]采用基因芯片分析正常结直肠组织和结直肠癌组织的基因表达差异,筛选、分析,选择其中差异明显的上调片段,克隆出新基因,其编码的蛋白质在137-250位氨基酸之间含有一个cullin的结构域,与cullin-3编码的蛋白质同源;研究表明其与CDK2结合调控CDK2的活性,因此命名新基因为CDK2相关的culin结构域1(CDK2-associatedcullin domain1,CACUL1)。最近几项研究表明,CACUL1在多种恶性肿瘤中高表达并参与细胞周期调控、抑制细胞凋亡[14,15],也参与ER-α和RARα调控并抑制转录活性[16,17];此外,Kigosh等[18]报道CACUL1通过稳定Nrf2即通过Nrf2/ARE通路来调节内源性抗氧化应激反应。
肿瘤细胞增殖能力是评估肿瘤细胞活性的重要指标之一,不但要从细胞数量上评定,尚需对细胞周期进展及细胞凋亡状况评估。细胞增殖依赖于高效有序的细胞周期,细胞周期被改变往往会引起细胞增殖的显著变化[19]。细胞周期进展受许多因素调控,其内源性调控主要通过Cyclin-CDK-CKI有步骤的磷酸化和去磷酸化完成[20];Cyclins和CDKs正性调控细胞周期,CKIs负性调控细胞周期。Cyclins与CDK过表达或活性异常增强、CKI表达缺失和检测点异常,都可能导致细胞周期调控异常,引起肿瘤的发生、发展。刘荣等[21]的研究表明,CDK2异常表达导致细胞周期G1/S控制点功能异常,细胞增殖失去正常调控,使肿瘤获得增长优势,参与肿瘤的形成与进展。Huang等[22]报道,Cyclin A过表达与食管鳞癌分化程度有关,提示分化差;表明肿瘤细胞增殖活跃,提示其可作为恶性肿瘤细胞增殖活性的预测因子;进一步研究表明Cyclin A阳性表达的ESCC患者,增加了紫杉醇为基础的化疗敏感性。Bird-Lieberman等[23]将Cyclin A作为评估Barrett食管可能发展成为食管腺癌预测的生物标志物。Cyclin E在正常食管黏膜组织中低表达,在食管癌组织高表达,且表达水平随肿瘤分化程度降低而升高,表明细胞处于分裂增殖状态时Cyclin E表达增加。而Cyclin E可与CDK2结合并活化CDK2,形成的Cyclin E-CDK2复合物通过其激酶活性对pRb等底物进行磷酸化,促进细胞进入S期,无限增殖,导致癌症发生。
siRNA作为经典的抑制mRNA表达工具而被广泛使用,其调控机制主要是通过与mRNA的碱基完全互补配对,从而达到沉默靶基因的效应,是一种负调控机制;siRNA对靶mRNA的沉默效应,取决于siRNA本身设计,以及靶mRNA结构。本实验通过实时定量PCR技术检测,转染CACUL1 siRNA后EC109细胞中CACUL1 mRNA表达量显著降低,表明CACUL1 siRNA能很好地抑制CACUL1基因表达。采用MTT、流式细胞技术检测,沉默CACUL1能抑制EC109细胞增殖能力,使细胞周期阻滞在G1/G0期,与对照组比较,早期凋亡和晚期凋亡细胞数量均显著增加。通过Western blot实验检测得知,沉默CACUL1调控CDK2-Cyclin A/E蛋白表达,进而影响食管癌细胞功能。因此,调控CACUL1表达,通过Cyclin-CDK-CKI系统调节细胞周期、抑制细胞凋亡,影响细胞增殖,为食管癌的基因治疗提供新的思路。
参考文献:
[1] Rustgi AK, El-Serag HB. Esophageal carcinoma[J]. N Engl J Med, 2014, 371(26):2499-2509.
[2] Torre LA, Bray F, Siegel RL,etal. Global cancer statistics 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108.
[3] Chen W, Zheng R, Baade PD,etal. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132.
[4] Zhao YC, Sun Y. Cullin-RING ligases as attractive anti-cancer targets[J]. Curr Pharm Des, 2013, 19(18):3215-3225.
[5] Sarikas A, Hartmann T, Pan ZQ. The cullin protein family[J]. Genome Biol, 2011, 12(4):220.
[6] Chen G, Li G. Increased Cul1 expression promotes melanoma cell proliferation through regulating p27 expression[J]. Int J Oncol, 2010, 37(5):1339-1344.
[7] Min KW, Kim DH, Do SI,etal. Diagnostic and prognostic relevance of Cullin1 expression in invasive ductal carcinoma of the breast[J]. J Clin Pathol, 2012, 65(10):896-901.
[8] Metzger R, Heukamp L, Drebber U,etal. CUL2 and STK11 as novel response-predictive genes for neoadjuvant radiochemotherapy in esophageal cancer pharmacogenomics[J]. Pharmacogeno-mics, 2010, 11(8):1105-1113.
[9] Kin B, Nam HJ, Pyo KE,etal. Breast cancer metastasis suppressor 1 (BRMS1) is destabilized by the Cul3-SPOP E3 ubiquitin ligase complex[J]. Biochem Biophys Res Commun, 2011, 415(4):720-726.
[10] Hung MS, Mao JH, Xu Z,etal. Cul4A is an oncogene in malignant pleural mesothelioma[J]. Cell Mol Med, 2011, 15(2):350-358.
[11] Burnatowska-Hledin MA, Kossoris JB, Van Dort CJ,etal. T47D breast cancer cell growth is inhibited by expression of VACM-1, a cul-5 gene[J]. Biochem Biophys Res Commun, 2004, 319(3):817-825.
[12] Paradis V, Albuquerque M, Mebarki M,etal. Cullin-7: a new gene involved in liver carcinogenesis related to metabolic syndrome[J]. Gut, 2013, 62(6):911-919.
[13] Chen Y, Zhang YZ, Zhou ZG,etal. Identification of differently expressed genes in human colorectal adenocarcinoma[J]. World J Gastroenterol, 2006, 12(7):1025-1032.
[14] Kong Y, Bai PS, Sun H,etal. The deoxycholic acid targets miRNA-dependent CaC1 gene expression in multidrug resistance of human colorectal cancer[J]. Int J Biochem Cell Biol, 2012, 44(12): 2321-2332.
[15] Chen TJ. Gao F,Yang T,etal. CDK-associated Cullin-1 promotes cell proliferation with activation of ERK1/2 in human lung cancer A549 cells[J]. Biochem Biophys Res, 2013, 437(1):108-113.
[16] Moon M,Um SJ,Kim EJ.CAC1 negatively regulates RAR-αactivity through cooperation with HDAC[J]. Biochem Biophys Res, 2012, 427(1):41-46.
[17] Kim J, Park UH, Moon M,etal. Negative regulation of ER-α by a novel protein CAC1 through association with histone demethylase LSD1[J]. FEBS Lett, 2013, 587(1):17-22.
[18] Kigoshi Y, Fukuda T, Endo T,etal. CACUL1/CAC1 regulates the antioxidant response by stabilizing Nrf2[J]. Sci Rep, 2015, 5:12857.
[19] 郑琪,廖子君,赵凌宇,等.Rab1A siRNA对SGC7901胃癌细胞增殖和凋亡的影响[J].山西医科大学学报,2016,47(10):895-901.
[20] Murraya W, Marks D. Can sequencing shed light on cell cycling?[J]. Nature, 2001, 409(6822): 844-846.
[21] 刘荣,皇甫辉.喉鳞癌中CDK2对细胞周期的影响及其意义[J].山西医科大学学报,2008,39(5):433-436.
[22] Huang JX, Shen SL, Lin M,etal. Cyclin a overexpression is associated with chemosensitivity to paclitaxel-based chemotherapy in patients with esophageal squamous cell carcinoma[J]. Oncol Lett, 2012, 4(4):607-611.
[23] Bird-Lieberman EL, Dunn JM, Coleman HG,etal. Population-based study reveals new risk-stratification biomarker panel for Barrett’s esophagus[J].Gastroenterology,2012,143(4):927-935.

