小檗胺减轻大鼠离体心脏缺血再灌注损伤的作用及其分子机制
杨 健,肖 杰,肖 军,王 垒*
(1中国人民解放军第313医院心血管内科,葫芦岛 125000;2军委机关事务管理总局北极寺老干局门诊部;3中国人民解放军第309医院心血管内科;*通讯作者,E-mail:wangleifmmu@163.com;#共同通讯作者,E-mail:xxxjjj6288@sina.com)
缺血性心脏病严重危害人类健康,恢复血流供应是挽救缺血心肌的根本途径。动物实验及临床观察均表明,心肌缺血一定时间后恢复血流供应会加重组织损伤,造成器官、组织和细胞的结构与功能改变,引起细胞凋亡,最终影响心脏功能,这种现象被称为心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MI/RI)[1]。氧化应激水平的上升是缺血再灌注损伤引起细胞凋亡的主要原因之一,并在许多疾病的发生、发展中都发挥着非常重要的作用。缺血预处理(ischemia preconditioning,IPC)可通过启动抗氧化与抗凋亡等多种保护性机制减轻心肌缺血再灌注损伤,而药理学预处理因其易于应用和无需侵入性的特点,常用来模拟IPC[2,3],因此,寻找有效的保护性药物减轻心脏缺血再灌注损伤对心血管研究具有重要意义。
小檗胺(berbamine,BM)是从中药小檗属植物中提取出的一种双苄基异喹啉生物碱。近年来,小檗胺在抗肿瘤、免疫调节及心血管保护等方面的研究取得了许多进展,已被用于减轻化疗及放疗引起的低白细胞血症[4-6]。尽管有研究表明小檗胺可明显改善缺血再灌注损伤后的心脏功能,降低梗死面积及心律失常的发生率[7,8],但其分子机制仍未完全阐明。大量研究报道,沉默信息调控因子1(silent information regulator 1,SIRT1),一种NAD+依赖的蛋白去乙酰化酶,在缺血再灌注损伤中发挥重要的抗氧化应激及抗凋亡等调节作用[9,10],但其能否介导小檗胺的心脏保护效应仍需进一步验证。为此,本研究采用大鼠离体心脏缺血再灌注损伤模型,深入探究BM减轻心肌缺血再灌注损伤的分子机制,为今后BM用于缺血性心脏病及其并发症的治疗提供实验基础和理论依据。
1 材料与方法
1.1 实验动物及主要试剂
清洁级雄性SD大鼠32只,8周龄,体质量250-300 g,动物生产许可证号为SCXK(军)2007-007号,购自第四军医大学实验动物中心。BM、EX527和氯化三苯基四氮唑(TTC)购自美国Sigma公司。乳酸脱氢酶(lactate dehydrogenase,LDH)、肌酸激酶同工酶(creatine kinase MB isoenzyme,CK-MB)ELISA试剂盒购自美国R&D公司。琥珀酸脱氢酶(succinate dehydrogenase,SDH)、超氧化物歧化酶(superoxide dismutase,SOD)、细胞色素C氧化酶(cytochrome C oxidase,COX)和丙二醛(malondialdehyde,MDA)试剂盒购自南京建成生物工程研究所。anti-Ac-foxo1和anti-gp91phox抗体购自美国Santa Cruz公司;anti-Bcl2、anti-Bax、anti-cleaved caspase 3抗体购自美国Cell Signaling公司;anti-SIRT1、anti-Nrf2和anti-HO-1抗体购自美国Abcam公司;anti-β-actin抗体购自美国CMCTAG公司;辣根过氧化物酶标记的羊抗兔和羊抗鼠IgG二抗购自北京中杉金桥生物技术有限公司。
1.2 离体心脏模型的建立及实验分组
实验开始前40 min,用体积分数为95% O2和5% CO2混合气体向正常Krebs-Henseleit(KH)液(NaCl 120 mmol/L、KCl 4.7 mmol/L、MgSO41.2 mmol/L、KH2PO41.2 mmol/L、CaCl21.25 mmol/L、葡萄糖11 mmol/L、NaHCO325 mmol/L)中持续通气直至实验结束,温度维持在37 ℃,pH维持在7.35-7.45。SD大鼠经戊巴比妥钠(50 mg/kg)麻醉后开胸摘取心脏并置于4 ℃ KH液中,主动脉根部迅速固定于Langendorff灌流管口,灌流液从主动脉口逆行灌注,灌注压维持在80 mmHg。将球囊测压管刺破二尖瓣经左心房进入左心室,通过Labchart软件记录心脏功能。调节球囊内液体量使左室舒张末压(left ventricular end-diastolic pressure,LVEDP)维持在0-10 mmHg,平衡灌注15 min。平衡灌注期末,进行心功能监测,各组心脏以正常灌流液继续灌注5 min,开始行给药或给予阻断剂处理。实验随机分为4组(n=8):IR组、BM(100 nmol/L)+IR组、EX527(5 μmol/L)+BM(100 nmol/L)+IR组和EX527(5 μmol/L)+IR组。实验流程见图1。
1.3 心脏功能的监测
采用AcqKnowledge3.8.1生物信息采集系统(Biopac Systems公司,美国)进行心功能监测,记录左室内压(left ventricular pressure,LVP),LVEDP和左室收缩峰压(left ventricular peak systolic pressure,LVPSP),并计算左室发展压(left ventricular deve-loped pressure,LVDP)。
1.4 心肌梗死面积的检测

图1 实验流程图Figure 1 Experimental protocol
实验结束后,立即将心脏冻存于-80 ℃冰箱,待心脏完全冰冻后,沿纵轴依次切取6片厚度约为1 mm的切片,放入1% TTC溶液中,避光置于37 ℃水浴锅中孵育15 min;4%多聚甲醛中固定过夜后拍照,用OPTIMASv 5.2软件测定心肌梗死面积。白色区为梗死组织,红色区为正常组织,以白色区面积/总面积表示心肌梗死面积比。
1.5 心肌坏死指标的测定
常用冠状动脉流出液中LDH和CK-MB的释放量来指示心肌细胞坏死程度。收集各组心脏再灌注开始后5 min内的冠状动脉流出液,按照ELISA试剂盒说明书检测每组心脏LDH和CK-MB的释放量,与各组心脏湿重的相对比为各自标准化释放量,表示为IU/g。
1.6 心肌纤维形态学变化观察
实验结束后,各组心脏去掉心房等组织并剪取相同部位的左室心肌组织,4%多聚甲醛固定后常规石蜡包埋、切片,HE染色观察并拍照。
1.7 线粒体氧化应激指标的测定
差速离心法分离出心肌细胞线粒体后[11],按照试剂盒要求添加各试剂,用酶标仪分别检测相应波长下的吸光度值计算各组心肌细胞线粒体内SDH、SOD、COX活性和MDA含量。
1.8 Western印迹检测相关蛋白表达
每个心脏取50 mg的左室心肌组织,提取蛋白,并用BCA比色法进行蛋白定量。经聚丙烯酰胺变性凝胶电泳(SDS-PAGE)分离,湿转法将蛋白转移至聚偏二氟乙烯膜(PVDF)上,5%脱脂牛奶室温封闭2 h,分别在SIRT1(1 ∶1 000)、Ac-foxo1(1 ∶500)、Bcl2(1 ∶1 000)、Bax(1 ∶1 000)、cleaved caspase 3(1 ∶1 000)、gp91phox(1 ∶500)、Nrf2(1 ∶1 000)、HO-1(1 ∶1 000)、β-actin(1 ∶4 000)抗体中4 ℃孵育过夜,TBST洗膜3次,每次10 min,用相应的HRP标记的二抗(1 ∶5 000)室温孵育2 h,TBST洗膜3次,每次10 min。通过Bio-Rad照相系统采集照片,用ImageLab软件对其进行分析,β-actin作为内对照,检测各蛋白表达情况。
1.9 统计学分析
2 结果
2.1 各组大鼠心功能的比较
IR组心脏在恢复灌流后,心功能明显下降;BM+IR组心功能与IR组相比明显改善,LVEDP显著降低,LVDP显著升高(P<0.05);而使用EX527可明显逆转BM对心功能的保护作用,LVEDP显著升高,LVDP显著降低(P<0.05);单独使用EX527对再灌注损伤后的心功能无明显影响(P>0.05,见图2)。
2.2 各组大鼠心肌梗死面积和心肌纤维的比较
IR组大鼠心脏再灌注后TTC染色发现,心肌组织梗死明显;用BM预处理5 min后,BM+IR组大鼠心肌梗死面积较IR组明显降低(P<0.05)。同时,HE染色发现IR组心肌纤维排列紊乱,纤维断裂现象明显;BM+IR组心肌纤维排列紊乱的现象显著改善,纤维断裂显著减少。检测冠状动脉流出液中LDH和CK-MB含量发现,BM+IR组LDH及CK-MB释放量较IR组明显降低,心肌细胞坏死程度明显减轻(P<0.05)。而使用EX527均可明显逆转BM对心脏的上述保护作用(P<0.05,见图3)。
2.3 各组大鼠心肌组织氧化应激水平的比较
与IR组相比,BM+IR组大鼠心肌组织中抗氧化应激蛋白Nrf2和HO-1表达量明显增加,氧化应激标志蛋白gp91phox表达量明显降低(P<0.05);心肌细胞线粒体中SOD,COX和SDH活性显著升高,MDA含量显著减少,心肌细胞氧化应激水平明显降低(P<0.05);而使用EX527可明显逆转BM的抗氧化应激损伤的作用(P<0.05,见图4)。

与IR组比较,#P<0.05,##P<0.01;与BM+IR组比较,*P<0.05,**P<0.01;与BM+EX527+IR组比较,&P<0.05,&&P<0.01图2 各组心脏左室内压比较Figure 2 Comparison of left ventricular pressure among four groups

与IR组比较,#P<0.05,##P<0.01;与BM+IR组比较,*P<0.05,**P<0.01;与BM+EX527+IR组比较,&P<0.05,&&P<0.01图4 各组大鼠心肌组织氧化应激水平比较Figure 4 Comparison of oxidative stress level of myocardial tissues among four groups
2.4 各组大鼠心肌SIRT1通路及凋亡相关蛋白表达的比较
与IR组相比,BM+IR组大鼠心肌组织中SIRT1表达量明显增加,foxo1乙酰化水平明显降低,SIRT1通路被显著激活(P<0.05);并且给予BM预处理后,抗凋亡蛋白Bcl-2表达明显上调,凋亡蛋白Bax和cleaved caspase3表达明显下调,细胞凋亡明显被抑制;而使用EX527可显著逆转BM的抗凋亡作用(P<0.05,见图5)。
3 讨论
近年来,小檗胺因其在心血管疾病中的保护作用得到了广泛关注,因此,进一步阐明其分子保护机制具有很大的临床意义。研究发现,药物预处理可通过激发或模拟机体自身释放内源性保护物质发挥心脏保护效应[12]。作为一种重要的内源性心血管疾病保护性分子[13],SIRT1可介导多种抗氧化物质发挥抗心肌缺血再灌注损伤的作用[10,14,15],然而SIRT1能否介导小檗胺的心脏保护效应仍有待于进一步的研究。在本研究中,小檗胺预处理能明显提高再灌注损伤后的心功能,降低心肌梗死面积和肌纤维断裂程度,降低LDH的释放和CM-MB的产生,减轻缺血再灌注损伤。同时,本研究也观察到,SIRT1蛋白表达量在给予药物处理后明显上调,SIRT1下游分子foxo1的乙酰化程度显著降低,SIRT1信号通路被显著激活,而给予SIRT1阻断剂处理后能显著逆转小檗胺的保护作用,表明SIRT1可能参与小檗胺抗心肌缺血再灌注损伤的作用。
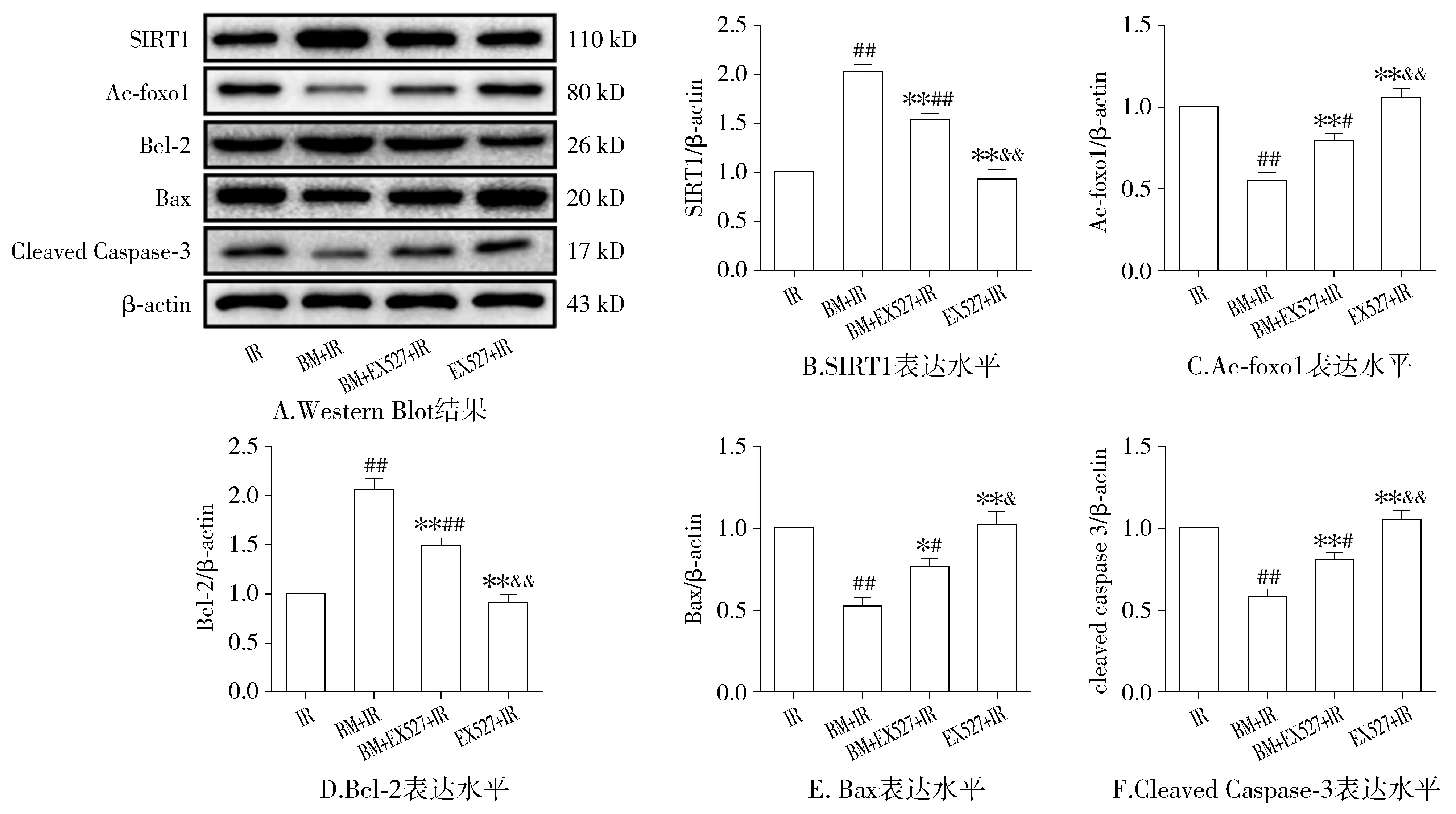
与IR组比较,#P<0.05,##P<0.01;与BM+IR组比较,*P<0.05,**P<0.01;与BM+EX527+IR组比较,&P<0.05,&&P<0.01图5 各组大鼠心肌组织SIRT1通路及凋亡相关蛋白表达比较Figure 5 The expression of SIRT1 signaling and apoptosis-related proteins of myocardial tissues in each group
大量研究证实,线粒体功能紊乱是心肌缺血再灌注损伤的重要病理学基础,并且线粒体氧化应激水平的上升可加速心肌细胞氧化应激损伤的进展[16]。由于心肌缺血再灌注导致线粒体功能障碍,氧自由基大量生成,使生物膜发生脂质过氧化反应,破坏心肌细胞膜、细胞器膜的流动性及通透性,并且攻击细胞结构蛋白与核酸,破坏心肌细胞结构,影响心肌细胞基因表达,最终导致再灌注性心律失常、心肌顿抑、细胞凋亡与坏死等严重后果,从而加剧缺血心肌的组织损伤及功能障碍[17-19]。在本研究中,与IR组心脏相比,小檗胺预处理能明显减轻线粒体氧化应激损伤,表现为线粒体SOD、COX和SDH活性增强,MDA生成减少。并且药物处理后,抗氧化应激蛋白Nrf2和HO-1表达量升高,氧化应激标志蛋白gp91phox表达量降低;同时给予SIRT1阻断剂能显著逆转小檗胺的抗氧化应激损伤作用,表明SIRT1可介导小檗胺减轻再灌注后的氧化应激损伤。
细胞凋亡与缺血再灌注损伤之间的关系也是近年来心、脑等器官缺血再灌注损伤的研究热点,缺血再灌注损伤可以诱发组织器官的细胞凋亡,成为缺血再灌注损伤影响组织器官功能的重要途径和表现形式[20-23]。本研究观察了缺血再灌注损伤与细胞凋亡相关信号通路的关系,结果显示凋亡蛋白Bax和cleaved caspase 3在小檗胺药物预处理后表达量明显下降,抗凋亡蛋白Bcl2表达量明显上升。本研究同样观察到,SIRT1阻断剂能显著逆转小檗胺的上述保护效果,表明SIRT1可介导小檗胺减轻再灌注后的细胞凋亡。
综上所述,本研究首次证实,小檗胺可通过激活SIRT1信号通路,减轻心肌组织氧化应激水平及细胞凋亡,进而发挥保护大鼠离体心脏缺血再灌注损伤的作用。本实验结果为进一步完善BM在心肌缺血再灌注损伤中的保护作用提供了新的实验依据,但BM如何激动SIRT1分子及其上下游通路仍有待进一步的研究与探索。
参考文献:
[1] Prasad A, Stone GW, Holmes DR,etal. Reperfusion injury, microvascular dysfunction, and cardioprotection: the “dark side” of reperfusion[J]. Circulation, 2009, 120(21):2105-2112.
[2] Reimer KA, Murry CE, Jennings RB. Cardiac adaptation to ischemia. Ischemic preconditioning increases myocardial tolerance to subsequent ischemic episodes[J]. Circulation, 1990, 82(6):2266-2268.
[3] Thuc LC,Teshima Y,Takahashi N,etal.Cardioprotective effects of pravastatin against lethal ventricular arrhythmias induced by reperfusion in the rat heart[J]. Circ J, 2011, 75(7):1601-1608.
[4] Ren Y, Lu L, Guo TB,etal. Novel immunomodulatory properties of berbamine through selective down-regulation of STAT4 and action of IFN-gamma in experimental autoimmune encephalomyelitis[J]. J Immunol, 2008, 181(2):1491-1498.
[5] Wang S, Liu Q, Zhang Y,etal. Suppression of growth, migration and invasion of highly-metastatic human breast cancer cells by berbamine and its molecular mechanisms of action[J]. Mol Cancer, 2009, 8:81.
[6] 郭治彬,付金国.小檗胺的心血管药理作用研究进展[J].中国中西医结合杂志,2005,25(8):765-768.
[7] Zheng Y, Gu S, Li X,etal. Berbamine postconditioning protects the heart from ischemia/reperfusion injury through modulation of autophagy[J]. Cell Death Dis, 2017, 8(2):e2577.
[8] Zhang CM, Gao L, Zheng YJ,etal. Berbamine protects the heart from ischemia/reperfusion injury by maintaining cytosolic Ca(2+)homeostasis and preventing calpain activation[J]. Circ J, 2012, 76(8):1993-2002.
[9] Yang Y, Duan W, Li Y,etal. Novel role of silent information regulator 1 in myocardial ischemia[J]. Circulation, 2013, 128(20):2232-2240.
[10] Yu L, Sun Y, Cheng L,etal. Melatonin receptor-mediated protection against myocardial ischemia/reperfusion injury: role of SIRT1[J]. J Pineal Res, 2014, 57(2):228-238.
[11] Li T, Zhang P, Liu J,etal. Protective effects of hemoglobin-based oxygen carrier given to isolated heart during ischemia via attenuation of mitochondrial oxidative damage[J]. Free Radic Biol Med, 2010, 48(8):1079-1089.
[12] 党旭云,蔚俊星,李静.右美托咪定对缺血再灌注损伤大鼠心肌VEGF表达的影响[J].山西医科大学学报,2015,46(10):959-961.
[13] Winnik S, Auwerx J, Sinclair DA,etal. Protective effects of sirtuins in cardiovascular diseases: from bench to bedside[J]. Eur Heart J, 2015, 36(48):3404-3412.
[14] Yu L, Li Q, Yu B,etal. Berberine attenuates myocardial ischemia/reperfusion injury by reducing Oxidative stress and inflammation response: role of silent information regulator 1[J]. Oxid Med Cell Longev, 2016, 2016:1689602.
[15] Yang Y, Duan W, Lin Y,etal. SIRT1 activation by curcumin pretreatment attenuates mitochondrial oxidative damage induced by myocardial ischemia reperfusion injury[J]. Free Radic Biol Med, 2013, 65:667-679.
[16] Walters JW, Amos D, Ray K,etal. Mitochondrial redox status as a target for cardiovascular disease[J]. Curr Opin Pharmacol, 2016, 27:50-55.
[17] Chen YR, Zweier JL. Cardiac mitochondria and reactive oxygen species generation[J]. Circ Res, 2014, 114(3):524-537.
[18] Kalogeris T, Bao Y, Korthuis RJ. Mitochondrial reactive oxygen species: a double edged sword in ischemia/reperfusion vs preconditioning[J]. Redox Biol, 2014, 2:702-714.
[19] Bagheri F, Khori V, Alizadeh AM,etal. Reactive oxygen species-mediated cardiac-reperfusion injury: Mechanisms and therapies[J]. Life Sci, 2016, 165:43-55.
[20] 张雯,宋俊科,杜冠华.缺血再灌注损伤与细胞凋亡信号转导通路[J].中国药学杂志,2015,50(7):565-569.
[21] 马新亮.丝裂原所致活化蛋白激酶家族在缺血再灌注所致心肌细胞凋亡中的作用(英文)[J].山西医科大学学报,2001,32(S1):16-21.
[22] Baliga RR. Apoptosis in myocardial ischemia, infarction, and altered myocardial states[J]. Cardiol Clin, 2001, 19(1):91-112.
[23] Feuerstein GZ. Apoptosis-new opportunities for novel therapeutics for heart diseases[J]. Cardiovasc Drugs Ther, 2001, 15(6):547-551.

