CEA、CA50、CA199联合检测在胰腺癌诊断和预后评估中的价值
李蓉
胰腺癌是消化系统常见的死亡率最高的恶性肿瘤之一,由于其恶性程度高,病情发展迅速,其死亡率已经位居恶性肿瘤总死亡率第三位[1]。众所周知,胰腺癌早期临床表现不典型,容易造成误诊、漏诊,所以确诊时只有20%的患者有机会接受外科手术治疗[2]。胰腺癌的预后效果非常差,5年生存率仅有1.3%~9.1%[3]。因而,寻找特异性的早期诊断和评估预后的标志物是降低胰腺癌死亡率、提高患者生活质量的关键。临床上对胰腺癌的诊断主要借助于影像学、病理学以及血清学的检查。目前比较认可的血清学指标的单一检测缺乏足够的灵敏度和特异度,很难作为有效的诊断和预后评估指标。因此,本研究主要探讨癌胚抗原(CEA)、糖类抗原 50(CA50)和糖类抗原 199(CA199)三种血清学肿瘤标志物的联合检测在胰腺癌的诊断和预后评估中的价值。
1 材料与方法
1.1一般资料选择我院2014年10月~2016年3月住院且根据影像学和病理学确诊的胰腺疾病患者280 例,其中胰腺癌组160 例,男101例,女59例; 年龄35~81岁,平均58.3岁。根治性手术切除53例,姑息手术107例。44例术后复发患者中男31例,女13例,确诊术后复发时的年龄为41~68岁。良性胰腺疾病组120例,男57例,女63例; 年龄20~77岁,包括慢性胰腺炎、胰头黏液性囊腺瘤、胰管结石、胰腺假性囊肿等。所有患者排除胰腺癌外其他恶性肿瘤、心脏病、严重的炎症、 部分自身免疫性疾病、 垂体瘤及原发性甲状腺功能减退、肾脏疾病等。同时选取正常体检健康对照组100例,男59例,女41例;年龄20~77岁,平均55.6岁。3组一般资料经统计学分析差异无统计学意义(P>0.05),具有可比性。
1.2检测方法真空采血管空腹采集研究对象的 肘 正 中 静 脉 血 4ml,静 置 30min,3 000r/min 离心10min,分离血清立即检测,-20℃保存。利用AutolumoA2000全自动化学发光检测仪及其提供的配套试剂对CEA、CA50 和CA199进行检测。CEA、CA50和CA199 正 常参考值分别为CEA<5ng/ml,CA50<25U/ml,CA199<35U/ml。
1.3统计学方法采用SPSS 18.0软件包进行数据管理和统计学分析,计量资料以均数±标准差(±s)表示,采用单因素方差分析和t检验,以P<0.05为差异有统计学意义。其中敏感性和特异性的计算依据公式,敏感性=真阳性/真阳性+假阴性;特异性=真阴性/假阳性+真阴性。
2 结果
2.1 CEA、CA50和CA199在胰腺癌与良性胰腺疾病组、健康对照组中表达水平比较与良性胰腺疾病组和健康对照组相比,胰腺癌患者组CEA、CA50和CA199在血清中的表达水平显著升高,差异有统计学意义(P<0.05)。而良性胰腺疾病组和健康对照组相比,血清CEA、CA50和CA199的表达水平差异无统计学意义(P>0.05),见表 1。
表1 3组 CEA、CA50和 CA199在血清中的表达(±s)
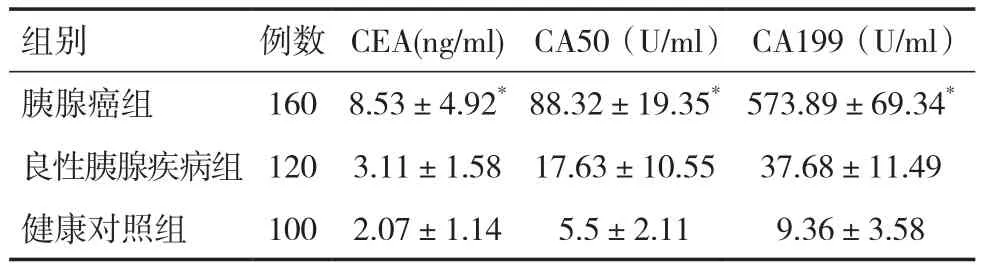
表1 3组 CEA、CA50和 CA199在血清中的表达(±s)
注:与良性胰腺疾病组、健康对照组比较,*P<0.05
组别 例数 CEA(ng/ml)CA50(U/ml) CA199(U/ml)胰腺癌组 160 8.53±4.92*88.32±19.35*573.89±69.34*良性胰腺疾病组 120 3.11±1.58 17.63±10.55 37.68±11.49健康对照组 100 2.07±1.14 5.5±2.11 9.36±3.58
2.2血清CEA、CA50和CA199在胰腺癌患者不同肿瘤分期中的表达水平CEA、CA50和CA199在胰腺癌不同肿瘤分期患者中的表达水平有显著性差异,随着临床分期的变化,3种肿瘤标志物表达水平明显发生变化。Ⅲ~Ⅳ期患者中的表达水平明显高于Ⅰ~Ⅱ期肿瘤患者,见表2。
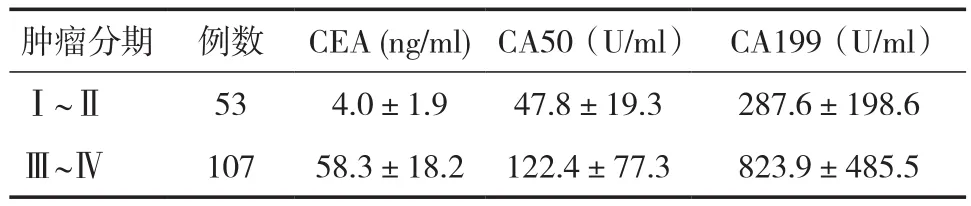
表2 CEA、CA50和CA199在胰腺癌患者不同肿瘤分期中的表达水平(x—±s)
2.3 CEA、CA50和CA199单一及联合检测胰腺癌的敏感性和特异性CEA、CA50和CA199在胰腺癌诊断中的敏感性达到了72.7%、51.5%、82.6%,特异性为87.8%、72.3%、76.0%。联合检测的敏感性和特异性均高于单一检测,为93.1%和82.8%。
2.4胰腺癌切除术后CEA、CA50和CA199表达水平在未复发组与复发组中表达水平的比较胰腺癌患者术后复发组中CEA、CA50和CA199的表达水平与未复发组相比显著性升高(P<0.05),见表3。
表3 CEA、CA50和CA199在复发组与未复发组中表达水平的比较 (±s)

表3 CEA、CA50和CA199在复发组与未复发组中表达水平的比较 (±s)
组别 例数 CEA(ng/ml) CA50(U/ml) CA199(U/ml)复发组 44 8.97±5.14 109.23±38.15 473.41±111.32未复发组 9 3.28±0.97 3.72±2.17 18.40±6.68
2.5 CEA、CA50和CA199单一及联合检测对胰腺癌术后复发诊断的敏感性和特异性53例手术切除组术后随访期在复发的44例患者中,CEA、CA50、CA199的敏感性分别为74.2%、53.0%、80.3%,特异性为89.9%、73.4%、74.0%。联合检测后敏感性和特异性分别达到了95.5%和86.3%。
3 讨论
胰腺癌是致死率较高的癌症之一,尽管现在临床上多采取多峰性治疗,但由于其复发率较高,所以5年生存率仍不到5%[4]。目前外科手术是唯一可以治愈的机会,但是只有20%的患者可以进行手术切除肿瘤[5]。而这些患者中只有15%的患者有早期癌症的表现,一旦有手术机会并且进行辅助治疗后,5年生存率就会增加到20%~30%[6]。所以及早确诊对治愈率和生存率的提高尤为重要。
CEA、CA50、CA199是肿瘤细胞表面的黏蛋白物质,而这种黏蛋白与肿瘤的发生发展有密切的联系。在临床中,这3种物质被公认为是肿瘤血清标志物,而且广泛用于胰腺癌的辅助诊断。CEA是一种酸性糖蛋白,胚胎时期主要在胰腺、肝脏等部位合成,CEA在大多数上皮性肿瘤中的表达,特别是内胚层来源的肿瘤如胰腺癌、消化道肿瘤、乳腺癌、肺癌中均有明显升高[7],是临床中常被用来辅助诊断胰腺癌的肿瘤标志物。CA50 是以唾液酸脂和唾液酸糖蛋白为主的糖蛋白,同时也是一种肿瘤抗原,它与CA199有一定的交叉抗原性,多用于胰腺癌、肠癌等的辅助诊断。CA199是一种Lewisa血型抗原,它作为肿瘤相关标志物在胰腺癌和胆囊癌中的检出阳性率最高,对胰腺癌的诊断敏感性为68%~93%,特异性也可达到60%以上,是迄今对胰腺癌辅助诊断最有价值和最主要的一种肿瘤血清标志物,近年来逐渐有证据表明它可以成为胰腺癌预后评估以及预测治疗后生存率的一项指标[8]。然而,这3者中任何一个指标单独检测时均不能达到足够的敏感性和特异性,多数研究者认为联合检测能够增加胰腺癌诊断的敏感性及特异性[9,10]。
本研究通过联合检测CEA、CA50、CA199在胰腺癌、良性胰腺疾病及健康对照组中的表达水平,发现CEA、CA50、CA199在胰腺癌中的表达均明显增高;与良性胰腺疾病以及健康对照组相比,差异有统计学意义。在联合检测3种指标后对胰腺癌的诊断敏感性可达到93.1%,特异性达到82.8%。因此通过本研究我们可以得出联合检测CEA、CA50、CA199对胰腺癌的诊断是一种快捷、无创、有效的途径。在本研究中我们同时对实施胰腺癌外科手术的患者进行连续监测,对术后患者联合检测CEA、CA50、CA199这3种标志物的表达,发现胰腺癌根治性切除术后复发组血清中CEA、CA50、CA199的表达水平与未复发组相比有明显的增高。在评估术后复发情况的观察中,联合检测(指3项检测任一指标阳性)对复发患者的诊断阳性率为95.5%(42/44),特异性达到了86.3%(3项检测指标均阳性),在满足特异性诊断的前提下,诊断的敏感性得到了提高。
有研究报道CEA、CA50和CA199对细胞间的粘附发挥着重要的作用, 细胞的粘附参与了肿瘤的转移过程,本研究同时检测了3种指标在胰腺癌患者不同肿瘤分期中的表达差异,发现CEA、CA50和CA199的表达水平与肿瘤的临床分期有关,在Ⅲ~Ⅳ期患者中的表达水平明显高于Ⅰ~Ⅱ期肿瘤患者。所以证实CEA、CA50和CA199与胰腺癌的增殖、浸润及转移有一定的相关性。所以在胰腺癌复发转移的监测和评估中发挥的具体机制,我们将在后续的实验中进一步研究探讨。
综上,通过对CEA、CA50、CA199三种血清肿瘤标志物的联合检测,对胰腺癌诊断的敏感性和特异性均高于单一指标的检测,并且可以较好地对胰腺癌患者预后进行有效的评估,从而有助于胰腺癌患者的疗效观察、复发预测,为改善患者生存及生活质量提供帮助。
1 Imaoka H, Mizuno N, Hara K, et al. Prognostic impact of carcinoembryonic antigen (CEA) on patients with m etastatic pancreatic cancer: A retrospective cohort study[J]. Pancreatology,2016,16(5):859-864
2 Deng T, Yuan Y, Zhang C , et al. Identification of Circulating MiR-25 as a Potential Biomarker for Pancreatic Cancer Diagnosis[J]. Cell Physiol Biochem,2016,39(5):1716-1722
3 Siegel RL, Miller KD, Jemal A. Cance r statistics, 2016. CA a Cancer J Clin,2016,66(5):7-30
4 Zhao J, Liang Y, Yin Q, et al. Clinical and prognos tic significance of serum transforming growth factor-beta1 levels in patients with pancreatic ductal adenocarcinoma [J]. Braz J M ed Biol Res,2016,49(8):1414-1431
5 Hidalgo M,Plaza C,Musteanu M,et al.SPARC Expression Did Not Predict Efficacy of nab-Paclitaxel plus Gemcitabine or Gemcitabine Alone for Metastatic Pancreatic Cancer in an Exploratory Analysis of the Phase Ⅲ MPACT Trial[J].Clin Cancer Res,2015,21(21):4811-4818
6 Sultana A, Cox T, Ghaneh P, et al. Adjuvant therapy for pancreatic cancer [J]. Recent Results Cancer Res,2012,196(7):65-88
7 黄红莉,周刚,牛立志,等.胰腺癌患者冷冻消融治疗前后血清CD44V6和整合素β1的变化及在预后评估中的意义[J]. 检验 医学,2013,28(12):1083-1087
8 Hernandez JM, Cowgill SM, Al-Saadi S, et al. CA 19-9 velocity predicts disease-free survival and overall s urvival after pancreatectomy of curative intent [J].J Gastrointest Surg ,2009,13(6):349-353
9 田力, 王 晓艳, 沈 守荣 . 肿 瘤标志物 CA199、CA242、CEA、CA125联合检测在胰腺癌诊断中的意义[J]. 世界华人消化杂志,2012,20(31):3047-3050
10 谢焕琴, 钟 武装. 血 清CA199、CA242及CEA联合检测对胰腺癌的诊断价值 [J]. 广西医科大学学报,2013,30(5):75-76

