肝细胞癌患者血清中microRNA-21和microRNA-126的表达水平及临床意义
周轶冰
肝细胞癌(hepatocellular carcinoma,HCC)在我国是一种恶性程度极高的肿瘤,死亡率较高,其发生是一个复杂的病理、生理发展过程,由调控细胞关键信号通路的失调、肿瘤原癌基因的激活和抑癌基因的失活等多因素参与,通过肿瘤细胞的增殖、迁移以及扩散等多途径发展[1]。microRNA广泛存在于各种真核生物中,非蛋白质编码RNA,长度为21~23核苷酸。通过已经被阐明的一小部分microRNA的生物学功能得知,人体的许多生理过程都有microRNA的参与,如胚胎发育、细胞分化与先天免疫等,尤其针对病毒性肝炎、肝癌等疾病更是存在着不同的microRNA表达,对于调控癌基因和抑癌基因起着关键作用[2~4]。
本研究主要针对肝细胞癌患者血清中micro RNA-21和microRNA-126的表达水平及其临床意义进行研究,统计资料来源于2014年3月~2017年3月期间在我院就诊的肝细胞癌患者血清标本,选取其中20例作为实验组,采用qRT-PCR检测方法对实验组样本术前、术后microRNA-21和microRNA-126的表达水平进行定量检测和分析,对microRNA-21和microRNA-126在各实验组和健康对照组中的表达进行统计学分析。
1 材料与方法
1.1临床资料选取2014年3月~2017年3月在我院确诊的肝细胞癌且行手术治疗的患者20例,取血清样本作为本研究的实验组,其中乙型肝炎病毒(HBV)阳性13例,乙型肝炎病毒阴性7例;男14例,女6例,年龄38~65岁,平均(48.6±4.5)岁。HBV阳性实验组中ALT≤40U/L者5例,ALT>40U/L者8例;AFP<5μg/L者9例,AFP≥5μg/L者4例;肿瘤大小≥3cm者10例,<3cm者3例;根据肿瘤TNM分期法对实验组中的样本进行分期:Ⅰ期2例,Ⅱ期6例,Ⅲ期5例。HBV阴性实验组中ALT≤40U/L者6例,ALT>40U/L者1例;AFP<5μg/L者3例,AFP≥5μg/L者4例;肿瘤大小≥3cm者4例,<3cm者3例;根据肿瘤TNM分期法对实验组中的样本进行分期:Ⅰ期1例,Ⅱ期2例,Ⅲ期4例。选取我院健康体检志愿者的血清样本10例作为健康对照组,其中男6例,女4例,年龄37~65岁,平均(51.0±6.2)岁,ALT≤ 40U/L者 9例,ALT>40U/L者1例;AFP<5μg/L者10例。HBV阳性实验组、HBV阴性实验组和健康对照组之间的性别、年龄等基本资料差异均无统计学意义(P>0.05),而在一些HBV-DNA定量、肿瘤大小以及肿瘤TNM分期等病理、生理资料上,两个实验组之间差异有统计学意义(P<0.05)。
1.2方法提取纯化总microRNA采用美国Molecular Research Center公司生产的Trizol试剂盒, 其中RT引物、上游引物、下游引物由广州睿博生物科技有限公司设计并提供[5~7]。然后通过RT-PCR 技术将microRNA单链逆转录成为cDNA,其中使用的逆转录试剂盒由Fermentas公司生产提供,再以此为模板通过PCR扩增系统进行DNA扩增。最后血清样本中microRNA-21和 microRNA-126表达水平的确定借助荧光探针法定量PCR检测技术来实现[8~10]。
提取血清中microRNA的方法如下[11]:①清晨空腹时,抽取各实验组对象外周静脉血2ml,为防止血细胞破裂,将试管中放入EDTA抗凝剂,再将抽取的静脉血放入管中,轻轻摇匀,使血液充分接触抗凝剂。②将上一步得到的试管放入冰箱,温度设定4℃,2h内将血浆分离。③采用上海生物有限公司生产的高速离心机,离心10min,将上层无色上清液小心吸出至Eppendorf管中,不可取中间白色细胞层。④将Eppendorf管中的上层无色上清液放入离心机,离心10min,使血浆进一步分离。⑤血浆分离后可放入冰箱长期保存,温度设定-80℃,按照每500μl的体积为一份进行分装。⑥提取并纯化总的microRNA,具体操作方法见美国Molecular Research Center公司生产的Trizol试剂盒说明书。⑦提取纯化microRNA的浓度和纯度,具体操作方法见美国Perkineliner UV紫外分光光度仪说明书。
另外,本研究入组的实验样本均经我院病理学确诊为肝细胞癌,术前未经任何放疗或者化疗,所有患者均接受了肝细胞癌根治性切除术。
1.3统计学方法本研究采用SPSS 20.0统计软件进行分析,其中年龄、肿瘤大小、AFP、ALT等患者的定量数据资料在HBV阳性实验组术前、术后、HBV阴性实验组术前、术后与健康对照组之间的差异采用非配对t检验来确定,具体数据采用±s表示,各实验组间microRNA-21和microRNA-126表达水平的差异则采用U检验,P<0.05为差异有统计学意义,所有P均为双侧[12]。
2 结果
采用qRT-PCR方法对HBV阳性实验组和健康对照组中的microRNA-21和microRNA-126的表达水平进行检测和分析,结果表明:①HBV阳性实验组患者术前microRNA-21的表达较健康对照组明显上调,术后microRNA-21的表达较术前明显下调,差异均具有统计学意义(P<0.05);②HBV阳性实验组患者术前microRNA-126的表达较健康对照组明显下调,术后microRNA-126的表达较术前明显上调,差异均具有统计学意义(P<0.05)。见表1。
采用qRT-PCR方法对HBV阴性实验组和健康对照组中的microRNA-21和microRNA-126的表达水平进行检测和分析,结果表明:①HBV阴性实验组患者术前microRNA-21的表达较健康对照组明显上调,术后microRNA-21的表达较术前明显下调,差异均具有统计学意义(P<0.05);② HBV 阴性实验组患者术前、术后microRNA-126的表达水平与健康对照组无显著差异(P>0.05)。见表2。
表1 microRNA-21和microRNA-126在HBV阳性实验组与对照组中的表达(±s)
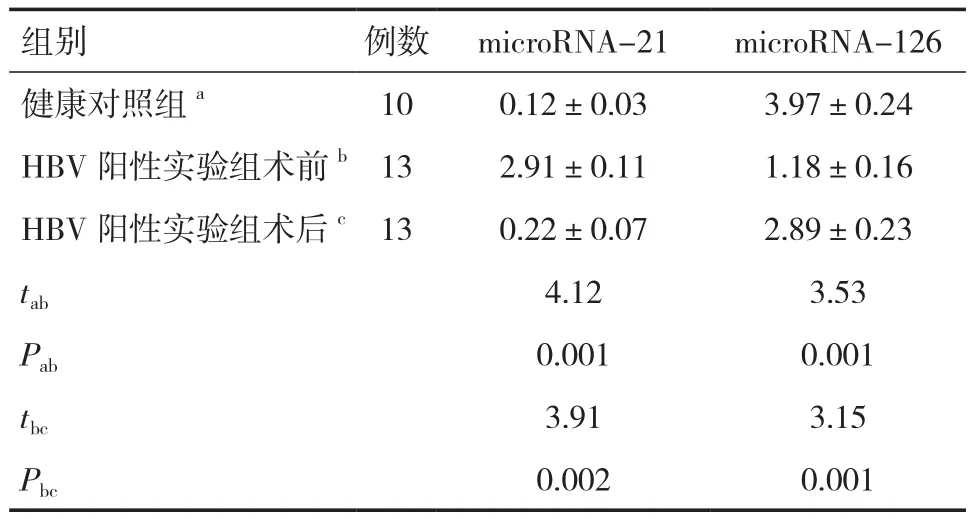
表1 microRNA-21和microRNA-126在HBV阳性实验组与对照组中的表达(±s)
组别 例数 microRNA-21 microRNA-126健康对照组a 10 0.12±0.03 3.97±0.24 HBV阳性实验组术前b13 2.91±0.11 1.18±0.16 HBV阳性实验组术后c13 0.22±0.07 2.89±0.23 tab 4.12 3.53 Pab 0.001 0.001 tbc 3.91 3.15 Pbc 0.002 0.001
表2 microRNA-21和microRNA-126在HBV阴性实验组与对照组中的表达(±s)
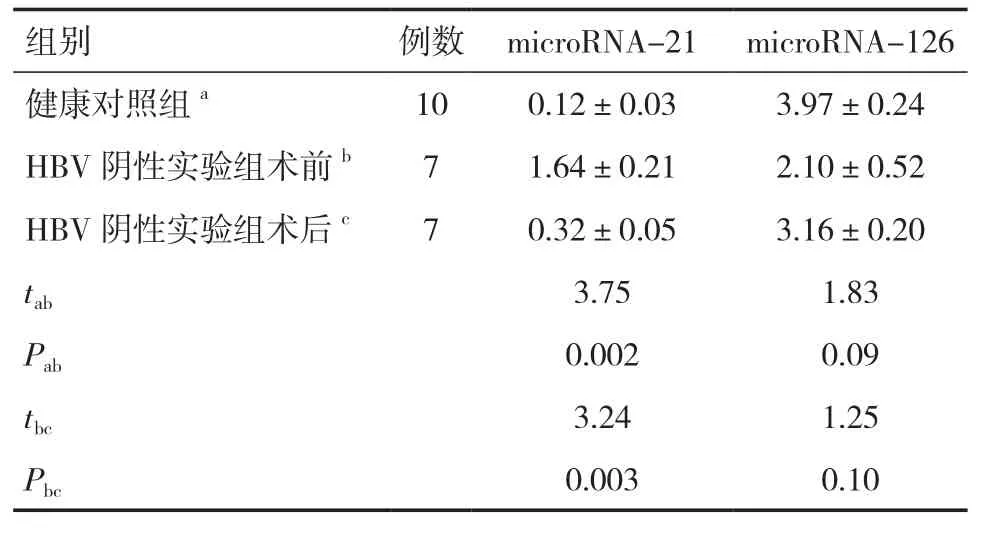
表2 microRNA-21和microRNA-126在HBV阴性实验组与对照组中的表达(±s)
健康对照组a 10 0.12±0.03 3.97±0.24 HBV阴性实验组术前b 7 1.64±0.21 2.10±0.52 HBV阴性实验组术后c 7 0.32±0.05 3.16±0.20 tab 3.75 1.83 Pab 0.002 0.09 tbc 3.24 1.25 Pbc 0.003 0.10
3 讨论
研究发现,血清中的microRNA-21和microRNA-126非常稳定,即使在反复冻融、煮沸以及长期储存等处理环境中也不会发生降解,运用实时荧光定量RT-PCR方法检测分析得到的microRNA-21和microRNA-126表达比较稳定。
microRNA-21不管在HBV阳性实验组还是阴性实验组中术前的表达水平较健康对照组都有明显上调,而术后实验组中microRNA-21的表达水平较术前有明显下调,由此推测,microRNA-21有可能为早期肝癌提供无创诊断依据。本研究还发现,microRNA-21在HBV阳性实验组中的表达水平明显高于HBV阴性实验组,差异具有统计学意义(P<0.05),这是因为microRNA的表达谱在从HBV感染发生到肝细胞癌的演变进程中不断地发生变化,往往在进程的早期这种变化更加明显,所以microRNA-21的表达水平明显上调会发生在HBV感染阶段,推测肝细胞受到HBV感染刺激,主动分泌microRNA-21,导致实验组血清中microRNA-21的表达水平明显上调,且从HBV感染发生到肝细胞癌的演变进程中逐渐升高。希望将来可以增加研究的样本例数、扩大研究范围,采用实时荧光定量RT-PCR方法检测分析microRNA-21,得到microRNA-21的定量标准曲线,确定microRNA-21正常值和异常值表达水平的数学曲线。
本研究表明,microRNA-126在HBV阳性肝癌患者实验组的表达水平较健康对照组有明显下调,而术后其表达水平较术前有明显上调,差异均具有统计学意义(P<0.05)。microRNA-126在HBV阴性实验组术前、术后和健康对照组中的表达水平均无显著差异。有研究发现[13~15],在结直肠癌和乳腺癌中EGFL-7作为microRNA-126的宿主基因,上游启动子存在甲基化现象,这种现象导致microRNA-126的表达水平明显下调,如果去甲基化处理上游启动子,microRNA-126的表达水平将会明显上调,所以我们推测引起microRNA-126表达水平下调的主要原因可能是EGFL-7上游启动子甲基化。
综上所述,在 HBV 阳性实验组血清样本中microRNA-21和microRNA-126的表达存在异常,在HBV阴性肝癌患者实验组血清样本中microRNA-21的表达也有显著性差异,这些研究表明microRNA-21可以作为肝癌早期无创诊断的血清标记物, microRNA-126也可以为HBV阳性肝癌的早期诊断提供依据,而且可以用于评价手术治疗效果,但是microRNA-21和microRNA-126并不具有肝癌血清标记物的特异性,它们能否准确的在肝癌早期作为无创诊断的血清标记物还有待更多试验样本量的证实,尤其是要描绘microRNA-21正常值和异常值表达水平的数学曲线更需要增加研究的样本例数、扩大研究范围。
1 Zhang Y,Huang W,Ran Y,et al.miR-582-5p inhibits proliferation of hepatocellular carcinoma by targeting CDK1 and AKT3[J].Tumour Biol,2015,36(11):8309-8316
2 Yuan Q,Loya K,Rani B,et al.MicroRNA-221 overexpression accelerates hepatocyte proliferation during liver regeneration[J].Hepatology,2013,57(1):299-310
3 Zhou L,Yang ZX,Song WJ,et al.MicroRNA-21 regulates the migration and invasion of a stem-like population in hepatocellular carcinoma[J].Int J Oncol,2013,43(2):661-669
4 Hu C,Shen SQ,Cui ZH,et al.Effect of microRNA-1 on hepatocellular carcinoma tumor endothelial cells [J].World J Gastroenterol,2015,21(19):5884-5892
5 Fang F,Chang RM,Yu L,et al. MicroRNA-188-5p suppresses tumor cell proliferation and metastasis by directly targeting FGF5 in hepatocellular carcinoma[J].J Hepatol,2015,63(4):874-885
6 王以浪,王亚非,张亮,等.肝细胞癌患者TACE术前后血清miR-21表达变化及临床意义 [J].介入放射学杂志,2014,23(5):406-410
7 郝清亚,王以浪,姚登福,等.肝癌患者血清microRNA-21水平变化 [J].实用肝脏病杂志,2014,17(1):68-70
8 侯晋,曹雪涛.MicroRNA与肝癌诊治:新的机遇和挑战[J].中国肿瘤生物治疗杂志,2015,22(1):1-7
9 陈胜,王亮,曹爽,等.外周血中microRNA用于肝癌诊断的研究进展 [J].国际消化病杂志,2014,34(6):389-391
10 李梦萍,曹海明,武哲丽,等.原发性肝癌不同血瘀证患者肝组织微小RNA表达差异的初步研究[J].山东医药,2014,54(38):1-4
11 罗兰云.microRNA-122抑制肝肿瘤细胞HepG2的增殖研究[J].胃肠病学和肝病学杂志,2016,8(12):1467-1470
12 叶军.MicroRNA-122在肝细胞癌调控机制中的研究进展[J].现代预防医学,2014,41(15):2811-2813
13 牛强,吕伟,赵玮,等.肝硬化患者血清MicroRNA-122含量与分级关系 [J].中华临床医师杂志(电子版),2015,9(22):4120-4123
14 樊丽萍,陈建杰,凌琪华,等.MicroRNA-122与肝脏疾病[J].实用肝脏病杂志,2013,16(1):85-87
15 许文龙,李祥云.microRNA-122在脂肪肝患者血清中的变化[J].中国卫生检验杂志,2015,25(21):3653-3655

