有机相脂肪酶催化合成山梨酸乙酯的研究
,, ,
(1.浙江工业大学 生物工程学院,浙江 杭州 310014;2.浙江省生物有机合成技术研究重点实验室,浙江 杭州 310014)
山梨酸乙酯是一类新型的山梨酸衍生物,是一种国际公认的低毒高效食品防腐剂,也是一种重要的农药增效剂[1].目前山梨酸乙酯的合成主要是化学合成法.汤健[2]报道了一种仿自然衍生法制取山梨酸乙酯原液,制备工艺较繁琐,山梨酸乙酯得率为85%.邓继勇等[3]研究了以氯化亚锡水合物为催化剂催化山梨酸乙酯的合成,山梨酸乙酯的分离处理复杂.梁红冬等[4]报道了一种山梨酸乙酯的合成方法,反应在110 ℃温度条件下进行,存在较大安全隐患.因此化学法合成反应条件苛刻,存在副反应多、设备腐蚀严重和后处理复杂等缺点.酶催化法[5]利用酶对催化反应的高度专一性,具有反应条件温和、节能环保和催化效率高等优点,已显示出巨大的发展潜力和广阔的应用前景.
脂肪酶(EC 3.1.1.3)又称甘油酯水解酶,是一类特殊的酯键水解酶,能够催化酯化、酯水解、醇解和转酯化等多种反应[6-8],在油水界面可催化脂肪分解为甘油和脂肪酸,在非水介质中则催化甘油和脂肪酸合成脂肪[9-10].脂肪酶具有界面活化现象,在油水界面的催化活性会得到显著提高.在脂肪酶催化体系中,除了参与反应的酶和底物外,反应介质也有影响[9].与传统的水相酶催化相比,在近乎无水的有机相中的酶催化反应,脂肪酶表现出优异的催化作用.笔者首次利用脂肪酶催化山梨酸和乙醇合成山梨酸乙酯,对该催化反应的影响因素进行了系统的优化研究.
1 材料与方法
1.1 材料与仪器
固定化CandidaanatarcticB脂肪酶(Novozym 435)、固定化Rhizomucormiehei脂肪酶(Lipase RM IM)和Thermomyceslanuginosus脂肪酶(Lipase TL IM)购于丹麦Novo Nordisk公司;Asperillusniger脂肪酶(A.nigerLipase)、Pseudomonasfauore脂肪酶(Lipase AK)、固定化Burkholderiacepacia脂肪酶(Lipase PS IM)购于日本Amano公司;Aspergillusoryzae脂肪酶(A.oryzaeLipase)中国典型培养物保藏中心M206105;Penicilliumexpansum脂肪酶(P.expansumLipase)购自深圳绿微康生物工程有限公司;山梨酸由宁波王龙科技股份有限公司赠送;山梨酸乙酯购于阿拉丁试剂(上海)有限公司;4A分子筛、无水乙醇、正己烷、乙酸乙酯等化学试剂均为分析纯,国药集团化学试剂有限公司.
台式恒温水浴摇床(M1248-0003,美国NBS公司);气相色谱仪(Agilent 6890N,美国安捷伦科技公司);电子分析天平(PB203-N,上海世义精密仪器有限公司).
1.2 实验方法
1.2.1 山梨酸乙酯的合成
在25 mL具塞反应瓶中,将1.0 mmol乙醇和0.5 mmol山梨酸溶解于5 mL有机溶剂中,混匀后加入50 mg脂肪酶粉.在摇床上以150 r/min转速,37 ℃反应10 h后取出部分样品进行检测.其反应式为

1.2.2 反应过程的色谱分析
酶催化反应过程通过气相色谱仪分析.取反应液100 μL,用环己烷稀释至测定范围进行分析,色谱柱HP-5(30 m×0.32 mm,0.25 μm)、载气(N2)流速2.0 mL/min;进样口温度220 ℃,分流比20∶1;柱箱温度120 ℃,恒温保持2 min,以10 ℃/min 的速率上升到150 ℃,恒温保持6 min.采用氢离子火焰检测器,检测器温度250 ℃;山梨酸乙酯保留时间为4.1 min.
1.2.3 反应得率的测定
山梨酸乙酯摩尔分数测定后,算出其摩尔浓度.反应得率=(山梨酸乙酯摩尔浓度/山梨酸初始摩尔浓度)×100%.
1.2.4 产物的质谱分析方法
GC-MS分析条件(Agilent 7890N/5975C):气相色谱柱型号HP-5 MS,进样口温度250 ℃;进样量1 μL;分流比50∶1;柱流速1 mL/min;柱温箱温度100 ℃保留3 min,10 ℃/min升温至200 ℃保留5 min;辅助加热区温度250 ℃;MS四极杆温度150 ℃,离子源温度230 ℃.EI+轰击源,全扫描模式扫描,扫描质量范围30~500 amu,发射电流200 μA,电子能量70 eV.
2 结果与分析
2.1 脂肪酶的筛选
笔者考察了Novozym 435,Lipase RM IM,Lipase TL IM,Lipase AK,A.nigerLipase,P.expansumLipase,A.oryzaeLipase和Lipase PS IM脂肪酶等8 种不同来源脂肪酶对该反应的催化效果,结果见表1.根据表1中数据可以看出:Novozym 435脂肪酶具有催化合成山梨酸乙酯活力,转化率达到8.7%,因此确定山梨酸乙酯合成反应催化剂为Novozym 435.

表1 脂肪酶催化反应的筛选Table 1 Screening of lipase for the synthesis of ethyl sorbate
2.2 有机溶剂的影响
有机溶剂作为反应介质对底物的相对溶解度、酶的催化活性和稳定性有一定的影响,而酶的催化活性与溶剂的疏水性大小(logP)有很大关系[11].在一定程度上可以作为溶剂极性的定量表达,logP值越高,溶剂的疏水性越强,对酶催化的影响也越小[12].为了确定反应的最适反应介质,以Novozym 435脂肪酶催化反应,分别以环己烷、异辛烷、叔丁醇、甲基叔丁基醚、1,4-二氧六环、甲苯和二氯甲烷作为反应溶剂进行考察,它们的疏水性如表2所示(有机溶剂在25 ℃时的logP值数据来源于SciFinder Scholar).有机溶剂对酶催化反应的影响如图1所示,可得出Novozym 435在叔丁醇、环己烷和异辛烷有机溶剂中催化活性较高,表明酶催化活性与溶剂疏水性参数logP有一定相关性,但并无必然关联.其中叔丁醇中得率最高,故选取叔丁醇作为反应溶剂做下一步实验.

表2 有机溶剂及其logP值Table 2 Organic solvents and their logP

1—环已烷;2—异辛烷;3—叔丁醇;4—甲基叔丁基醚;5—1, 4-二氧六环;6—甲苯;7—二氯甲烷图1 不同有机溶剂对酶催化反应的影响Fig.1 Effect of various solvents on the enzymatic catalytic reaction
2.3 底物摩尔比对酶催化反应的影响
通过控制反应底物的摩尔比,可以改变反应速率来缩短反应所需时间,且降低下游提取工艺难度[13-14].脂肪酶催化的酯化反应为可逆反应,过多的乙醇加入使体系的山梨酸和脂肪酶浓度降低[15],从而降低山梨酸乙酯的得率,因此有必要通过对几种不同底物摩尔比进行比较来确定最佳底物摩尔浓度比例.在叔丁醇反应体系中,以Novozym 435脂肪酶催化反应,用不同底物浓度比例反应的结果如图2所示,在n(乙醇)∶n(山梨酸)<5∶1时,山梨酸乙酯的得率随着比例的提高而升高,当底物摩尔比为5∶1时,转化率达到最大为46.3%,故选用5∶1的比例进行下一步实验.

图2 底物摩尔比对酶催化反应的影响Fig.2 Effect of substrate molar ratio on the enzymatic catalytic reaction
2.4 分子筛种类对酶催化反应的影响
在脂肪酶的酯化反应过程中,反应体系中的含水量会直接影响反应速率及反应平衡.水是维持脂肪酶活力的必需物质,含水量过低会降低酶的催化活性,含水量过高则破坏反应化学平衡,抑制反应平衡向产物方向移动[16-17],从而降低得率.因此反应体系中适宜的含水量对脂肪酶的催化反应中提高底物的转化率具有重要的意义.本实验叔丁醇反应体系中,以Novozym 435脂肪酶催化反应,n(乙醇)∶n(山梨酸)=5∶1,通过在反应体系中加入不同种类及不同浓度的分子筛来改变反应体系中的水分[18],以考察含水量对山梨酸乙酯得率的影响,结果如图3所示.结果表明:当反应体系中加入4A分子筛及添加比例为1∶10时,山梨酸乙酯得率最大为79.6%.
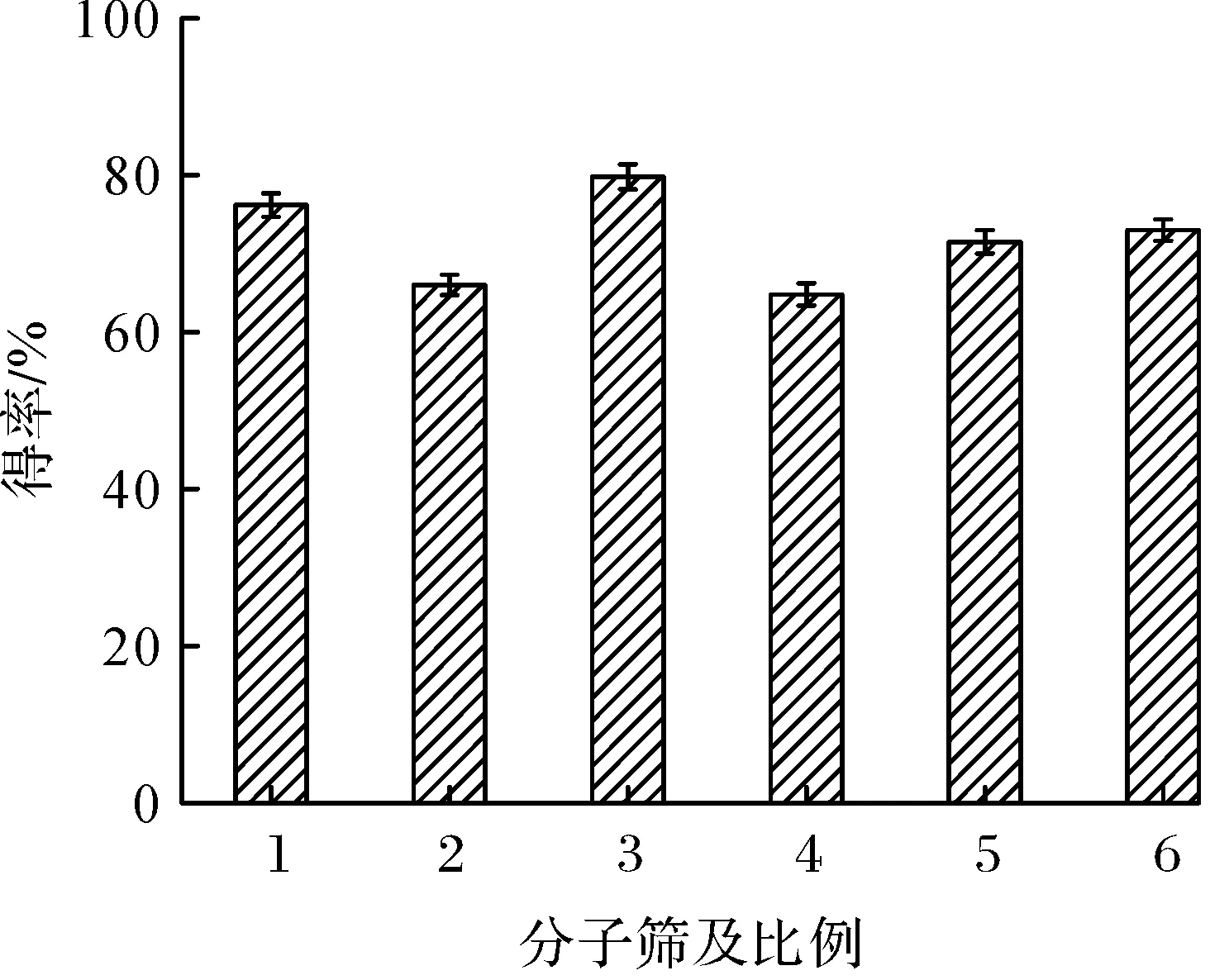
1—4A 1∶5;2—5A 1∶5;3—4A 1∶10;4—5A 1∶10; 5—4A 1∶15;6—5A 1∶15图3 分子筛种类对酶催化反应的影响Fig.3 Effect of zeolite on the enzymatic catalytic reaction
2.5 反应温度对酶催化反应的影响
酶反应动力学得出温度升高,反应速度加快[19].但过高的温度会破坏酶的三级结构,进而降低反应速率,同时温度的改变对于有机溶剂黏度的影响也会影响转化率.因此最优反应温度的考察就显得十分必要.在叔丁醇反应体系中,利用Novozym 435脂肪酶催化反应,n(乙醇)∶n(山梨酸)=5∶1,添加4A分子筛比例为1∶10,不同温度条件进行酶催化反应的结果如图4所示.转化率随温度的升高而升高,但超过60 ℃后,酶蛋白在高温下逐渐失活,影响了催化反应,导致底物转化率降低.因此最佳反应温度选择为60 ℃,此时山梨酸乙酯得率可达97.4%.
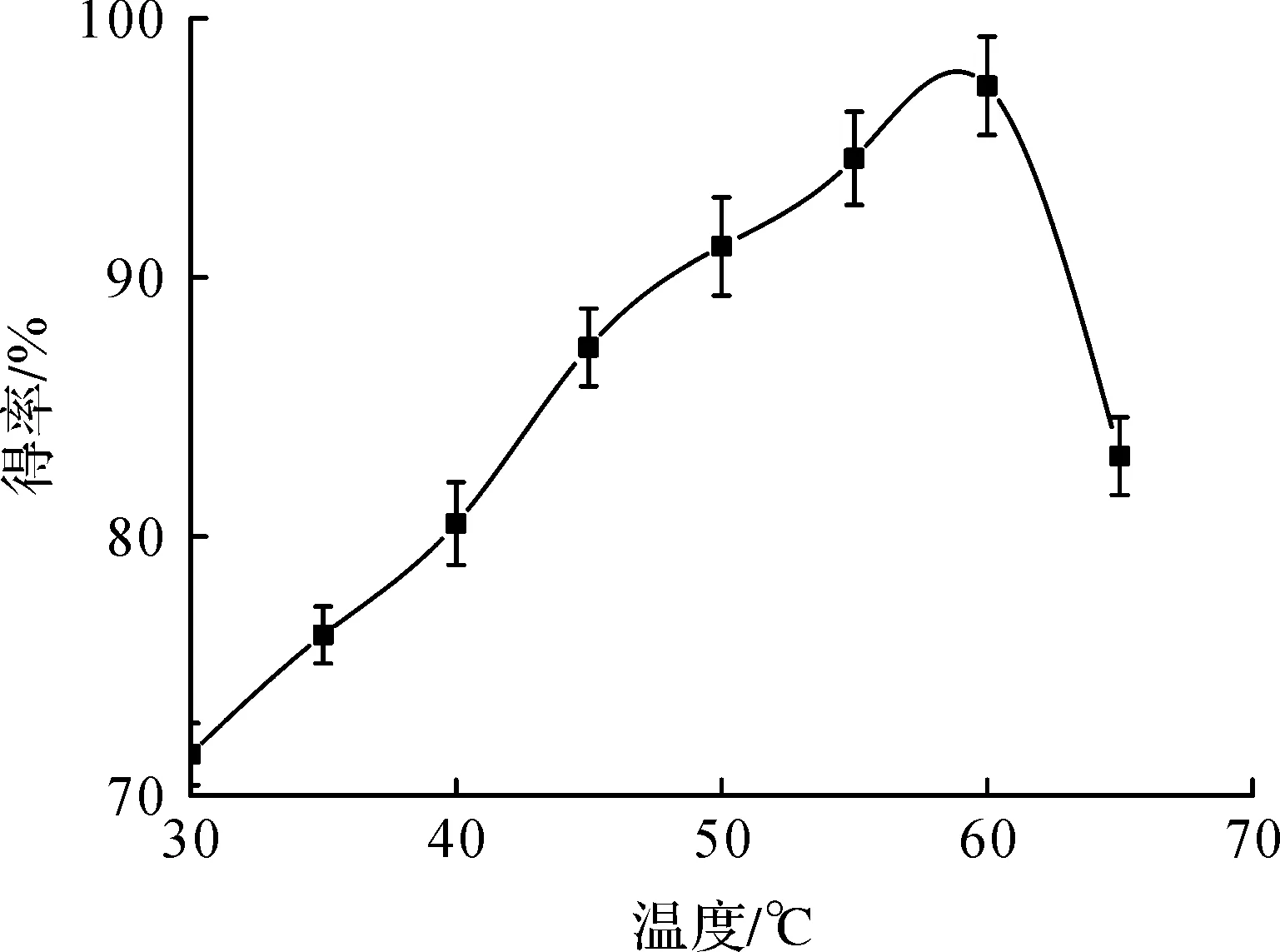
图4 反应温度对酶催化反应的影响Fig.4 Effect of reaction temperature on the enzymatic catalytic reaction
2.6 酶催化反应的时间曲线
在以上最佳单因素优化后的条件下进行酶催化试验,不同反应时间后取样检测山梨酸乙酯,比较山梨酸乙酯得率,结果见图5.由图5得出:随酶催化时间的增长,反应得率不断升高,当酶催化反应进行10 h后,反应得率增加减缓,可能由于反应过程中产物的山梨酸乙酯大量积累后水解速率增加,导致酯化反应和水解反应达到平衡.因此,该酶催化反应选择反应时间为10 h,此时得率可达97.4%.

图5 酶催化反应的时间曲线Fig.5 Time course of enzyme-catalyzed reaction
2.7 产物的表征结果分析
酶催化反应合成得到的山梨酸乙酯利用气相色谱-质谱联用仪分析,得到产物的气相质谱图(图6).根据质谱图推测该产物为山梨酸乙酯,其中m/z=140.1为山梨酸乙酯的分子离子峰.
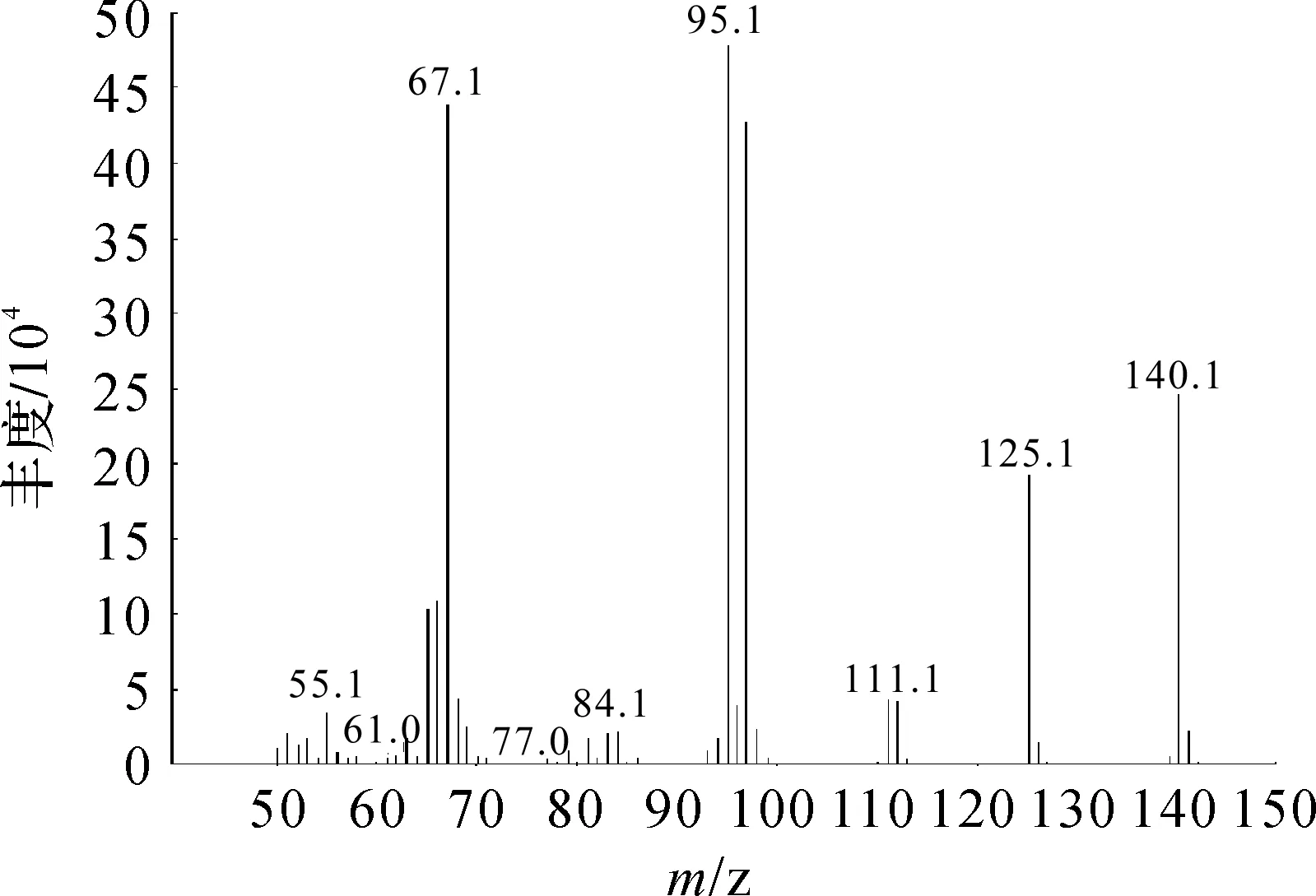
图6 山梨酸乙酯的GC-MS质谱图Fig.6 Mass spectrometry of ethyl sorbate
3 结 论
利用脂肪酶催化以山梨酸和乙醇为原料合成了重要的低毒高效食品防腐剂山梨酸乙酯,通过单因素试验对该催化反应的影响因素(反应溶剂、温度和底物摩尔比等)进行了系统的优化研究,确定了最佳合成工艺条件:脂肪酶Novozym 435作为催化剂,叔丁醇为反应溶剂,n(乙醇)∶n(山梨酸)=5∶1,吸水剂4A分子筛添加量10%,反应温度60 ℃,当反应10 h后山梨酸乙酯得率可达到97.4%,产物经气相质谱(GC/MS)结构鉴定.构建了一条酶法合成山梨酸乙酯的绿色工艺路线,为进一步商业化开发和绿色生产山梨酸乙酯提供良好的理论和实践基础.
参考文献:
[1] 何建真,王健燕,陈竞宇.山梨酸乙酯制备方法及其应用[J].广西化工,1998,27(2):30-32.
[2] 汤健.山梨酸乙酯原液的生产方法:中国,99112561.4[P].2001-05-23.
[3] 邓继勇,周原,王焕龙.山梨酸乙酯的非酸催化合成[J].广西化工,2000,29(3):7-10.
[4] 梁红冬,陈建,范伟婷.山梨酸乙酯的合成研究[J].广东石油化工学院学报,2013,23(1):67-72.
[5] 段章群,杜伟,刘德华.生物酶法制备1,3-甘油二酯[J].化学进展,2009,21(9):1939-1944.
[6] KRETZA E, PAPANEOPHYTOU C, PAPI R, et al. Lipase activity inThermusthermophilusHB8: purification and characterization of the extracellular enzyme[J]. Biotechnology and bioprocess engineering,2012,34(17):512-525.
[7] 马玲芝,钱俊青.离子交换树脂固定化脂肪酶催化合成蔗糖乙酯[J].浙江工业大学学报,2012,40(1):21-24.
[8] 钱俊青,蒋盛蓝,秦德怀,等.214型离子交换树脂固定化假丝酵母脂肪酶的研究[J].浙江工业大学学报,2013,41(3):244-247.
[9] ZAKS A, KLIBANOV M. Enzyme catalyzed processes in organic media at 100 ℃[J]. Abstracts of papers of the American chemical society,1984,81(188):1249-1251.
[10] SALWA KARBOUNE, MOHAMMAD SAFARI, BENA-MARIE LUE, et al. Lipase-catalyzed biosynthesis of cinnamoylated lipids in a selected organic solvent medium[J]. Journal of biotechnology,2005,119(156):281-290.
[11] 彭立凤.有机溶剂对酶催化活性和选择性的影响[J].化学进展,2000,12(3):103-105.
[12] 姚侠,郑建永,应向贤,等.有机相脂肪酶催化合成乙酸肉桂酯[J].生物加工过程,2012,10(3):12-16.
[13] 杜理华,徐亮亮,成柄灼.一种脂肪酶催化柚皮苷酯化反应的研究[J].浙江工业大学学报,2014,42(6):627-631.
[14] 黄志良,战宇,宁正祥,等.山梨酸酯的合成与抗菌作用研究[J].华南农业大学学报,2002,23(3):84-86.
[15] 黄小华,胡益民,王修然.山梨酸乙酯的制备[J].安微机电学院学报,1999,14(4):19-22.
[16] 王召贺,张云,孙爱君,等.一种深海微生物脂肪酶在非水介质中催化合成乙酸肉桂酯的应用研究[J].食品工业科技,2016,9(1):202-206.
[17] 孙平,卜庆珍,唐小华,等.脂肪酶催化麦芽糖硬脂酸酯合成的研究[J].中国食品添加剂,2009(2):108-111.
[18] 王晓梅,张建荣.分子筛脱除碳酸酯中微量水的应用研究[J].河北化工,2012,35(10):78-80.
[19] 闫倩云,李玲玲,丛方地,等.固定化脂肪酶生物反应器催化合成乙酸正己酯[J].食品工业科技,2015,36(9):171-174.

