检测鸡TRIM25蛋白的免疫组化方法
禇 颖,马文杰,胡卫国,陈 茹,邱建华,郭慧君,李宏梅
(山东农业大学动物科技学院,山东省动物生物工程与疾病防治重点实验室,山东省畜禽疫病防制工程技术研究中心,泰安 271018)
TRIM25是TRIM(Tripartite motif)蛋白家族中的成员,从属于 C-Ⅳ亚家族[1]。该蛋白N端具有TRIM蛋白家族典型的RING、B-box、Coiled-coil(RBBC)结构域,C端还有一个PRY/SPRY结构域。该蛋白质的RING 结构域是一个富含半胱氨酸的保守结构域,具有泛素连接酶的特性,可以把线性化或多聚化的泛素分子转移到靶蛋白上,调节靶蛋白的生物活性[2];C端的PRY/SPRY结构域是一段具有很大柔性的结构域,可以与靶蛋白结合,并使之发生泛素化[3]。
TRIM25蛋白有两个重要的作用备受关注,一是通过泛素化细胞生长抑制因子14-3-3δ使其降解而促进细胞增殖,促进肿瘤的发生[4];二是参与机体的先天性抗RNA病毒反应[1]。一些研究表明,TRIM25的过表达能抑制人艾滋病毒(HIV-1)、鼠白血病病毒(MLV)、禽白血病病毒(ALV)和B型乙肝病毒等RNA病毒在细胞内的复制[5-6]。另外,一些RNA病毒利用TRIM25蛋白可以抑制抗病毒因子的产生,进而产生免疫逃避,如A型禽流感病毒(AIV)利用其自身的非结构蛋白(NS1)可以结合TRIM25,并抑制视黄酸诱导基因蛋白(RIG-I)依赖的Ⅰ型抗病毒因子的产生,为 AIV-A宿主细胞内复制和宿主间传播感染提供了条件[7-8]。更值得关注的是,已有研究报道以TRIM25为靶点对Ⅰ型干扰素抗病毒反应进行人工控制,用于一些RNA病毒的防治[9]。
Z. Q. Feng等2015年首次报道了鸡TRIM25全基因,比较发现与人和小鼠的TRIM25相似性分别仅为在47.6%和45.7%,荧光定量检测发现在鸡免疫组织(如胸腺、法氏囊)和肺等含量较高[10]。然而,对于鸡TRIM25蛋白的组织分布、生物学功能及作用机制了解还很少。本研究旨在克隆鸡TRIM25抗原基因,构建重组原核表达质粒,获得鸡TRIM25蛋白,制备抗鸡TRIM25的多克隆抗体,建立检测其表达的免疫组化方法,为研究鸡TRIM25蛋白生物学特性、组织分布和抗病毒机制提供物质基础和方法依据。
1 材料与方法
1.1 实验动物和其他实验材料
BALB/c小鼠购自山东大学实验动物中心;兔购自泰安市岱岳区范镇贵合畜禽养殖场。Trans-1、BL21、pEASY-Blunt E1表达载体购自全式金有限公司。HRP酶标二抗购自博奥森生物有限公司;Bradford蛋白浓度测定试剂盒、超纯RNA提取试剂盒和FastQuant cDNA第一链合成试剂盒均购自北京天根生化科技有限公司;TME单组份底物显色液购自北京索莱宝生物科技有限公司;质粒抽提试剂盒、PCR产物纯化试剂盒购自OMEGA公司;弗氏佐剂购自Sigma公司。
1.2 方法
1.2.1 引物的设计与合成 根据已发表的TRIM25基因序列(GenBank:KM879874.1)设计引物,对保守序列的TRIM25的RBBC基因进行扩增。上游引物:5′-CGCGGATCCCATCTGCCTCAGCATCTT-3′ ;下游引物:5′-CCGGAATTCATCCACAGACACATTCACT-3′引物由华大基因有限公司合成。
1.2.2 鸡TRIM25基因的获取 2周龄海兰褐雏鸡脾,剪碎,研磨,按RNA提取试剂盒说明书提取总RNA。按FastQuant cDNA第一链合成试剂盒说明书逆转录,得到cDNA。利用设计合成的引物,以cDNA为模板,按50 μL的扩增体系PCR扩增TRIM25基因。PCR扩增条件:95 ℃ 2 min;95 ℃,20 s;60 ℃,20s ;72 ℃,15 s,循环35次,72 ℃ 5 min。1.5%琼脂糖凝胶电泳鉴定扩增结果。
1.2.3 克隆载体的构建与鉴定 PCR产物经胶回收试剂盒纯化后与pMD18-T simple载体连接,得到重组连接载体,命名为:pMD18-T-TRIM25;并转化至Trans1-T1感受态细胞,挑取菌落,接种于LB液体培养基(50 μg·mL-1Amp+),37 ℃振摇12 h,用DNA质粒试剂盒提取重组质粒,BamHⅠ和EcoRⅠ双酶切鉴定重组质粒,并测序比对基因序列。
用pEASY-Blunt E1表达质粒与目的基因构建重组表达质粒,命名为pEASY-Blunt E1-TRIM25,按说明用目的基因正向引物和T7 Terminator 引物PCR扩增鉴定阳性克隆。1.5%琼脂糖凝胶电泳鉴定结果,并测序分析。
1.2.4 鸡TRIM25蛋白的表达、纯化及鉴定 将含目的基因的阳性菌接种于含氨苄的LB固体培养基上,37 ℃培养8~10 h;次日挑取单菌落接种于含氨苄的LB液体培养基中,37 ℃振荡过夜培养;按1∶100比例转种于500 mL液体培养基;培养至OD600 nm约为0.6,加入1 mmol·L-1的IPTG,振摇培养4 h,取培养液SDS蛋白电泳分析蛋白表达结果。用抗His标签蛋白的单克隆抗体通过Western blot方法鉴定目的蛋白质。
按照说明,用蛋白质纯化柱纯化His-TRIM25重组蛋白,通过SDS蛋白电泳分析纯化效果;用BCA蛋白质定量试剂盒测定纯化后的TRIM25蛋白的浓度。
1.2.5 血清抗体的制备 4只2月龄新西兰兔和16只6周龄BALB/c小鼠,取血清保存作为阴性对照。将纯化的重组TRIM25蛋白与弗氏佐剂乳化后背部皮下多点注射兔(兔每只200 μg蛋白抗原;鼠每只100 μg蛋白抗原),间隔2周加强免疫2次,最后一次免疫2周采集抗血清。以间接ELISA方法检测抗体效价。
1.2.6 血清抗体效价检测 参考发表的间接 ELISA法[11]测定抗体效价。用纯化的TRIM25重组蛋白质作包被抗原,封闭,加入稀释的兔、鼠血清孵育,分别加入相应的酶标羊抗兔和羊抗鼠的二抗,显色。用酶标仪在OD450 nm时检测吸光度值。判定标准:阳性对照、阳性血清OD450 nm值>1.0,阴性血清与阴性对照的OD450 nm值<0.2,检测样品OD450 nm值>0.2,S/N>2.1时,达到此标准的血清的最大稀释倍数为其抗体效价。
1.2.7 鸡TRIM25蛋白抗体介导的免疫组化方法建立 将青年海兰褐鸡肺、脾和肝样品进行常规石蜡包埋,制作连续切片厚度为5 μm,相邻切片分为2套,贴于玻片上。按常规步骤建立检测组织TRIM25表达的免疫组化方法,阴性对照用未免疫兔血清代替一抗,显微镜观察并拍照。
2 结 果
2.1 TRIM25基因的克隆与表达
利用设计的引物对TRIM25基因进行扩增,凝胶电泳结果显示(图1)所提取的基因大小1 012 bp左右,这与TRIM25的功能结构域RING、B-box和Coiled-coil包含的基因序列大小基本一致,测序结果显示该基因与发表的鸡TRIM25基因相应序列是一致的,表明目的基因克隆成功。
2.2 重组质粒的构建与鉴定
利用BamHⅠ和EcoRⅠ酶对构建的重组pMD18-T-TRIM25质粒进行鉴定,核酸电泳得到预期大小的两条电泳条带,其中含TRIM25目的基因条带(图2)。用TRIM25目的基因正向引物和T7 Terminator 引物对构建的表达质粒pEASY-Blunt E1-TRIM25进行PCR扩增鉴定,核酸电泳获得预期基因片段,结果见图3,其中包含TRIM25目的基因片段。测序结果显示,重组质粒中插入片段的序列与上述所克隆测序的基因序列完全一致。
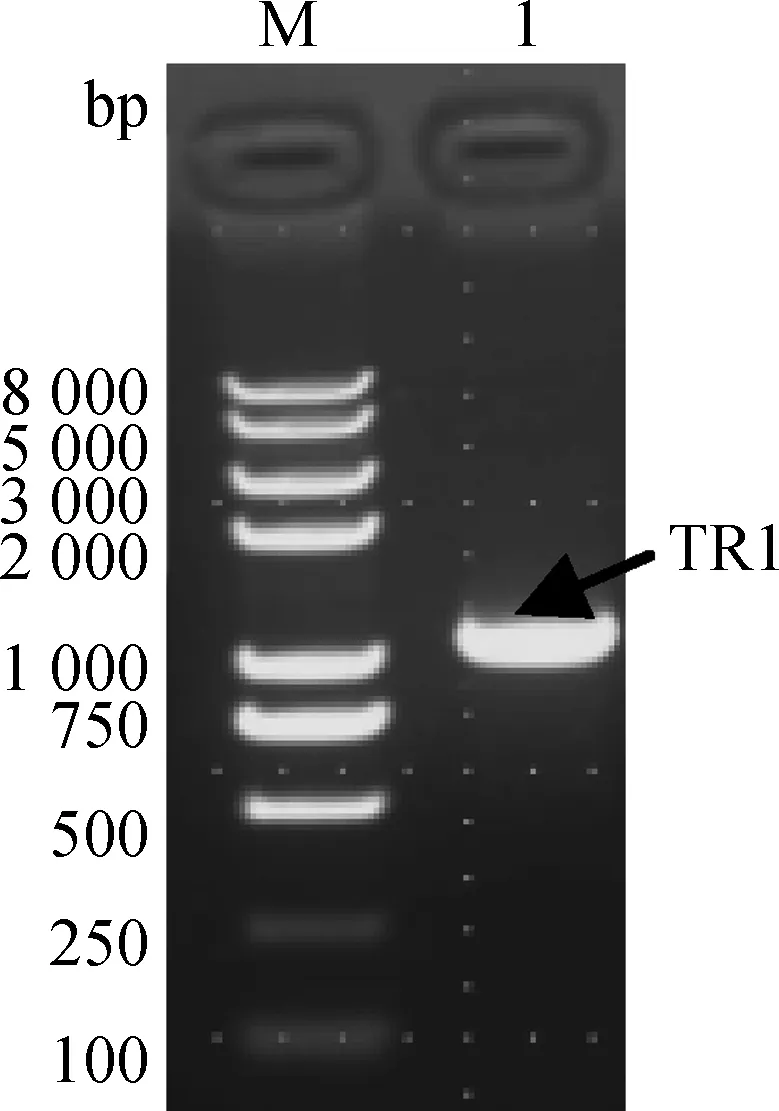
M. DNA 相对分子质量标准; 1.目的基因PCR产物M. DNA marker; 1. Chicken TRIM25 gene图1 鸡TRIM25基因的克隆鉴定Fig.1 Identification of cloned chicken TRIM25 gene
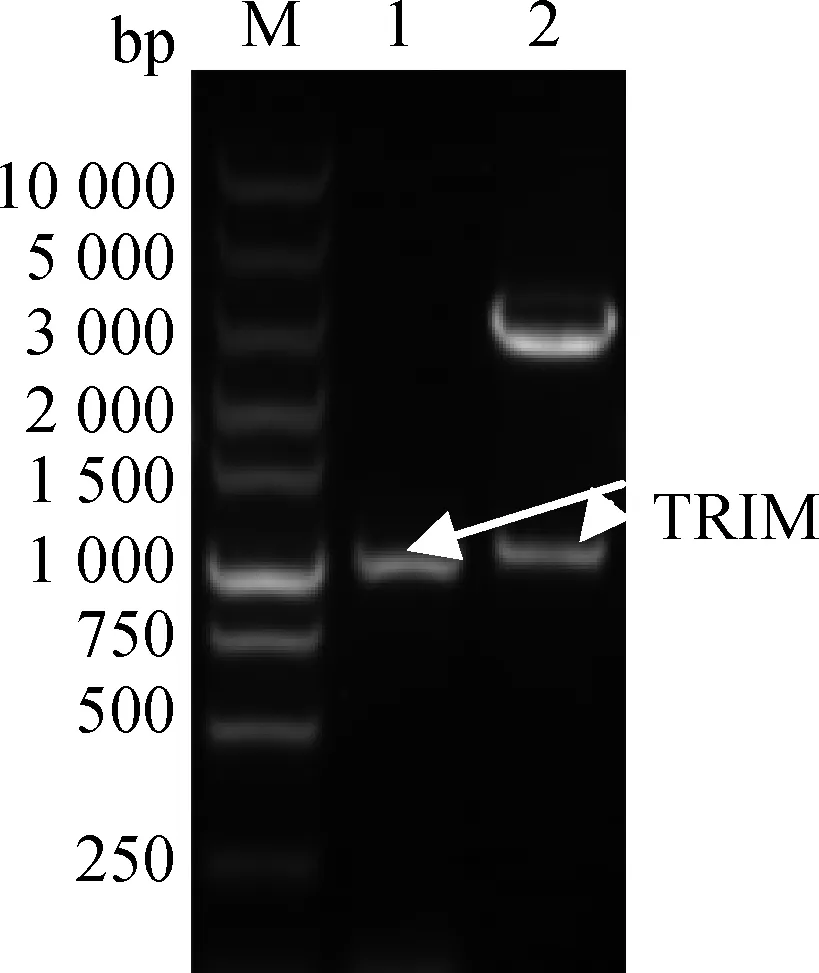
M. DNA 相对分子质量标准; 1.目的基因;2.双酶切结果M. DNA marker; 1. Chicken TRIM25 gene; 2. Gene fragments after being digested图2 重组pMD18-T-TRIM25质粒双酶切鉴定Fig.2 Identification of recombinant plasmid pMD18-T-TRIM25
2.3 TRIM25蛋白的诱导表达、纯化及鉴定
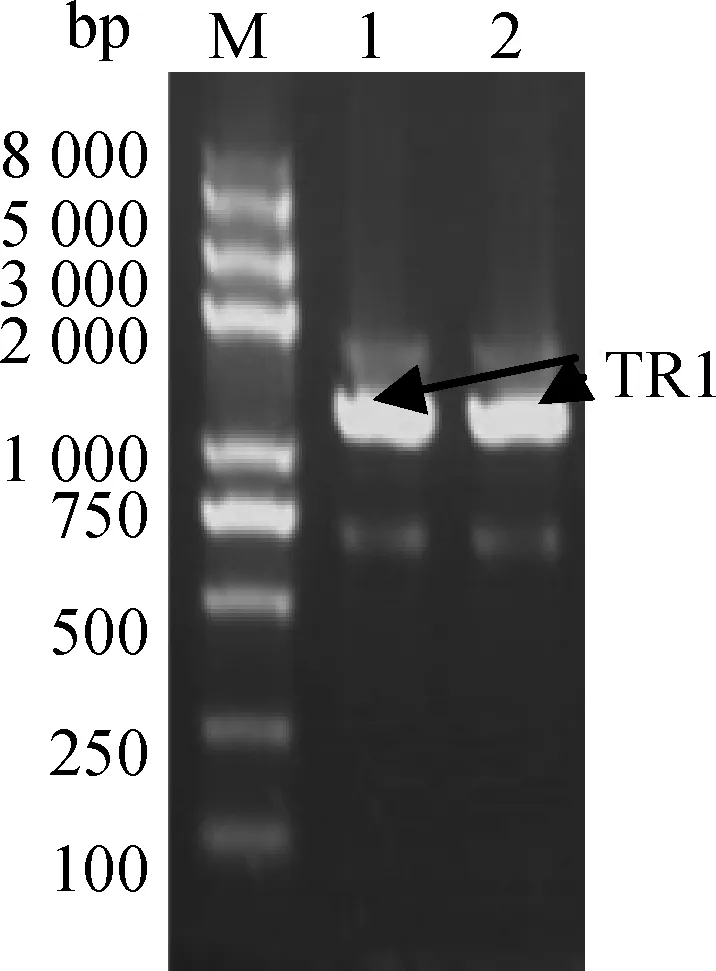
M. DNA 相对分子质量标准; 1和2.目的基因引物和T7 Terminator 引物的PCR产物M. DNA marker; 1 and 2. PCR amplified products with the primers of chicken TRIM25 and T7 Terminator图3 表达质粒pEASY-Blunt E1-TRIM25的鉴定Fig.3 Identification of the expressed plasmid pEASY-Blunt E1-TRIM25
将重组表达质粒转化入表达菌BL21内,1.0 mmol·L-1的IPTG 37 ℃诱导蛋白表达,将表达的蛋白质经SDS-PAGE分析,结果见图4A。图4A中泳道2显示目的蛋白获得大量表达,蛋白大小约48 ku,而未经IPTG诱导的菌体未表达或表达极少的目的蛋白质(泳道1)。对表达的蛋白指标利用His标签蛋白进行纯化,经SDS-PAGE分析可见获得纯化的蛋白质条带,结果见图4B第3泳道蛋白质条带。
2.4 TRIM25蛋白的鉴定
将纯化的蛋白质,以His标签单克隆抗体为一抗,HRP标记的羊抗鼠IgG为二抗,进行Western blot分析,结果见图5。结果显示,所表达的蛋白质可与His标签单抗发生特异性反应,表明所诱导的蛋白质包含预期的TRIM25目的蛋白。
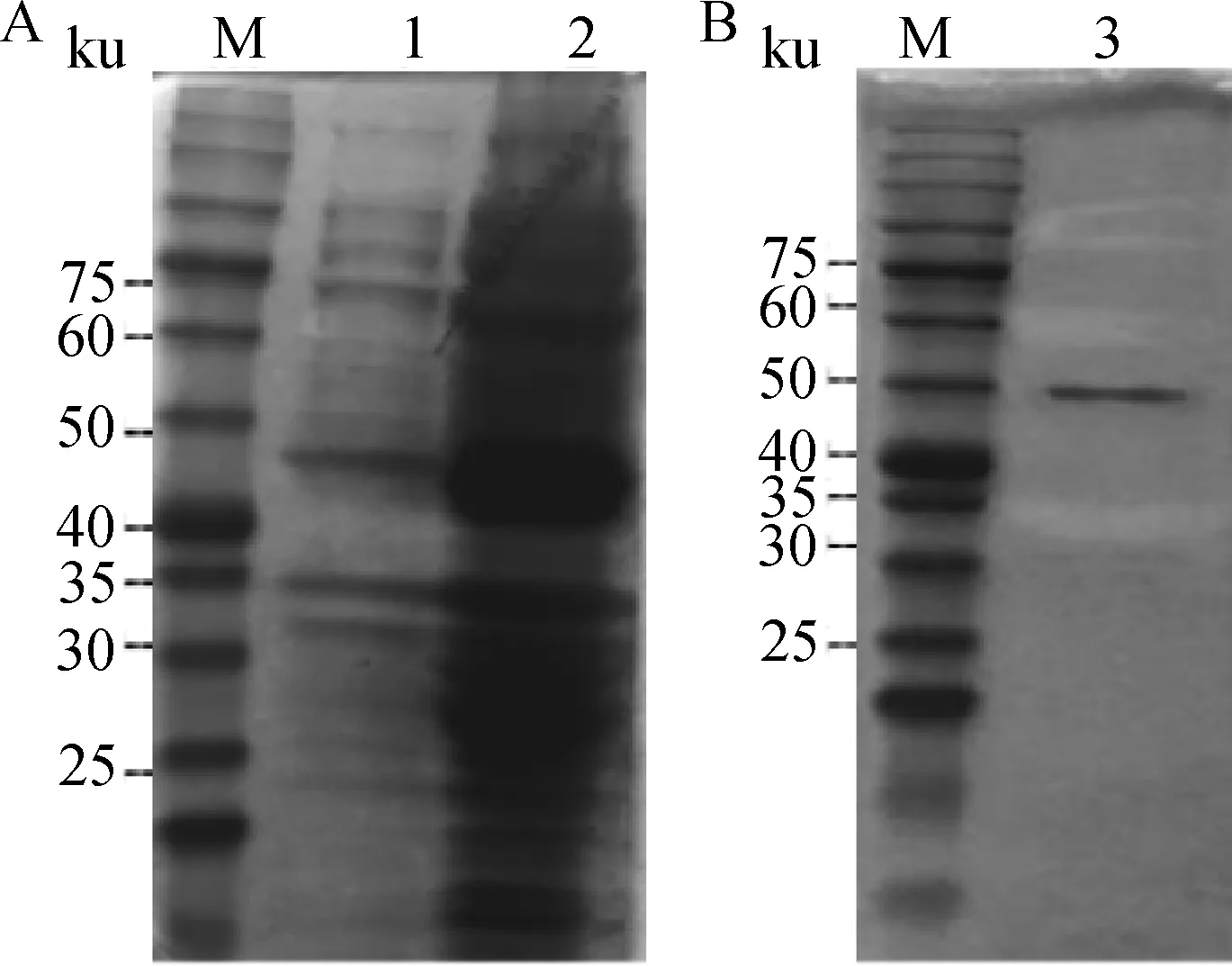
M.蛋白质相对分子质量标准; 1.未经IPTG诱导的菌体裂解物; 2.经IPTG诱导后菌体裂解物; 3.纯化后的TRIM25蛋白M. Protein marker; 1. The expressed products without induction of IPTG; 2. The expressed products with induction of IPTG; 3. The purified products of recombinant chicken TRIM25图4 鸡TRIM25重组蛋白的表达及纯化Fig.4 The expressed and purified products of recombinant chicken TRIM25
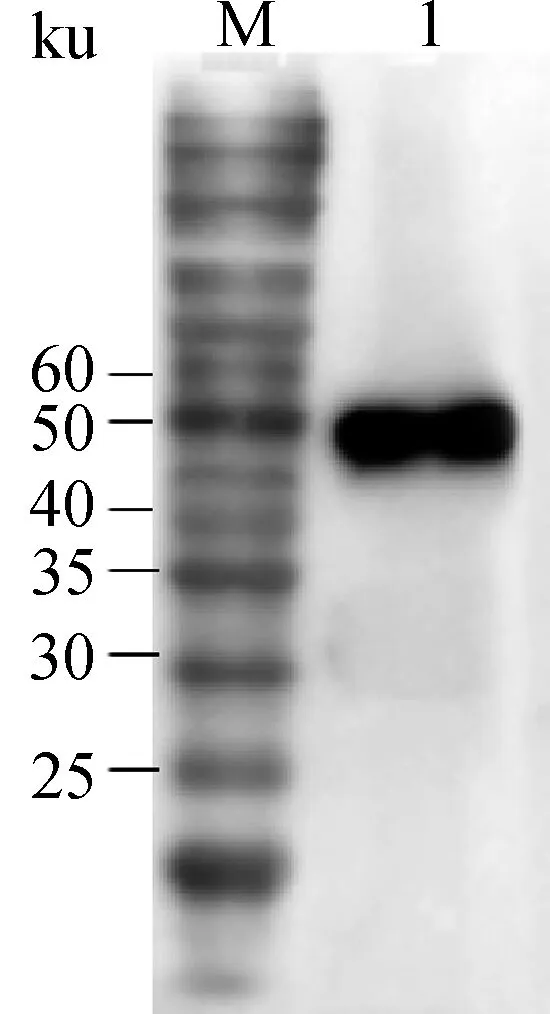
M. 蛋白质相对分子质量标准; 1.His标签单抗介导的Western blot 结果M. Protein marker; 1. Western blot mediated by MAb against His marked protein图5 鸡TRIM25重组蛋白的Western blot鉴定Fig.5 Identification of recombinant chicken TRIM25 with Western blot mediated by His-MAb
2.5 血清抗体效价的测定
将纯化后的TRIM25重组蛋白为免疫原接种兔和BLAB/c小鼠,经三次免疫后,对兔和小鼠血清抗体效价进行检测,结果显示,兔血清中抗体效价达到1∶106以上,鼠血清中抗体效价达到1∶107以上。
2.6 鸡肺、脾和肝组织中TRIM25蛋白的分布检测
使用制备的多克隆抗体建立免疫组化方法,对青年海兰褐鸡肺、脾、肝组织中TRIM25蛋白进行检测。图6结果显示,在鸡肺、脾和肝中细胞内均存在不同程度TRIM25的表达,肺组织中主要出现在三级支气管和肺房以及血管相应组织内(图6A2),高倍镜下显示阳性细胞主要为鸡肺房内皮细胞、周围的淋巴细胞、巨噬细胞以及血管内皮细胞、淋巴细胞的细胞质内(图6A3)。脾组织主要出现在脾髓生发中心脾淋巴细胞和血管内皮细胞、淋巴细胞的细胞质中(图6B2和6B3)。肝组织中肝小叶肝细胞和淋巴细胞以及血管内皮细胞胞质均出现较多表达(图6C2和6C3)。
3 讨 论
TRIM25蛋白是近些年来新发现的一种机体先天性蛋白分子,具有广泛的生物学活性,该蛋白质通过泛素化靶蛋白而参与机体一系列生物反应[12]。比较发现,不同动物的TRIM25蛋白在结构上存在差异,鸡TRIM25蛋白与人和小鼠的同源性相对较低[10],很难用人和鼠的TRIM25蛋白抗体用于鸡TRIM25蛋白的研究。由于缺乏识别鸡TRIM25蛋白的抗体试剂,限制了对鸡TRIM25蛋白进行深入研究。本研究根据已发表的鸡TRIM25蛋白的基因序列,对其抗原指数分析发现在鸡TRIM25的相对保守的功能结构域RING、B-box和Coiled-coil(RBBC结构),大小为1 012 bp的基因片段上具有较高的抗原指数(结果未列出)。根据该结果,设计基因引物从海兰褐鸡脾组织中扩增出目的基因,用该基因构建重组表达质粒,获得鸡TRIM25的蛋白抗原。
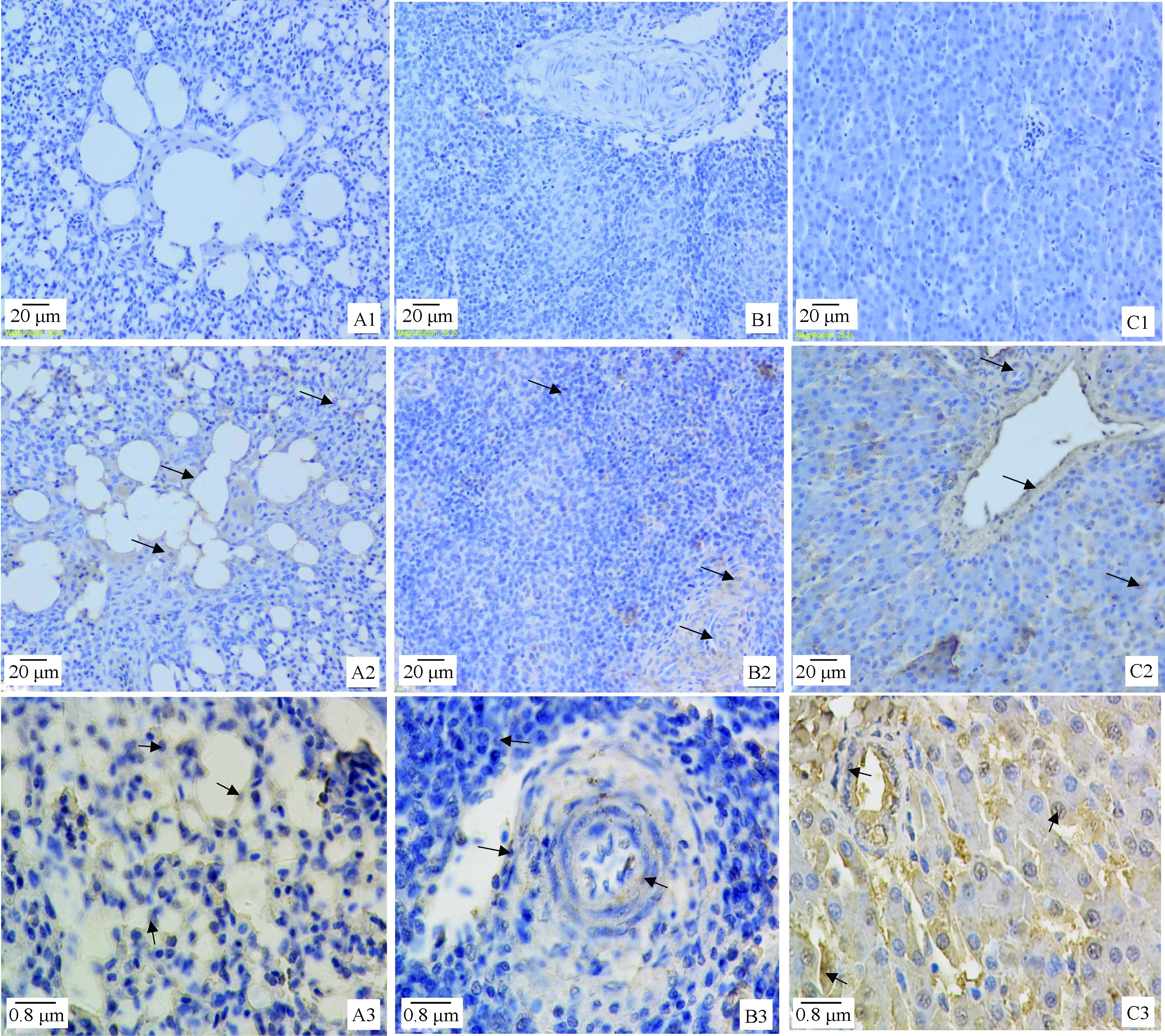
A1, B1, C1分别为无抗体血清处理的肺、脾、肝; A2-A3, B2-B3, C2-C3分别为TRIM25抗体处理的肺、脾、肝; 箭头为鸡TRIM25阳性细胞A1, B1, and C1 are the slices of chickens’ lungs, spleens and livers treated by control sera; A2-A3, B2-B3 and C2-C3 are the slices of chickens’ lungs, spleens and livers treated by TRIM25-antibody sera, respectively; Arrows of line, positive cells to chicken TRIM25图6 兔源鸡TRIM25抗体介导的免疫组化方法对鸡肺、脾、肝组织中TRIM25表达的检测Fig.6 Detection for TRIM25 expression in chicken’s lungs, spleens and livers with Immunohistochemistry method mediated by the prepared rabbit’s antibody
先前大量报道用pET表达载体构建重组表达质粒对目的基因进行诱导表达[13],本研究利用经pET改造的表达质粒pEASY-Blunt E1对目的基因进行连接,构建pEASY-Blunt E1-TRIM25重组表达质粒。由于该质粒利用T7lac启动子严谨调控,N端含有His蛋白纯化标签和氨苄青霉素筛选标记,能够简单、快速、高效地对目的基因进行连接、表达和筛选,同时根据提供的T7 Promoter物或Terminator引物,方便地对构建的重组表达质粒进行验证(通过PCR扩增即可)。另外,该质粒在感受态细胞克隆效率高,筛选效率也大大提高。
对构建的重组表达质粒pEASY-Blunt E1-TRIM25转化至表达菌体内,借鉴我们先前的表达条件[13],用1 mmol·L-1的IPTG进行诱导,对目的基因获得较大量的表达。由于该表达的目的蛋白质存在于菌体的包涵体内,利用超声波破碎法获得游离态的重组蛋白质经His标签蛋白的Ni-纯化层析柱纯化,获得纯度达到95%以上的目的蛋白。蛋白质浓度检测发现能够达到抗原接种要求。
利用该抗原分别接种兔和BALB/c小鼠,目的是能够制备出用于不同研究的识别抗体。由于获得兔源血清抗体数量较多,可用于免疫组化、ELISA包被和免疫印迹分析等,而鼠源的抗体具有效价高、特异性较强,可用于免疫组化和免疫印迹分析。从我们接种后检测血清抗体效价来看,小鼠的血清抗体效价要比兔血清抗体效价高很多,在特异性上几乎没有差异(结果未展示)。
利用制备的兔源血清抗体,建立免疫组化方法,发现制备的血清抗体经1∶200倍稀释、与组织4 ℃过夜孵育效果获得较好的免疫组化显色反应。肺、脾、肝三种组织中检测比较发现,在三种组织均检测出一定数量的阳性细胞,这与Z. Q. Feng等利用荧光定量检测到的结果[10]基本一致。而在本研究中发现这些阳性细胞主要为肺内三级支气管、肺房的上皮细胞、淋巴细胞和血管内皮细胞、淋巴细胞内;脾生发中心的脾淋巴细胞、血管内皮细胞和颗粒细胞;肝小叶的内皮细胞、肝细胞和血窦内皮细胞等,统计发现这些阳性细胞多为免疫细胞(如淋巴细胞、颗粒细胞、巨噬细胞等)以及增殖旺盛的细胞(如上皮细胞和内皮细胞等),这可能与TRIM25的抗感染和介导细胞增殖等作用密切相关。
4 结 论
本研究从海兰褐鸡脾中扩增TRIM25基因,构建重组原核表达质粒,诱导表达鸡TRIM25蛋白,然后获得能够识别鸡TRIM25蛋白,且具有较高效价的兔源和鼠源血清抗体,建立定性检测TRIM25表达的免疫组化方法,初步检测了鸡TRIM25在肺、脾和肝组织中的分布,为深入研究TRIM25蛋白的功能提供了物质基础和方法依据。
参考文献(References):
[1] OZATO K, SHIN D M, CHANG T H, et al. TRIM family proteins and their emerging roles in innate immunity[J].NatRevImmunol, 2008, 8(11): 849-860.
[2] DESHAIES R J, JOAZEIRO C A P. RING domain E3 ubiquitin ligases[J].AnnRevBiochem, 2009, 78: 399-434.
[3] SONG B, GOLD B, O′HUIGIN C, et al. The B30.2(SPRY) domain of the retroviral restriction factor TRIM5α exhibits lineage-specific length and sequence variation in primates[J].JVirol, 2005, 79(10): 6111-6121.
[4] URANO T, SAITO T, TSUKUI T, et al. Efp targets 14-3-3σ for proteolysis and promotes breast tumour growth[J].Nature, 2002, 417(6891): 871-875.
[5] UCHIL P D, QUINLAN B D, CHAN W T, et al. Trim E3 ligases interfere with early and late stages of the retroviral life cycle[J].PLoSPathog, 2008, 4(2): e16.
[6] ZHANG S J, GUO J T, WU J Z, et al. Identification and characterization of multiple TRIM proteins that inhibit hepatitis B virus transcription[J].PLoSOne, 2013, 8(8): e70001.
[7] GACK M U, ALBRECHT R A, URANO T, et al. Influenza A virus NS1 targets the ubiquitin ligase TRIM25 to evade recognition by the host viral RNA sensor RIG-I[J].CellHostMicrobe, 2009, 5(5): 439-449.
[8] RAJSBAUM R, ALBRECHT R A, WANG M K, et al. Species-specific inhibition of RIG-I ubiquitination and IFN induction by the influenza A virus NS1 protein[J].PLoSPathog, 2012, 8(11): e1003059.
[9] INN K S, GACK M U, TOKUNAGA F, et al. Linear ubiquitin assembly complex negatively regulates RIG-I- and TRIM25-mediated type i interferon induction[J].MolCell, 2011, 41(3): 354-365.
[10] FENG Z Q, CHENG Y, YANG H L, et al. Molecular characterization, tissue distribution and expression analysis ofTRIM25 inGallusgallusdomesticus[J].Gene, 2015, 561(1): 138-147.
[11] ZHANG D D, LI H M, ZHANG Z S, et al. Antibody responses induced by recombinant ALV-A gp85 protein vaccine combining with CpG-ODN adjuvant in breeder hens and the protection for their offspring against early infection[J].AntiviralRes, 2015, 116: 20-26.
[12] 刘庆祥. TRIM家族蛋白对I型干扰素信号通路的调控作用[J]. 中山大学研究生学刊: 自然科学、医学版, 2015, 36(4): 42-52.
LIU Q X. Functions of TRIM family proteins in type I interferon signaling pathway[J].JournaloftheGraduatesSunYat-SenUniversity:NaturalSciences,Medicine, 2015, 36(4): 42-52. (in Chinese)
[13] 刘海港, 李宏梅, 王树迎, 等. 山羊β雌激素受体多克隆抗体的制备及免疫组化方法的建立[J]. 畜牧兽医学报, 2013, 44(2): 302-308.
LIU H G, LI H M, WANG S Y, et al. Preparation of polyclonal antibody against goat estrogen receptor β and its application in immunohistochemistry assay[J].ActaVeterinariaetZootechnicaSinica, 2013, 44(2): 302-308. (in Chinese)

