饲粮铜水平对育成期雄性水貂铜元素代谢和血清生化指标的影响
吴学壮,杨 颖,刘汇涛,高秀华,杨福合,戴四发,邢秀梅
(1.安徽科技学院动物科学学院,蚌埠 233100; 2. 中国农业科学院饲料研究所,农业部饲料生物技术重点实验室,北京 100081; 3. 中国农业科学院特产研究所, 长春 130112)
铜是动物机体不可缺少的元素之一。研究表明,铜参与动物体造血功能及铁的代谢,又对生物氧化还原过程、色素沉积和脂类代谢起重要作用[1-3]。铜是铜锌超氧化物歧化酶、酪氨酸酶、铜蓝蛋白、赖氨酰氧化酶、细胞色素氧化酶的重要组成成分。大量动物试验已经明确,随着日粮铜添加量的增加,血清铜浓度在一定范围内随着饲料中铜添加量的增加而升高,铜和锌在动物肠道吸收过程中存在拮抗作用[4],但是日粮铜水平对动物血清铁、锌浓度是否也存在影响,有待进一步进行科学确定。研究表明,铜与血脂代谢存在密切相关,动物日粮添加铜能够影响动物体内脂类代谢,主要表现在日粮添加铜可以降低血浆胆固醇和甘油三酯水平[5-7]。但铜对动物生长调节和脂质代谢调控的机理仍不清楚,有待进一步研究。水貂是严格的肉食性动物,其消化道仅约为其体长的4倍,食物在消化道中停留时间比较短,约2~3 h,育成期水貂生长发育迅速,所以,水貂需要采食高能量、高蛋白的饲料来满足其需要,对微量元素的需要量也较其他动物高[8]。
目前国内外关于饲粮中铜水平对水貂血清生化指标和铜锌铁元素代谢的报道相对较少。水貂铜的营养有待进一步研究。因此,本研究通过饲粮中添加不同水平的铜,探讨其对育成期水貂铜代谢、血清Cu、Zn、Fe含量和血清中蛋白质代谢指标、脂类指标及相关酶活性的影响,旨在揭示铜在水貂体内的营养作用调控机制,为铜在水貂生产中的合理应用提供科学依据。
1 材料与方法
1.1 试验设计与日粮
试验在“农业部长白山野生生物资源重点野外科学观测试验站”的毛皮动物生产基地开展。选取健康、体重相近(60±3)日龄的雄性水貂80只。采用单因素随机试验设计,将80只试验水貂随机分为8个组,每组10个重复,每个重复1只。在基础饲粮中分别添加0 (Control组)、4(Cu4组)、8(Cu8组)、16(Cu16组)、32(Cu32组)、64(Cu64组)、128(Cu128组)和256 mg·kg-1(Cu256组)的铜(以CuSO4·5H2O为铜源)配成8种试验饲粮。试验水貂均单笼(40 cm×40 cm×60 cm)饲养,每日07:30与15:30各饲喂1次,自由采食,自由饮水,常规免疫。试验预试期7 d,正试期45 d。水貂目前没有统一的饲养标准,参照国内近几年水貂营养需要量的研究,配制水貂基础日粮,其组成及营养水平见表1。
1.2 样品采集
消化代谢试验样品采集:消化代谢试验于正试期开始30 d后开始,每组挑选8只体重相近的水貂进行消化代谢试验,水貂消化代谢试验时间为4 d,采用全收粪法。每天收集的尿液中每100 mL加入10 mL的10%硫酸溶液,将试验期间收集的尿液混合均匀后取样,加4滴甲苯用于防腐,保存于-20 ℃备用。每天收集的粪便称重后按鲜重的5%加入10%硫酸溶液,并加少量甲苯防腐,保存于-20 ℃,消化代谢试验结束后,将试验期间收集的粪混合均匀后取样,其中粪样先在80 ℃下杀菌2 h,然后降到65 ℃烘干至恒重,磨碎过40目筛,制成风干样本,以备实验室分析。
表1基础日粮组成及营养水平(干物质基础)
Table1Compositionandnutrientlevelsofbasaldiet(DMbasis) %
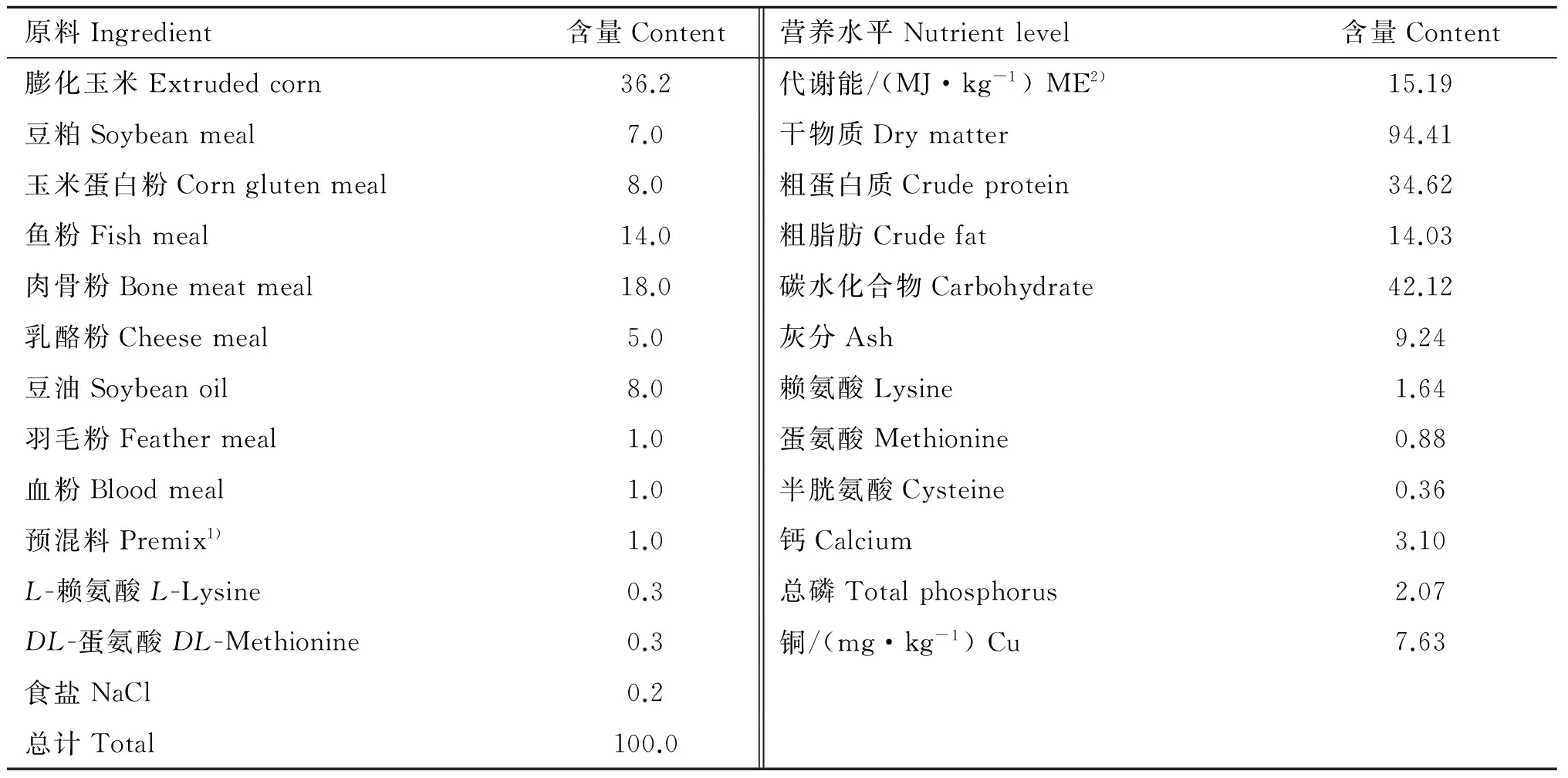
1). 每千克预混料含有: 维生素A醇1 000 000 IU; 胆钙化醇200 000 IU; 生育酚醋酸酯6 000 IU; 硫胺素600 mg; 核黄素800 mg; 钴胺素10 mg; 维生素K 100 mg; 抗坏血酸40 000 mg; 烟酸4 000 mg; 泛酸1 200 mg; 生物素20 mg; 叶酸80 mg; 胆碱30 000 mg; 铁8 200 mg; 锰1 200 mg; 锌5 200 mg; 碘 50 mg; 硒20 mg; 钴50 mg。2). 代谢能计算根据NRC(1982)
1). Contained the following per kg of premix composition: vitamin A palmitate 1 000 000 IU; vitamin D cholecalciferol 200 000 IU; vitamin E acetate 6 000 IU; vitamin B1thiamine hydrochloride 600 mg; vitamin B2riboflavin 800 mg; vitamin B12cobalamin 10 mg; vitamin K menadione 100 mg; vitamin C sodium ascorbate 40 000 mg; nicotinic acid 4 000 mg; vitamin B5niacin 1 200 mg; biotin 20 mg; folic acid 80 mg; choline 30 000 mg; Fe 8 200 mg; Mn 1 200 mg; Zn 5 200 mg; I 50 mg; Se 20 mg; Co 50 mg.2). The metabolisable energy content of feed was calculated on the basis of NRC(1982)
血液样品采集:饲养试验结束后,每组分别选取8只水貂,趾尖采血8~10 mL,置于促凝采血管和抗凝采血管各半。转移至实验室,3 500 r·min-1,4 ℃离心10 min,将分离出的血清和血浆分装在1.5 mL的Eppendorf管中,置于-80 ℃中保存,备用。
1.3 测定指标与方法
样品中铜、锌和铁含量的测定:用移液器取2 mL血清样品于100 mL锥形瓶中,加10 mL优级纯硝酸,封口放置2 h,置于电炉上低温消煮至近干,将溶液无损失地转移到10 mL容量瓶中,使用VARIAN SpectrAA-240原子吸收分光光度计进行Cu、Zn和Fe含量的测定。
血清脂类指标及血清抗氧化指标:GPO-PAP法检测血清甘油三酯(Triglyceride,TG)含量;COD-PAP法检测血清总胆固醇(Total cholesterol,TC)含量;选择性清除法测定低密度脂蛋白胆固醇(Low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)含量。以上指标均用试剂盒测定,试剂盒购自中生北控生物科技股份有限公司。
铜锌超氧化物歧化酶(Cu-Zn SOD)活性采用抽提法测定,血清铜蓝蛋白(CER)活性采比色法测定,以上血清指标测试均采用南京建成试剂盒通过分光光度计测定。
1.4 数据分析
试验数据采用SAS 9.13软件GLM程序单因素方差分析(one-way ANOVA)进行差异显著性检验,处理间差异采用邓肯氏法(Duncan)多重比较进行检验;采用SAS 9.13软件REG程序,以日粮铜含量为自变量,各种指标为效应因子,进行一次线性和二次曲线回归分析。P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 日粮铜水平对水貂铜代谢的影响
日粮铜水平对水貂铜代谢的影响见表2。水貂摄入铜、粪铜、尿铜和铜在体内的沉积量随日粮铜水平增加呈一次线性和二次曲线极显著增加(linear,quadratic,P<0.01)。
表2日粮铜水平对育成期水貂铜代谢的影响
Table2EffectsofdietarycopperlevelsonCumetabolismoflategrowingmink
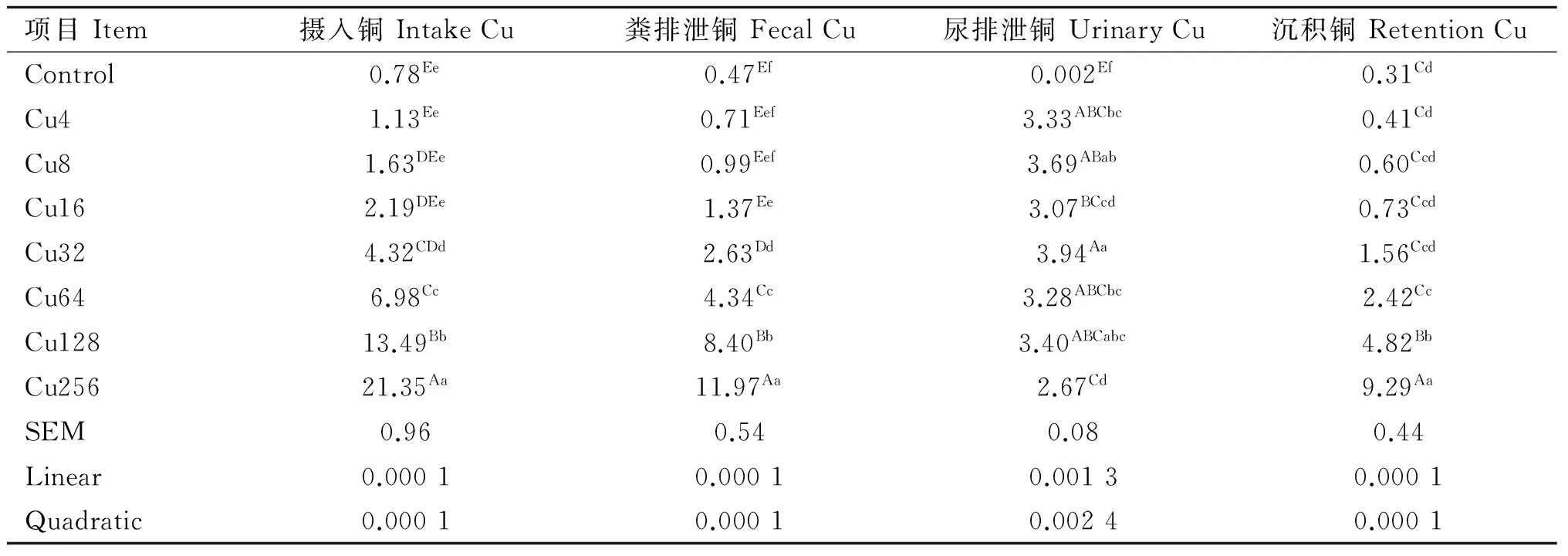
mg·d-1
同列中不同大写字母肩标表示差异极显著(P<0.01),不同小写字母肩标表示差异显著(P<0.05)。下表同
Within the same column, values with different capital letters superscripts are extremely significantly different (P<0.01),values with different small letters superscripts are significantly different (P<0.05). The same as below
2.2 日粮铜水平对水貂血清Cu、Zn和Fe含量的影响
日粮铜水平对水貂血清Cu、Zn和Fe含量的影响见表3。水貂血清铜含量随日粮铜水平的增加而升高(linear,quadratic,P<0.01);日粮铜水平对水貂血清锌和铁含量回归分析和方差分析结果均不显著。方差分析结果显示,Cu256组水貂血清铜含量极显著大于Control、Cu4、Cu8和Cu16组水貂(P<0.01);Cu32、Cu64和Cu128组水貂血清铜含量极显著大于Control和Cu4组水貂(P<0.01),显著大于Cu8组水貂(P<0.05),Cu16组水貂血清铜含量显著大于Control组水貂(P<0.05)。
2.3 日粮铜水平对水貂血清脂类指标的影响
日粮铜水平对水貂血清脂类代谢指标的影响见表4。水貂血清TC(linear,quadratic,P<0.01)和TG(linear,P<0.05;quadratic,P<0.01)含量随日粮铜水平的增加呈线性和二次曲线降低;日粮铜水平与水貂血清HDL-C和LDL-C含量回归分析不显著。方差分析结果显示,Control组水貂血清TC含量极显著高于Cu16、Cu32、Cu64、Cu128和Cu256组(P<0.01),Cu4和Cu8组水貂血清TC含量极显著高于Cu32、Cu64、Cu128和Cu256组(P<0.01),显著高于Cu16组(P<0.05);Control组水貂血清TG含量极显著高于Cu8、Cu16、Cu32、Cu64、Cu128和Cu256组(P<0.01),显著高于Cu4组(P<0.05);各组水貂血清HDL-C含量差异不显著;Control组水貂血清LDL-C含量显著高于Cu16、Cu32、Cu64、Cu128和Cu256组(P<0.05)。
表3日粮铜水平对育成期水貂血清Cu、Zn和Fe含量的影响
Table3EffectsofdietarycopperlevelsonplasmaCu,ZnandFeconcentrationsoflategrowingmink
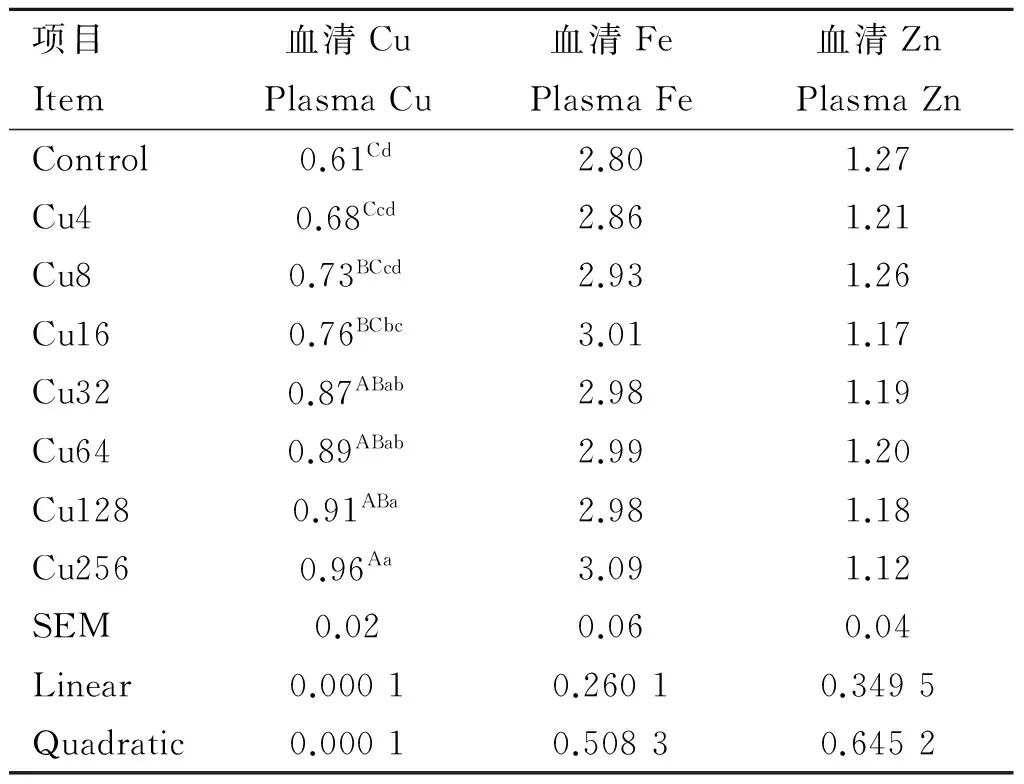
mg·L-1
表4日粮铜水平对育成期水貂血清脂类代谢指标的影响
Table4Effectsofdietarycopperlevelsonserumlipidmetabolismparametersoflategrowingmink
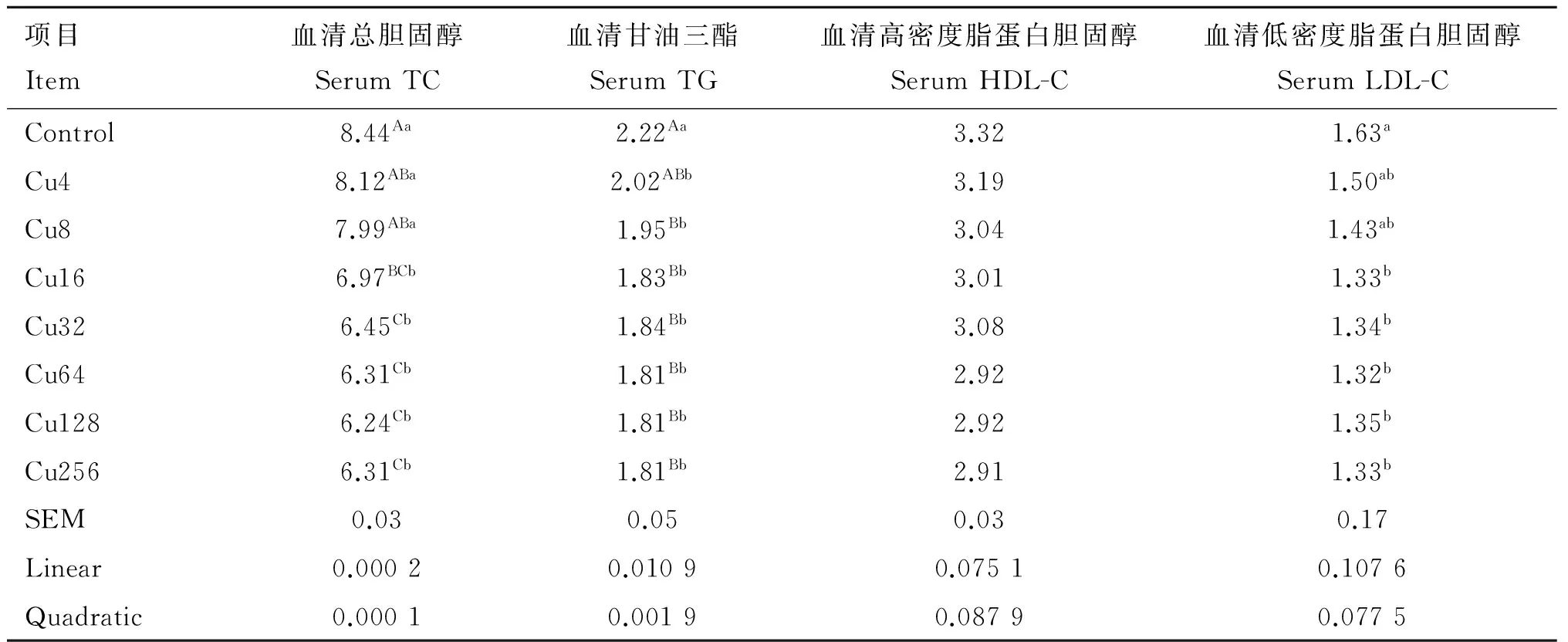
mmol·L-1
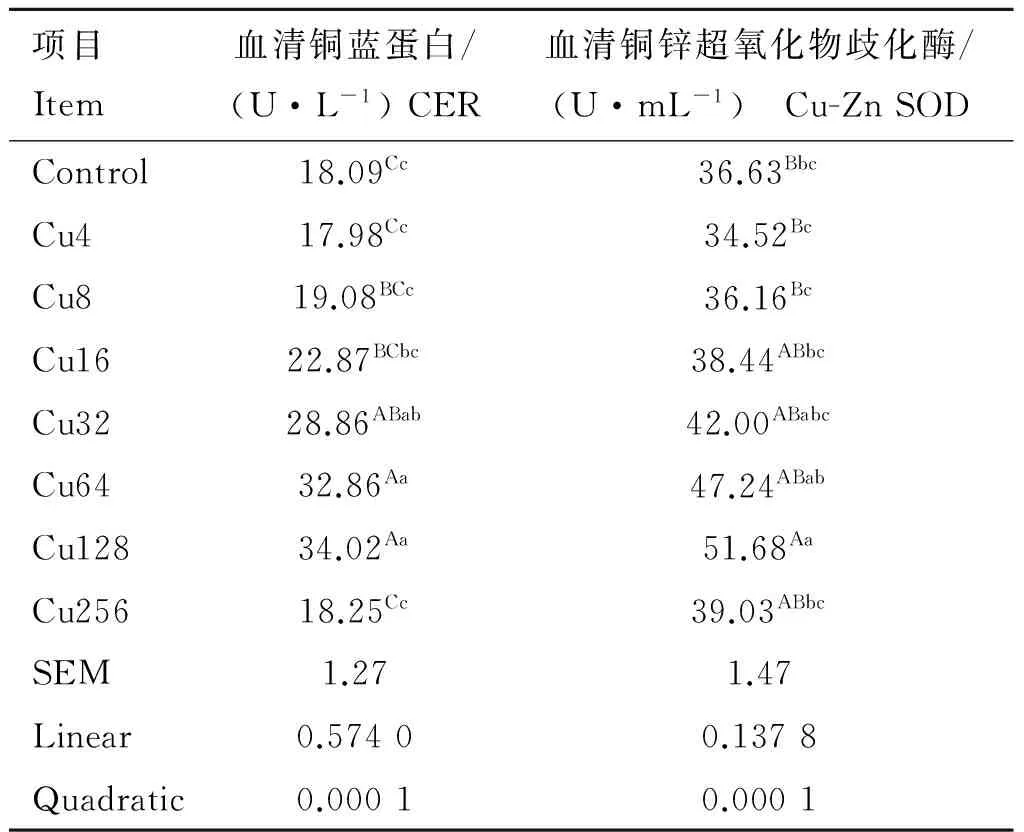
2.4 日粮铜水平对水貂血清抗氧化指标的影响
日粮铜水平对水貂血清抗氧化酶活性的影响见表5。水貂血清CER和Cu-Zn SOD活性随日粮铜水平的增加呈二次曲线先增加后降低(quadratic,P<0.01)。方差分析结果显示,Cu64和Cu128组水貂血清CER活性极显著高于Control、Cu4、Cu8、Cu16和Cu256组(P<0.01),Cu32组水貂极显著高于Control、Cu4和Cu256组(P<0.01),显著高于Cu8组(P<0.05);Cu128组水貂血清Cu-Zn SOD活性极显著高于Control、Cu4和Cu8组(P<0.01),显著高于Cu16和Cu256组(P<0.05)。
表5日粮铜水平对育成期水貂血清抗氧化酶活性的影响
Table5Effectsofdietarycopperlevelsonserumantioxidantenzymeactivitiesoflategrowingmink
项目Item血清铜蓝蛋白/(U·L-1)CER血清铜锌超氧化物歧化酶/(U·mL-1) Cu-ZnSODControl18.09Cc36.63BbcCu417.98Cc34.52BcCu819.08BCc36.16BcCu1622.87BCbc38.44ABbcCu3228.86ABab42.00ABabcCu6432.86Aa47.24ABabCu12834.02Aa51.68AaCu25618.25Cc39.03ABbcSEM1.271.47Linear0.57400.1378Quadratic0.00010.0001
3 讨 论
3.1 日粮铜水平对水貂铜代谢的影响
铜吸收的机制有两种,一种是主动运输过程,一种是扩散过程[9]。随日粮铜水平增加,铜进入体内的量也增加[4]。此外,有研究认为,血清铜蓝蛋白影响肠道对铜的吸收,血清铜蓝蛋白和铜含量与肠道内的铜存在一定的平衡关系[10]。研究表明,尿液中的铜含量甚微,汗液排出的铜可忽略不计,体内大部分铜通过胆汁分泌[11-12]。本研究表明,水貂食入铜、粪铜、尿铜和铜沉积都随日粮铜水平增加而增加,水貂体内的铜主要通过粪便排出体外,尿液中含量极低,但是随着日粮铜含量增加,尿液中铜的含量也增加,这与许多文献报道相一致[13]。马德磊[14]研究表明,随着日粮中铜水平的增加,2~3月龄生长肉兔粪铜含量呈倍数递增。
3.2 日粮铜水平对水貂血清Cu、Zn和Fe含量的影响
研究表明,血清铜浓度在一定范围内随着饲料中铜添加量的增加而升高,铜和锌在动物肠道吸收过程中存在拮抗作用[4]。此外,铜对于铁的运输过程相当重要,缺铜会影响铁从细胞内释放和转运到血液[15]。刘志[16]研究表明,蓝狐血清铜浓度随着饲粮铜水平的升高而显著升高,血清锌含量明显下降,血清铁含量无明显变化。邢芳芳等[17]报道,仔猪日粮铜水平低于100 mg·kg-1时,血清铜含量随日粮铜水平的提高而上升,但是日粮铜水平为100~250 mg·kg-1时,血清铜含量随饲料铜水平提高而降低,日粮铜水平对血清锌和铁的含量没有显著影响。G.A.Apgar等[18]研究表明,仔猪日粮中添加铜浓度在100、200和250 mg·kg-1,血清铜含量随日粮铜水平均有升高。马德磊[14]研究表明,日粮铜水平对2~3月龄生长肉兔血浆中铜含量影响极显著,对血浆中其他矿物质元素含量无显著影响。本研究发现,水貂日粮添加铜可以提高血清铜的含量,但是对血清锌和铁的含量没有显著影响,说明水貂饲喂基础日粮或高铜日粮对锌的吸收和铁的转运未产生显著影响。
3.3 日粮铜水平对水貂血清脂类指标的影响
近年来有大量报道表明,铜与血脂代谢存在密切相关,动物日粮添加铜能够影响动物体内脂类代谢,主要表现在日粮添加铜可以降低血浆胆固醇和甘油三酯水平[19-21]。但是,铜对动物体脂类代谢影响的内在机制并不清楚,有待进一步研究。动物体内胆固醇主要由肝合成,部分来自食物。HMG-CoA还原酶是肝细胞合成胆固醇过程中的限速酶[22],S.Kim等[23]研究发现,饲喂低铜日粮时,小鼠肝细胞中3-羟-3-甲基戊二酰-CoA还原酶(HMG-CoA还原酶)活性增加,胆固醇7α-羟化酶是在肝合成并促使胆固醇转化成胆酸的限速酶[24]。Z.R.Tang等[25]研究表明,成年大鼠饲喂低铜日粮时,胆固醇7-α羟化酶基因相对表达量降低80%,胆固醇7α-羟化酶活性降低,胆固醇转化发生障碍,导致高总胆固醇血症。本试验结果表明,随日粮中铜添加水平的增加,血清中TC、TG和LDL-C含量都呈现降低的趋势,而日粮中铜的添加对血清HDL-C含量未产生显著影响。
3.4 日粮铜水平对水貂血清抗氧化指标的影响
血浆铜蓝蛋白是一种含铜蛋白质,由肝细胞制造,其在铁转运过程中发挥重要作用。铜锌超氧化物歧化酶是一种含铜酶,其能消除生物体在新陈代谢过程中产生的超氧化物,细胞免受氧化损伤。隋慧[26]选用新生仔猪的肝进行细胞分离培养,建立肝细胞体外培养模型,以不同质量浓度的铜进行试验,试验结果表明,在细胞培养液中添加一定质量浓度的铜,可提高CER和Cu-Zn SOD的活性;低质量浓度的铜对CER活性的影响很小,当铜质量浓度逐渐升高时,CER活性显著升高,但当铜质量浓度过高则抑制CER活性。动物日粮添加铜能显著提血清铜锌超氧化物歧化酶活性和CER含量[4, 27-28],但是高剂量的铜可引起机体组织的病理损伤,导致血清CER和Cu-Zn SOD活性降低[2]。本研究表明,当水貂日粮铜水平高于需要量但又不致中毒时,血清CER和Cu-Zn SOD活性随日粮铜水平增加而增强;当日粮添加192 mg·kg-1铜以上时,有可能造成水貂肝损伤,导致血清CER和Cu-Zn SOD活性降低。
4 结 论
水貂日粮添加铜可以增加体内铜的沉积量和血清铜含量,同时能够降低血清胆固醇和甘油三酯水平,提高血清铜蓝蛋白和铜锌超氧化物歧化酶活性。
参考文献(References):
[1] 李 敏, 崔 伟, 彭 西, 等. 高铜对雏鸡脑组织抗氧化酶活性的影响[J]. 畜牧兽医学报, 2010, 41(2): 220-223.
LI M, CUI W, PENG X, et al. Effect of dietary high copper on the antioxidase activities of brain tissue in chickens[J].ActaVeterinariaetZootechnicaSinica, 2010, 41(2): 220-223. (in Chinese)
[2] 崔 伟, 李 敏, 彭 西, 等. 高铜对雏鸡肾脏组织结构及生化指标影响的研究[J]. 畜牧兽医学报, 2010, 41(1): 86-91.
CUI W, LI M, PENG X, et al. Effect of dietary high copper on tissue structure and biochemical parameters of kidney in chickens[J].ActaVeterinariaetZootechnicaSinica, 2010, 41(1): 86-91. (in Chinese)
[3] 刘好朋, 唐兆新, 苏荣胜, 等. 高铜日粮对肉鸡肝脏TrxR2基因mRNA表达和还原活性的影响[J]. 畜牧兽医学报, 2011, 42(3): 423-428.
LIU H P, TANG Z X, SU R S, et al. Effect of high level copper diet on expression oftrxR2 mRNA and reduction activity of trxR2 of liver in broiler[J].ActaVeterinariaetZootechnicaSinica, 2011, 42(3): 423-428. (in Chinese)
[4] WU X Z, LIU Z, GUO J G, et al. Influence of dietary zinc and copper on apparent mineral retention and serum biochemical indicators in young male mink (Mustelavison)[J].BiolTraceElemRes, 2015, 165(1): 59-66.
[5] HOSIENPOUR N, NOROUZIAN M A, AFZALZADEH A, et al. Source of copper may have regressive effects on serum cholesterol and urea nitrogen among male fattening lambs[J].BiolTraceElemRes, 2014, 159(1-3): 147-151.
[6] LIU L, SUI X Y, LI F C. Effect of dietary copper addition on lipid metabolism in rabbits[J].FoodNutrRes, 2017, 61(1): 1348866.
[7] NETTO A S, ZANETTI M A, DEL CLARO G R, et al. Effects of copper and selenium supplementation on performance and lipid metabolism in confined brangus bulls[J].Asian-AustJAnimSci, 2014, 27(4): 488-494.
[8] LEOSCHKE W L. Nutrition and nutritional physiology of the mink: a historical perspective[M]. Victoria, Canada: Trafford Publishing, 2011.
[9] 杨 凤. 动物营养学[M]. 北京: 中国农业出版社, 2010.
YANG F. Animal nutrition[M]. Beijing: China Agriculture Press, 2010. (in Chinese)
[10] RAMOS D, MAR D, ISHIDA M, et al. Mechanism of copper uptake from blood plasma ceruloplasmin by mammalian cells[J].PLoSOne, 2016, 11(3): e0149516.
[11] SQUITTI R, GHIDONI R, SIMONELLI I, et al. Copper dyshomeostasis in Wilson disease and Alzheimer’s disease as shown by serum and urine copper indicators[J].JTraceElemMedBiol, 2018, 45: 181-188.
[12] GRAY L W, PENG F Y, MOLLOY S A, et al. Urinary copper elevation in a mouse model of Wilson’s disease is a regulated process to specifically decrease the hepatic copper load[J].PLoSOne, 2012, 7(6): e38327.
[13] MEJBORN H. Effect of copper addition to mink feed during the growth and moulting period on growth, skin production, and copper retention[J].Scientifur, 1989, 13(3): 229-234.
[14] 马德磊. 日粮铜水平对生长肉兔生产性能、消化代谢、血液生化指标和MT-Ⅰ mRNA表达量的影响[D]. 泰安: 山东农业大学, 2009.
MA D L. Effect of dietary copper supplement on growth performance, digestion, blood biochemical parameters and liver MT-I mRNA expression of growing meat rabbits[D]. Tai’an: Shandong Agricultural University, 2009. (in Chinese)
[15] VASHCHENKO G, MACGILLIVRAY R T A. Multi-copper oxidases and human iron metabolism[J].Nutrients, 2013, 5(7): 2289-2313.
[16] 刘 志. 生长期蓝狐饲粮适宜铜水平和铜源的研究[D]. 北京: 中国农业科学院, 2016.
LIU Z. Optimum copper levels and sources in growing and furring blue foxes[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. (in Chinese)
[17] 邢芳芳, 燕富永, 孔祥峰, 等. 甘氨酸铜、蛋氨酸铜替代硫酸铜对仔猪血清生化指标的影响[J]. 江苏农业学报, 2008, 24(3): 378-380.
XING F F, YAN Y F, KONG X F, et al. Effects of Gly-Cu and Met-Cu replacing copper sulfate as dietary additive on serum biochemical parameters of piglets[J].JiangsuJournalofAgriculturalSciences, 2008, 24(3): 378-380. (in Chinese)
[18] APGAR G A, KORNEGAY E T, LINDEMANN M D, et al. Evaluation of copper sulfate and a copper lysine complex as growth promoters for weanling swine[J].JAnimSci, 1995, 73(9): 2640-2646.
[19] 徐晨晨, 王宝维, 葛文华, 等. 饲粮中不同水平铜对5~16周龄五龙鹅脂类代谢、抗氧化能力与免疫功能的影响[J]. 动物营养学报, 2014, 26(4): 908-917.
XU C C, WANG B W, GE W H, et al. Effects of dietary different copper levels on lipid metabolism, antioxidant ability and immune function ofWulonggeese at the age of 5 to 16 weeks[J].ChineseJournalofAnimalNutrition, 2014, 26(4): 908-917. (in Chinese)
[20] 王宝维, 徐晨晨, 葛文华, 等. 铜对1~4周龄五龙鹅脂类代谢、抗氧化能力及免疫器官指数的影响[J]. 动物营养学报, 2014, 26(8): 2093-2100.
WANG B W, MA C X, GE W H, et al. Effects of copper on lipid metabolism, antioxidant ability and immune organ indexes of Wulong geese aged from 1 to 4 weeks[J].ChineseJournalofAnimalNutrition, 2014, 26(8): 2093-2100. (in Chinese)
[21] 王荣梅, 曹华斌, 李和平, 等. 高铜对肉鸡肝线粒体膜通透性、脂类代谢及肝和肌肉铜含量的影响[J]. 中国兽医学报, 2010, 30(2): 243-246.
WANG R M, CAO H B, LI H P, et al. Effects of high level copper on mitochondrial permeability of liver, lipid metabolism, liver and muscle copper content in broiler[J].ChineseJournalofVeterinaryScience, 2010, 30(2): 243-246. (in Chinese)
[22] RANJI P, RAUTHAN M, PITOT C, et al. Loss of HMG-CoA reductase inC.eleganscauses defects in protein prenylation and muscle mitochondria[J].PLoSOne, 2014, 9(6): e100033.
[23] KIM S, CHAO P Y, ALLEN K G. Inhibition of elevated hepatic glutathione abolishes copper deficiency cholesterolemia[J].FASEBJ, 1992, 6(7): 2467-2471.
[24] XU Q, XUE C Y, ZHANG Y, et al. Medium-chain fatty acids enhanced the excretion of fecal cholesterol and cholic acid in C57BL/6J mice fed a cholesterol-rich diet[J].BiosciBiotechnolBiochem, 2013, 77(7): 1390-1396.
[25] TANG Z R, GASPERKOVA D, XU J, et al. Copper deficiency induces hepatic fatty acid synthase gene transcription in rats by increasing the nuclear content of mature sterol regulatory element binding protein 1[J].JNutr, 2000, 130(12): 2915-2921.
[26] 隋 慧. 铜对猪原代肝细胞含铜酶活性的影响[J]. 饲料研究, 2013(4): 32-35.
SUI H. The effect of copper on copper enzyme activity of the pig liver cells[J].FeedResearch, 2013(4): 32-35. (in Chinese)
[28] WU X Z, ZHANG T T, GUO J G, et al. Copper bioavailability, blood parameters, and nutrient balance in mink[J].JAnimSci, 2015, 93(1): 176-184.

