交联壳聚糖季铵盐薄膜的表征与性能
解 冰, 夏 凯, 赵春毛, 李 洁
(中北大学 材料科学与工程学院, 山西 太原 030051)
0 引 言
抑制细菌的黏附及滋生一直是工业、 食品、 医疗等领域的一大研究难点. 细菌在产品上的滋生不仅对人体健康安全造成潜在隐患, 也会加速产品的老化速率, 对产品的使用性能造成不利的影响[1-2]. 为此, 业界通过添加抗菌剂、 涂覆抗菌涂层、 使用抗菌材料为产品引入抗菌性能, 其中, 抗菌涂层因成本低廉、 制备工艺简便、 性能多样化等优点而成为了业界研究的热点[3]. 最近, 抗菌涂层的研究焦点转向了环境友好、 生物亲和的生物高分子材料上, 如溶菌酶、 壳聚糖及其衍生物等[4-5]. 其中, 壳聚糖因其绿色环保、 低成本和高抗菌性等优点在抗菌涂层应用中具有巨大的潜力.
壳聚糖是几丁质通过脱乙酰化反应得到的一种碱性多糖, 主要从甲壳内动、 植物的外壳中提取, 属于可再生资源[6]. 因其具有生物亲和性、 生物可降解性和抗菌性, 目前已有大量关于壳聚糖的研究, 如Yang等[7]用对苯二甲醛作为交联剂与壳聚糖反应, 制得了具有酸诱导溶解性的交联壳聚糖水凝胶, 并将其作为药物缓释载体应用在制药领域. 研究者们利用壳聚糖多羟基、 氨基的特性, 通过化学改性制备出了多种壳聚糖的衍生物以改善壳聚糖各方面性能, 例如壳聚糖季铵盐、 羧甲基化壳聚糖和磺化壳聚糖等[8-10]. 其中, 壳聚糖季铵盐(HTCC)不仅保持了壳聚糖自身的优异特性, 同时具有水溶性, 对多种临床致病菌如大肠杆菌、 金黄色葡萄球菌和铜绿假单胞菌等都表现出出色的抗菌活性[11].
HTCC丰富的特性使其在水处理和医疗卫生等领域具有巨大的应用潜力, 但直接将其作为抗菌涂层涂覆在基体的表面, 涂层在潮湿环境中的使用稳定性较差, 使用寿命短. 因此, 将HTCC应用在抗菌涂层前, 需要对其进行交联改性以提高水稳定性. 根据已掌握的文献来看, 目前关于交联壳聚糖季铵盐(CHTCC)的研究中, 多数采用戊二醛作为交联剂. 例如, 肖玲等[12]用戊二醛与HTCC反应制备了壳聚糖/HTCC复合薄膜, 交联后的壳聚糖季铵盐在水中具有一定的稳定性, 但戊二醛与HTCC反应后会生成具有光致变色特性的席夫碱, 这会导致产物的颜色变深, 影响其外观和使用[13]. 此外, 在采用环氧氯丙烷作为交联剂的研究中, 主要是通过乳化-化学交联法制备成CHTCC吸附剂, 而针对产物水稳定性的研究甚少. 例如, 周耀珍等[14]以壳聚糖为原料, 二甲基二烯丙基氯化铵为接枝单体, 甲醛为预交联剂, 环氧氯丙烷为交联剂, 通过反相乳液聚合制备出CHTCC吸附剂, 并研究了其对Ni和Cr离子的吸附性能.
本文以环氧氯丙烷为交联剂, 在简便、 可控的条件下与HTCC进行化学交联, 并采用流延法制得CHTCC薄膜, 研究了交联剂用量对CHTCC水稳定性的影响, 比较了HTCC和CHTCC的抗菌活性, 目的是制备出具有良好水稳定性的CHTCC抗菌薄膜.
1 实验部分
1.1 实验材料
HTCC, 酷尔化学科技有限公司; 环氧氯丙烷, 天津市光复精细化工研究所; 氢氧化钠, 天津市进丰化工有限公司; 盐酸, 洛阳市化学试剂厂; 透析袋, 截留分子量: 14000 Da, 上海雷布斯生物科技有限公司; MH肉汤, 青岛高科园海博生物技术有限公司; MH(A)培养基, 北京奥博新生物技术有限责任公司; 大肠杆菌(CGMCC 1.3373)、 金黄色葡萄球菌(CGMCC 1.2465)和铜绿假单胞菌(CGMCC 1.2620), 中国普通微生物菌种保藏管理中心; 去离子水, 自制.
1.2 交联壳聚糖季铵盐薄膜的制备
本文以环氧氯丙烷为交联剂, 采用化学交联-溶液流延法制备CHTCC薄膜, 具体操作如下.
称量2 g HTCC和200 mL去离子水加入到250 mL的三口烧瓶中, 将其置于水浴恒温磁力搅拌器中于70 ℃下搅拌5 h, 使HTCC均匀溶解. 之后用5%的氢氧化钠溶液调节HTCC溶液的pH值至10, 接着加入一定量的环氧氯丙烷, 并继续在70 ℃下搅拌4 h, 反应期间不断滴加5%氢氧化钠溶液使反应体系的pH值维持在10左右. 待反应完成后, 加入一定量的20%盐酸溶液于溶液中, 调节溶液的pH至7, 得到淡黄色、 半透明的CHTCC凝胶溶液. 待凝胶溶液的温度降低到室温后, 将其加入到透析袋中, 在去离子水环境下透析48 h以除去反应残留物, 期间每隔12 h更换一次去离子水, 最终得到微黄透明的CHTCC凝胶溶液. 交联反应示意图如图 1 所示.
将透析后的凝胶溶液倒入200 mL的烧杯中, 量取0.2 mL甘油加入凝胶溶液中, 将烧杯置于水浴恒温磁力搅拌器中于70 ℃下搅拌8~10 h以蒸发掉溶液中的去离子水. 待烧杯内溶液液面降低到40 mL时, 取少量凝胶溶液保存备用, 采用流延制膜法将剩下的凝胶溶液倒入表面皿中, 在真空条件下60 ℃干燥8~10 h, 最终得到微黄透明的CHTCC薄膜. 根据添加的环氧氯丙烷剂量将制得的薄膜编号为CHTCC-1, CHTCC-2, CHTCC-3, CHTCC-4和CHTCC-5, 对应的环氧氯丙烷剂量分别为1, 2, 3, 4和5 mL.

图 1 CHTCC薄膜的制备过程示意图Fig.1 Preparation process of CHTCC thin films
实验中同时制备了纯HTCC薄膜, 具体操作如上所述, 但不添加环氧氯丙烷.
1.3 表征与测试
采用傅里叶变换衰减全反射红外光谱法(ATR-FTIR, Bruker Tensor 27)分析HTCC和不同编号的CHTCC薄膜的分子结构. 具体操作: 检测前将制备的HTCC和CHTCC置于烘箱中60 ℃下干燥4 h, 然后将干燥好的样品置于全反射检测台上进行扫描, 光学分辨率为4 cm-1, 扫描次数32次, 测试范围为4 000~400 cm-1.
用核磁共振氢谱(1H NMR, Bruker AVANCE NEO)分析HTCC和CHTCC-5的分子链结构. 测试条件: 溶剂为D2O, 测试温度为28 ℃, 测试频率为600.13 MHz.
用JSM-6510扫描电子显微镜对HTCC和CHTCC薄膜的形貌进行表征. 制样方法: 将制得的薄膜剪成0.5 cm ×0.5 cm的样品并固定在贴有导电胶的铁制圆台上, 测试前对样品进行喷金处理, 分析样品的表面和断面形貌.
1.4 水稳定性和溶胀度的测定
用平衡溶胀法检测HTCC和CHTCC的溶胀度以及水稳定性. 测定方法: 先将HTCC和不同剂量交联剂制得的CHTCC薄膜剪成1 cm2大小的方片, 然后放入去离子水中浸泡. 48 h后取出称重, 接着把样品置于干燥箱中60 ℃干燥, 直至样品质量恒定不变, 然后称重. 根据下式计算样品的溶胀度.
(1)
式中:A为样品溶胀度;W1为干燥后样品的质量;W2为浸泡后样品的质量.
1.5 抗菌活性测试
采用ASTM E2180-07标准法检测HTCC和CHTCC对大肠杆菌(E.coli)、 金黄色葡萄球菌(S.aureus)和铜绿假单胞菌(P.aeruginosa)的抗菌活性, 用微量肉汤稀释法检测HTCC和CHTCC对3种细菌的最低抑菌浓度(MIC).
2 结果与讨论
2.1 全反射红外光谱分析
图 2 为HTCC和CHTCC的全反射红外光谱(ATR-FTIR)图. 图中3 321, 2 931, 2 881, 1 312和1 413cm-1处分别对应的是-OH, -CH2-, -CH-, C-N的伸缩振动峰和C=O弯曲振动峰, 1 649和 1 479 cm-1处的吸收峰分别对应的是季铵基团的-CH3伸缩振动峰和变形振动峰[15]. 在CHTCC图谱中1 571 cm-1处出现了新峰, 这是-NH2的弯曲振动峰[6], 这表明在交联反应后, 有少量的季铵盐基团从HTCC的仲氨基上脱去产生伯胺基团. 与HTCC相比, CHTCC在1 368和1 038 cm-1处的吸收峰强度明显大于HTCC的峰强, 分别对应的是C-O-C伸缩振动峰和-OH弯曲振动峰, 并且随着环氧氯丙烷剂量的增加, C-O-C的吸收峰增强. 这是因为HTCC分子链上的伯醇基团与环氧氯丙烷发生反应产生了仲醇和脂肪醚, 从而证明了HTCC的成功交联.
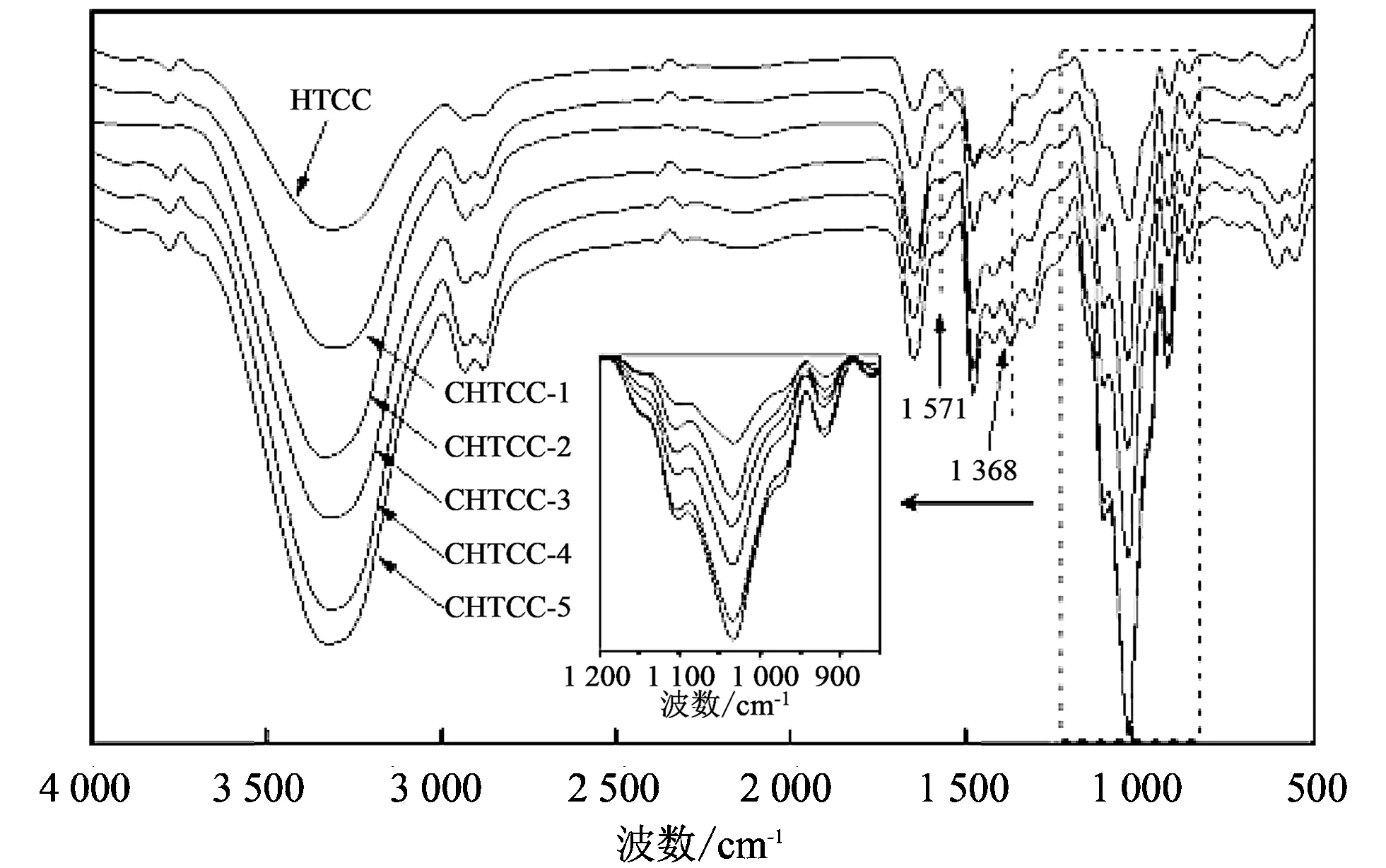
图 2 HTCC和CHTCC的全反射红外光谱图Fig.2 ATR-FTIR spectra of HTCC and CHTCC
2.2 核磁共振分析
对HTCC和CHTCC-5进行了核磁共振表征, 结果如图 3 所示.δ=2.10, 2.60, 2.72, 3.27, 3.45, 3.67~4.00 和4.35 ppm处的峰分别对应的是乙酰胺基团甲基, H-c, H-a, H-d, H-2, H-3~H-6和H-b的质子峰,δ=4.73 ppm处对应的是D2O和H-1的叠加峰[16].
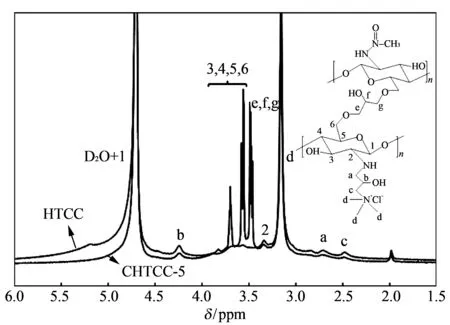
图 3 HTCC和CHTCC-5的核磁共振氢谱图Fig.3 1 HNMR spectra of HTCC and CHTCC-5
与HTCC相比, CHTCC-5在δ=3.57~3.61 ppm 处出现新峰, 这是环氧氯丙烷和HTCC反应后形成的-CH2CH(OH)CH2-上的亚甲基和次甲基的质子峰(H-e, H-f和H-g). 另外, CHTCC-5的H-3~H-6质子峰峰强明显高于HTCC, 且两者H-3~H-6峰面积积分比为2.40. 这些变化再次证明环氧氯丙烷与HTCC发生反应并使HTCC成功交联.
2.3 形貌分析
HTCC和CHTCC-5薄膜的表面和断面形貌如图 4 所示.

图 4 HTCC和CHTCC-5的扫描电子显微镜图(左: 表面, 右: 断面)Fig.4 SEM images of HTCC and CHTCC-5(Left: surface, right: cross section)
两种薄膜的表面都较平整, 没有凹陷和孔洞, 从断面图中可以看到薄膜内部紧密严实, 没有气孔且厚度均匀, 说明流延法制备的HTCC和CHTCC薄膜表面性能优异. 根据断面图计算, HTCC薄膜的厚度为228 μm, CHTCC-5薄膜的厚度为467 μm, 交联后的CHTCC薄膜厚度增大, 这是因为在交联反应后, 原来呈线性并相互缠结的HTCC分子链段与环氧氯丙烷反应形成交联网状的结构, 其分子链之间的距离增加, 宏观上CHTCC-5薄膜的厚度要大于HTCC的厚度.
2.4 水稳定性和溶胀度分析
采用平衡溶胀法研究CHTCC薄膜的溶胀度, 并间接分析CHTCC的交联度, 不同环氧氯丙烷剂量对CHTCC溶胀度的影响如表1所示. 因为HTCC属于水溶性高聚物, 所以在去离子水中, HTCC最终溶解形成无固定形状的水凝胶. 对于CHTCC-1, 因为交联剂添加量过少导致HTCC无法充分交联形成三维网状结构, 因此CHTCC-1有一部分会溶解于水中. 从CHTCC-2开始, 随着交联剂添加量增加, 薄膜的溶胀度逐渐减小, 当交联剂用量为5 mL时, 薄膜的溶胀度降低到6.53%. 这是因为随着HTCC交联度的增加, 链段长度减小, 分子网络的柔性减小, 其溶胀度也相应减小[17]. 这证明了交联剂剂量与薄膜交联度成正比, 而较低的溶胀度有利于薄膜的使用稳定性.

表 1 不同环氧氯丙烷交联的CHTCC薄膜的溶胀度
为了更直观地比较HTCC和CHTCC的水稳定性, 将制备的HTCC和CHTCC薄膜剪成1.5 cm×1.5 cm 的方块样品, 置于一次性表面皿中, 并加入过量的去离子水, 静置48 h后观察薄膜外观的变化, 实验结果如图 5 所示.
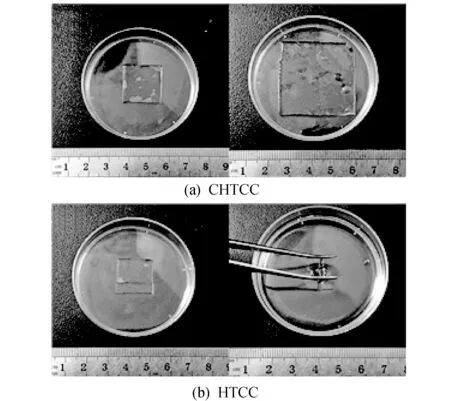
图 5 CHTCC和HTCC的水稳定性能测试(左: 吸水前, 右: 吸水后)Fig.5 Water stability test of CHTCC and HTCC (Left: before water treatment, right: after water treatment)
图5(a)为CHTCC薄膜, 在水中浸泡48 h后, 交联结构的CHTCC薄膜在去离子水中发生溶胀, 薄膜面积增大. 对于HTCC薄膜(图5(b)), 由于其良好的水溶性, 在浸泡48 h后已完全溶于去离子水中, 形成一定黏度的HTCC凝胶溶液.
2.5 抗菌活性分析
采用ASTM E2180-07标准, 通过平板培养法检测了HTCC和HTCC-5对大肠杆菌、 金黄色葡萄球菌和铜绿假单胞菌的抗菌活性, 对照组为没有经过HTCC和CHTCC-5薄膜处理直接接种菌液的平板, 接种液菌落浓度为1×103CFU/mL.
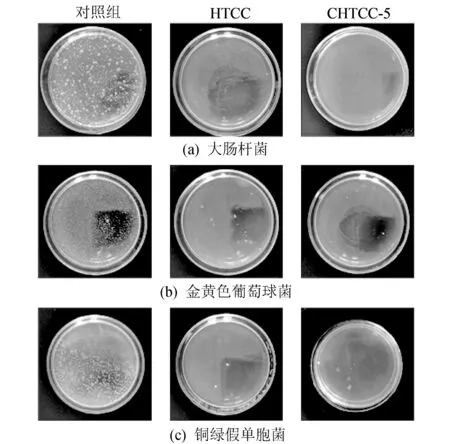
图 6 HTCC和CHTCC-5的抗菌活性Fig.6 Antibacterial activity of HTCC and CHTCC
如图 6 所示, 在对照组中可以看出平板上有大量的菌落形成, 通过接触HTCC和CHTCC-5薄膜后, 平板上的菌落明显减少, 这说明HTCC和CHTCC-5对3种细菌都具有抗菌作用, 且交联结构的形成并不影响CHTCC的抗菌活性.
表 2 为HTCC和CHTCC对3种不同菌株的MIC, 从表中可以看出, HTCC和CHTCC对大肠杆菌的MIC(625和320 μg/mL)比对铜绿假单胞菌(313和160 μg/mL)的MIC值要低, 说明HTCC和CHTCC对大肠杆菌和铜绿假单胞菌都具有较好的抗菌活性. 而HTCC和CHTCC对金黄色葡萄球菌的MIC分别为2 500和2 560 μg/mL. 这是因为大肠杆菌和铜绿假单胞菌都属于革兰氏阴性菌而金黄色葡萄球菌为革兰氏阳性菌, 两种细菌细胞壁组成不同, 革兰氏阳性菌的细胞壁厚且致密, 而革兰氏阴性菌的细胞壁较薄, 更容易被HTCC和CHTCC分子链上的季铵盐基团所影响导致细胞壁破裂[11]. 因此大肠杆菌和铜绿假单胞菌对HTCC和CHTCC的敏感性更强.
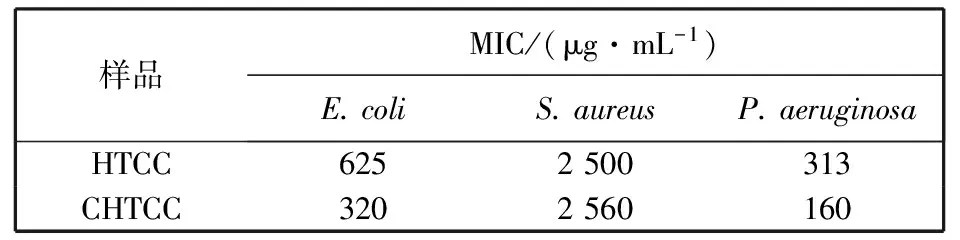
表 2 HTCC和CHTCC对大肠杆菌、 金黄色葡萄球菌和铜绿假单胞菌的最小抑菌浓度
3 结 论
本文采用化学交联法制备了一种具有交联网状结构的壳聚糖季铵盐. 经多种方法对产物进行表征后, 结果表明:
与HTCC原材料相比, CHTCC在水中只发生溶胀而不会溶解, 且交联剂剂量与薄膜交联度成正比, 当环氧氯丙烷添加量为5 mL时, CHTCC的溶胀度为6.53%, 此时薄膜的交联度最高, 使用稳定性最好. 交联过后, CHTCC依然保持着优异的抗菌性能, 对大肠杆菌、 金黄色葡萄球菌和铜绿假单胞菌都具有出色的抗菌活性, 其最小抑菌浓度分别为320, 2 560和160 μg/mL. 制备的CHTCC可以作为絮凝剂、 抗菌剂、 抗菌涂层和药物缓释载体应用在水处理、 食品包装、 医疗卫生和制药等领域.
参考文献:
[1] Calfee D P. Crisis in hospital-acquired, healthcare-associated infections[J]. Annual Review of Medicine, 2012, 63(63): 359-371.
[2] Argyres M I. Hospital-acquired infections due to gra-m-negative bacteria[J]. New England Journal of Medicine, 2010, 363(15): 1483.
[3] Crijns F R, Keinänen-Toivola M M, Dunne C P. Antimicrobial coating innovations to prevent healthcare-associated infection[J]. Journal of Hospital Infection, 2017, 95(3): 243-244.
[4] Chook S W, Chia C H, Zakaria S, et al. Effective immobilization of silver nanoparticles on a regenerated cellulose-chitosan composite membrane and its antibacterial activity[J]. New Journal of Chemistry, 2017, 41(12): 5061-5065.
[5] Jin G, Su Y, Liu P, et al. An environmentally benign antimicrobial coating based on a protein supramolecular assembly[J]. ACS Applied Materials & Interfaces, 2017, 9(1): 198-210.
[6] Rinaudo M. Chitin and chitosan: properties and applications[J]. Cheminform, 2007, 38(27): 603-632.
[7] Yang X L, Ju X J, Mu X T, et al. Core-shell chitosan microcapsules for programmed sequential drug release[J]. ACS Applied Materials & Interfaces, 2016, 8(16): 10524-10534.
[8] Chen Y, Li J, Li Q, et al. Enhanced water-solubility, antibacterial activity and biocompatibility upon introducing sulfobetaine and quaternary ammonium to chitosan[J]. Carbohydrate Polymers, 2016, 143: 246-253.
[9] Ghaee A, Nourmohammadi J, Danesh P. Novel chitosan-sulfonated chitosan-polycaprolactone-calcium ph-osphate nanocomposite scaffold[J]. Carbohydrate Polymers, 2017, 157: 695-703.
[10] Ge H C, Luo D K. Preparation of carboxymethyl chitosan in aqueous solution under microwave irradiation[J]. Carbohydrate Research, 2005, 340(7): 1351-1356.
[11] Sahariah P, Sigurjonsson O E, Srensen K K, et al. Impact of chain length on antibacterial activity and hemocompatibility of quaternary N-alkyl and N,N-dialkyl chitosan derivatives[J]. Biomacromolecules, 2015, 16(5): 1449-1460.
[12] 肖玲, 涂依, 李洁, 等. 壳聚糖/壳聚糖季铵盐复合膜的性能研究[J]. 武汉大学学报(理学版), 2005, 51(2): 190-194.
Xiao Ling, Tu Yi, Li jie, et al. Properties of chitosan/quaternized chitosan composite membranes[J]. Wuhan University Journal, 2005, 51(2): 190-194. (in Chinese)
[13] Amimoto K, Kawato T. Photochromism of organic compounds in the crystal state[J]. Journal of Photochemistry & Photobiology C Photochemistry Reviews, 2005, 6(4): 207-226.
[14] 周耀珍, 姚春才, 方年. 交联壳聚糖季铵盐吸附剂的制备及其对重金属离子的吸附[J]. 化工环保, 2014, 34(2): 170-175.
Zhou Yaozhen, Yao Chuncai, Fang Nian. Preparation of crosslinked quaternary chitosan salt and adsorption of heavy metal ions on it[J]. Environmental Protection of Chemical Industry, 2014, 34(2): 170-175. (in Chinese)
[15] 凌敏, 李茂政, 廖有为. 壳聚糖/壳聚糖季铵盐交联共混阴离子交换膜的制备与性能研究[J]. 应用化工, 2010, 39(1): 60-63.
Ling Min, Li Maozheng, Liao Youwei. Preparation and properties of chitosan/quaternized chitosan blend cross-linked anion exchange membranes[J]. Applied Chemical Industry, 2010, 39(1): 60-63. (in Chinese)
[17] 张晓云, 李睿, 刘孔怡, 等. 混合溶剂溶胀法测吸水树脂交联密度[J]. 实验技术与管理, 2016, 33(7): 40-42.
Zhang Xiaoyun, Li Rui, Liu Kongyi, et al. Measurement of crosslinking density of water absorbent resinby swelling in mixed solvent[J]. Experimental Technology and Management, 2016, 33(7): 40-42. (in Chinese)

