选择性消融Marshall韧带减少缺血再灌注损伤诱导的室性心律失常*
胡慧慧 马瑞松 秦智亮 余小梅 鲁志兵 李元红 江洪
自主神经失衡(交感神经活性增加和迷走神经活性降低)与心肌缺血再灌注(I/R)损伤中的不良心脏事件明显相关[1]。目前研究发现交感神经系统的激活,特别是星状神经节的激活会增加心脏性猝死(SCD)以及室性心律失常(VAs)的发生率[2]。相反,去心脏交感神经支配,如左侧星状神经节(LSG)消融、肾交感神经消融(RSD)能够抑制VAs和SCD的发生。Marshall韧带(LOM)是由冠状窦(CS)近端延伸至左上肺静脉(LSPV)口部的心外膜结构,包含Marshall斜静脉,心肌袖和部分自主神经[3]。LOM远段(LOMLSPV,靠近LSPV)延伸到肺静脉根部有丰富的交感神经,近段(LOMCS,靠近CS)直接连接到CS的肌袖,主要由副交感神经支配[4]。近年来我们的团队研究发现, LOMLSPV是LSG和心室之间的交感神经通路,消融LOMLSPV也可以抑制交感神经活性,减少VAs的发生。但是,LOMLSPV消融对I/R诱导的VAs的影响尚不清楚,以及与消融LSG是否有相同效果仍然不知。
笔者在犬心肌I/R模型中,观察选择性消融LOMLSPV对I/R损伤诱导的VAs的影响,比较消融LOMLSPV与消融LSG在预防I/R诱导的VAs中的作用。
1 材料与方法
1.1实验动物及试剂 健康成年杂种犬33只(体重15~20 kg),由武汉大学人民医院动物中心提供。以3% 戊巴比妥钠30 mg/kg静脉麻醉后,气管插管后给予持续正压通气,实验过程中每小时末追加戊巴比妥2 mg/kg。分别进行股动、静脉穿刺,置入鞘管,动脉连接压力转换器持续记录血压,静脉通道持续滴注生理盐水。颈部脱毛备皮消毒后,在左侧锁骨上水平暴露左侧颈内静脉备采血标本。调节合适室温,维持犬的正常体温。心电、血压信号均接入Lead 7000多导电生理记录系统(四川锦江电子公司)记录和分析。去甲肾上腺素(NE)、肾上腺素(E)ELISA检测试剂盒(武汉,Elabscience公司)。
1.2实验分组及干预 33只犬按一定比例随机分为3组:所有犬经左侧第四肋间开胸,心包剪开后,充分暴露心脏。于冠状动脉(简称冠脉)左前降支第一对角支、第二对角支之间穿针引线(2-0#无创丝线),① I/R组(n=11):分离左冠脉并穿线,结扎左冠脉前降支30 min,再灌注2 h。②LOM组(n=9):结扎冠脉前消融LOMLSPV段。将多极电生理记录电极贴于LOM,记录LOM电位以指导消融。消融功率设定为35 W,消融过程中持续生理盐水冲洗导管头端。有效标志是肉眼观察消融部位的LOM完全毁损且其电位消失[5]。③LSG组(n=13):结扎冠脉前消融LSG。LSG位于左侧第二肋间靠近脊柱处,拨开外膜后充分暴露LSG。首先使用高频电刺激(频率20 Hz,脉宽2 ms,电压10 V)进行功能定位,刺激能使血压上升即确认为LSG。消融功率设定为35 W,消融过程中持续生理盐水冲洗导管头端。消融成功的标志为同样的高频电刺激无法使血压上升[6]。LOM组与LSG组消融成功后30 min,结扎左冠脉前降支30 min,再灌注2 h。
1.3心肌I/R模型的制备 所有犬将无菌丝线连同一小段硬质圆钝头的塑料管一起结扎,造成缺血,及时记录心电图的改变。结扎成功的标准:心肌缺血区局部发绀,同步Ⅱ导联ECG显示ST段明显抬高及心脏表面变苍白。结扎30 min 后,在硬质塑料管上切断结扎线,恢复冠脉血流再灌注2 h。再灌注成功的标准:缺血区局部颜色变红,同步Ⅱ导联ECG显示ST段逐渐回落1/2以上。
1.4心率变异性(HRV)的记录 LOM组与LSG组采用LabChart多道生理记录仪(澳大利亚ADInstruments公司)记录开胸后基础状态及消融LOMLSPV或LSG 30 min后两个时间段动态心电图各30 min,利用配套的分析软件计算短时频域分析指标[低频(LF)、高频(HF)及LF/HF],分析各5 min时段的HRV,以评估心脏自主神经活性的变化。其中HF(0.15~0.40 Hz)是反映副交感神经活动的指标,LF(0.04~0.15 HZ)和LF/HF比值是反映交感神经活动的指标。
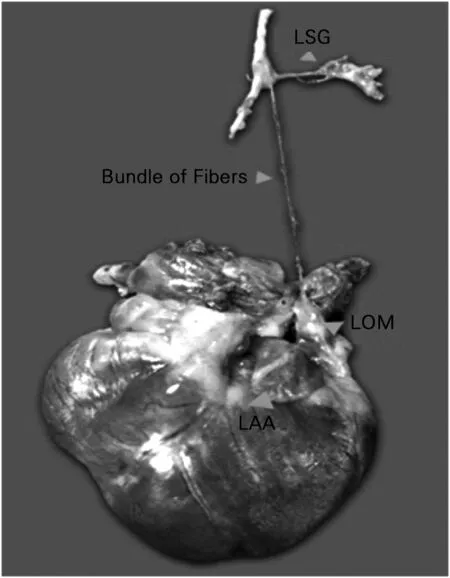
LSG=左侧星状神经节;Bundle of Fibers=纤维束; LOM=Marshall韧带;LAA=左心耳
图1Marshall韧带的解剖位置
1.5心电图室性心律失常的观察 三组均持续记录体表心电图,记录I/R期间的 VAs[单个或连发的室性早搏(简称室早)、室性心动过速(简称室速)和心室颤动(简称室颤)],统计VAs的发生情况和室速持续时间。
1.6血清NE、E的测定 所有犬分别于开胸后基础状态、结扎左前降支前消融LOM或LSG后30 min(第二次采血)、再灌注2 h后经颈内静脉取血4 ml,之后3 000 r/min离心30 min,取上清液采用ELISA法检测NE、E的含量。
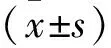
2 结果
2.1两组消融前后HRV的比较 与开胸后基础状态相比,消融后LF值和LF/HF值明显降低 (P均<0.05),而两组HF值有升高趋势,但均无差异(P均>0.05)。且两组在各个时间点的组间比较并无差异(P均>0.05)。见表1。
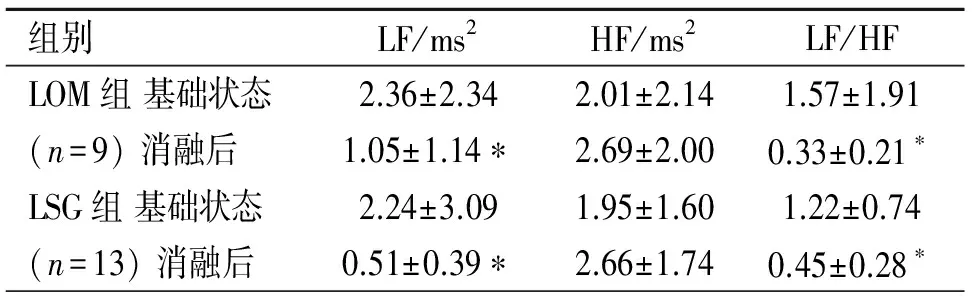
表1 消融LOMLSPV或LSG前后HRV的比较
注:LOM=Marshall韧带,LSG=左侧星状神经节,与开胸后基础状态比较,*P<0.05
2.2三组室性心律失常发生的比较 与I/R组相比,LOM组或LSG组的室速的发生次数明显减少(P<0.05)、室速的持续时间显著缩短(P<0.05),但LOM或LSG组室颤的发生率仅有减少趋势、室早的发生次数无差异(P>0.05)。LOM组与LSG组对室性心律失常的影响无差异(P>0.05)。见表2。
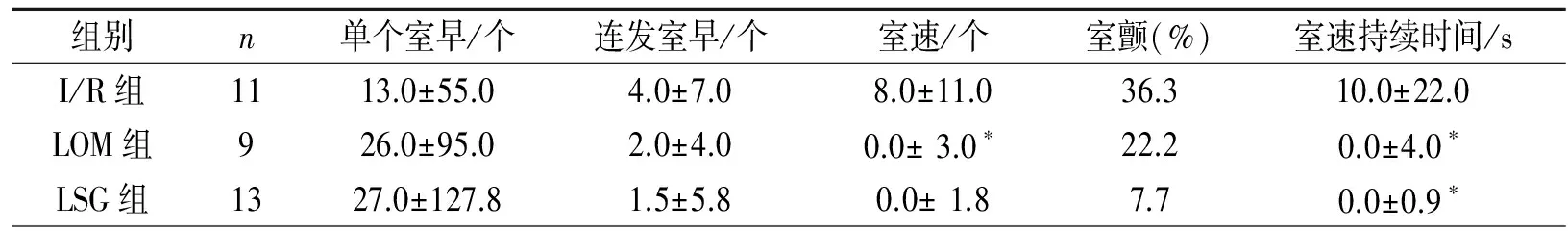
表2 消融LOMLSPV或LSG对I/R后室性心律失常事件(VAs)的影响(中位数± 四分位间距)
注:与I/R组相比较,*P<0.05
2.3三组NE、E水平的比较 基础状态时,三组血清NE、E水平基本一致,两两相比并无显著性差异(P均>0.05)。结扎前消融30 min后,三组NE、E水平也无显著性差异(P均>0.05)。再灌注2 h后,与I/R组相比, LOM或LSG组血清NE、E的水平明显降低(P均<0.05);LOM与LSG组NE、E并无差异(P均>0.05)。与同组基础状态比较, I/R组在再灌注2 h后NE和E水平显著增加(P<0.05),LOM或LSG组则无差异(P均>0.05)。见表3。

表3 各组不同时间点血清中NE、E水平的比较
注:与同组基础状态比较,*P<0.05;与I/R组比较,△P<0.05
3 讨论
I/R时过度的炎症反应、大量活性氧自由基(ROS)的形成以及补体的激活最终都会过度激活交感神经,缺血后的血小板活化、心肌细胞无氧呼吸亦会引起交感神经兴奋[7-8]。前期研究提示,通过抑制缺血诱导的心脏交感神经活性能够抑制缺血诱导的心肌组织中组胺和5-HT等介质的分泌[9]。交感神经过度激活与VA的发生之间有密切联系。交感神经末梢释放过量的NE和E聚集在心肌细胞与神经末梢间隙处,损伤心肌细胞引起心律失常[10]。LSG的活性也被认为是心脏交感神经张力的标志。Zhou等[11]发现,VAs的发生往往伴随着早期的LSG活性增加。LSG消融可以有效减少长QT模型中不良心脏事件的发生[12]、儿茶酚胺敏感性多形性室速[13]以及心肌梗死后恶性心律失常的发生[14]。在本研究中,笔者发现消融LOMLSPV和LSG明显抑制心脏交感神经活性(LF/HF、NE和E)和I/R诱导的VAs。这可能是SCD的保护补充机制。
LOM是一束包被于脂肪组织中的心外膜退化结构,含有血管、纤维束、神经以及心房肌,其走行于CS近端肌袖至LSPV口部,与心包相延续。在解剖学上,LSG则为颈下神经节与第一胸神经节融合而成,交感神经节前纤维在LSG换元后发出心下神经支,加入心丛后参与支配心脏活动。因此LOM也是LSG和心室交感神经通路中的一个重要环节。在功能上,笔者以往的研究[15]表明,LOMLSPV消融可以显著抑制刺激LSG引起的心室有效不应期缩短,减弱LSG刺激对长QT综合征的影响。Lin等[16]LOMLSPV刺激可诱发VAs。在组织学,我们的其他研究[17]表明,LOMLSPV富含交感神经而并非副交感神经。这些结果表明LOMLSPV在心脏交感神经通路中的重要作用。在本研究中,笔者发现消融LOMLSPV显著抑制心脏交感神经活性,降低心肌I/R损伤诱发室速的发生以及缩短室速时间。由于样本量小,VF的发生率在LSG组和LOM组无显著降低,但呈下降趋势。同时,笔者发现LOMLSPV和LSG消融并不能减少室早和连发室早的发生。所有这些研究结果表明LOMLSPV消融抑制交感神经活性,降低VAs的发生并抑制恶性心律失常的增加。上述结果表明消融LOMLSPV或LSG发挥着类似的预防I/R损伤后VAs发生的作用,且消融LOMLSPV产生的这种抗心律失常作用可能与破坏了LSG与心室间的交感连接通路有关。
1 Wang SY,Zhou X,Huang B,et al. Spinal cord stimulation protects against ventricular arrhythmias by suppressing left stellate ganglion neural activity in an acute myocardial infarction canine model[J]. Heart Rhythm,2015,12(7):1 628
2 Shen MJ,Zipes DP. Role of the autonomic nervous system in modulating cardiac arrhythmias[J]. Circulation Research,2014,114(6):1 004
3 Rodriguez-Manero M,Schurmann P,Valderrabano M. Ligament and vein of Marshall: A therapeutic opportunity in atrial fibrillation[J]. Heart Rhythm,2016,13(2):593
4 Makino M,Inoue S,Matsuyama T,et al. Diverse myocardial extension and autonomic innervation on ligament of Marshall in humans[J]. Journal of Cardiovascular Electrophysiology,2006,17(6):594
5 Wang SY, Lu ZB, He WB, et al. Selective ablation of the ligament of marshall reduces the prevalence of ventricular arrhythmias through autonomic modulation in a cesium-induced long QT canine model[J].JACC Clinical Electrophysiology, 2016,2(1):97
6 Huang B,Yu L,Scherlag BJ,et al. Left renal nerves stimulation facilitates ischemia-induced ventricular arrhythmia by increasing nerve activity of left stellate ganglion[J]. Journal of Cardiovascular Electrophysiology,2014,25(11):1 249
7 Huang HS,Pan HL,Stahl GL,et al. Ischemia- and reperfusion-sensitive cardiac sympathetic afferents: influence of H2O2and hydroxyl radicals[J]. The American Journal of Physiology,1995,269(3 Pt 2):H888
8 Nishi K,Sakanashi M,Takenaka F. Activation of afferent cardiac sympathetic nerve fibers of the cat by pain producing substances and by noxious heat[J]. Pflugers Archiv,1977,372(1):53
9 雷玉华,马瑞松,李元红,等. 肾交感神经消融对心肌梗死后室性心律失常发生的影响及其机制[J]. 中国心脏起搏与心电生理杂志,2016,30(05):432
10 Schomig A. Catecholamines in myocardial ischemia. Systemic and cardiac release[J]. Circulation,1990,82(3):I13
11 Zhou S,Jung B,Tan AY,et al. Spontaneous stellate ganglion nerve activity and ventricular arrhythmia in a canine model of sudden death[J]. Heart Rhythm,2008,5(1):131
12 Schwartz PJ,Priori SG,Cerrone M,et al. Left cardiac sympathetic denervation in the management of high-risk patients affected by the long-QT syndrome[J]. Circulation, 2004,109,1 826
13 Garcia-Moran E,Sandin-Fuentes MG,Alvarez Lopez JC,et al. Electrical storm secondary to acute myocardial infarction and heart failure treated with left stellate ganglion block[J].Rev Esp Cardiol(Engl Ed), 2013,66,595
14 Hayase J,Patel J,Narayan SM,et al. Percutaneous stellate ganglion block suppressing VT and VF in a patient refractory to VT ablation[J]. J Cardiovas Electrophysiol, 2013,24(8):926
15 Huang B,Yu L,He B,et al. Sympathetic denervation of heart and kidney induces similar effects on ventricular electrophysiological propertie[J]. Euro Intervention, 2015,11(5):598
16 Lin J,Scherlag BJ,Lu Z,et al. Inducibility of atrial and ventricular arrhythmias along the ligament of marshall: role of autonomic factors[J]. Journal of Cardiovascular Electrophysiology,2008,19(9):955
17 Makino M,Inoue S,Matsuyama T,et al. Diverse myocardial extension and autonomic innervation on ligament of Marshall in humans[J]. Journal of Cardiovascular Electrophysiology,2006,17(6):594

