肾交感神经与左侧星状神经节消融后心肌梗死犬室性心律失常的比较
孟冠南 余锂镭 黄兵 王梦龙 李雪飞 江洪
有研究表明,心脏交感神经的过度激活在心肌梗死(简称心梗)后室性心律失常的发生中起重要作用,因此降低心脏交感神经活性是减少心梗后室性心律失常的有效手段[1-3]。左侧星状神经节是心脏交感神经的重要节点,大量研究表明左侧星状神经节消融(LSGA)可以明显减少心梗后室性心律失常的发生[4]。近年来研究提示肾交感神经不仅在调节全身交感神经系统中起重要作用,与心脏交感神经之间也存在密切联系[5]。肾交感神经消融术(RSNA)在临床上多用于顽固性高血压的治疗,研究发现,RSNA不仅可以起到降血压的效果,也可以降低血清肾上腺素水平,而且本中心既往研究中也发现RSNA可以明显降低左侧星状神经节神经活性。笔者探讨RSNA是否也有减少心梗后室性心律失常的作用。
1 材料与方法
1.1实验动物 本研究由武汉大学动物实验伦理委员会审核并批准。24只健康成年家犬均由武汉大学动物中心提供,体重在16~20kg,随机分为RSNA组(n=8)、LSGA组(n=8)和对照组(Control,n=8)共3组,各组分别行RSNA、LSGA或假手术处理。所有动物均在3%戊巴比妥钠麻醉下进行(初始剂量30 mg/kg,维持剂量2 mg·kg-1·h-1),正压通气呼吸机维持,股动脉穿刺置管测量血压,多导生理记录仪持续记录血压、体表心电图(Lead7000,四川锦江电子科技有限公司)。分别测量基础状态(BS)及术后60 min内血压、心率。
1.2LSGA与RSNA LSGA组实验动物在麻醉后行左侧开胸手术,暴露左侧星状神经节,以Grass刺激仪(S88; Grass Instruments, Quincy, MA)给予高频电刺激(频率 20 Hz,脉宽2 ms,电压10 V)引起血压升高为标准确认消融位点,以消融大头导管(Biosense Webster Inc., Diamond Bar, CA, USA)进行消融,功率不超过35 W,时间60 s。以高频电刺激不引起血压升高为消融成功的判断标准。RSNA组在双侧肋弓下缘行腹膜后侧位切开术,暴露肾脏,找到肾动脉,以高频电刺激引起血压升高为标准确认消融位点,以消融大头导管(Biosense Webster Inc., Diamond Bar, CA, USA)给予6~8 W射频电流60 s进行消融,每侧消融6个点,以高频电刺激不再诱发血压升高为标准确认消融成功。Control组行假手术。
1.3心室有效不应期(ERP)测定 行双侧开胸术暴露心脏,剪开心包,将多极电极导管分别缝于左室心尖部(LVA)、左室基底部(LVB)、左室中间部(LVM)、右室心尖部(RVA)、右室基底部(RVB)、右室中间部(RVM)。以S1S2程序电刺激测定ERP:程序电刺激由Lead7000(四川锦江电子科技有限公司)发放,由连续8个周长为300 ms的S1S1刺激外加1个S2刺激组成,S1S2间期从250 ms为起始,以10 ms递减,接近ERP时以2ms递减,直至达到ERP。ERP定义为不能夺获心室的最长S1S2间期。分别测量上述部位术前及术后0、30、60 min时间点ERP。
1.4急性心梗模型制备及室性心律失常分析 上述指标测量结束后,钝性分离出冠状动脉左前降支,在左心耳根部以缝合线结扎左前降支使其完全闭塞,并观察心电图变化,出现胸前导联ST段抬高(至少两个导联ST段抬高0.1 mV及以上)确认急性心梗模型制备成功。持续记录心梗后1 h内心电图变化,分析室性心律失常发生情况。室性心律失常的分类采用Lambeth标准:①单发室性早搏(I-VPB);②室性早搏连发(Salvo),指2到3个连续的室性早搏;③室性心动过速(VT),指连续出现4个及以上的室性早搏。④心室颤动(VF),心电图上无法识别出独立的QRS波群。在本实验中主要观察心梗后1 h内I-VPB、Salvo发生个数(手动计数),VT次数及持续时间(心梗后1 h内所有VT持续时间之和),VF发生率(每只实验犬出现1次VF即死亡,VF发生率为出现VF的实验犬个数除以每组所有实验犬个数)。
1.5统计学分析 所有数据采用SPSS22.0系统进行分析。ERP数据采用均数±标准误的形式表示,其他计量资料数据采用均数±标准差的形式表示。ERP数据分析采用双因素方差分析,心梗后I-VBP、Salvo、VT数据均采用单因素方差分析,VF数据采用Fisher确切概率法分析。以P<0.05为差异有显著性。
2 结果
2.1三组之间心率、血压的比较 在基础状态下三组之间血压、心率均无显著差异(P均>0.05),术后60 min后RSNA及LSGA组心率均较Control组显著下降(P<0.01),但血压无差异(P>0.05),RSNA及LSGA组之间心率、血压均无差异(P均>0.05)(表1)。
2.2三组各部位心室ERP的比较 三组之间各部位ERP在基础状态下均无明显差异(P>0.05),但在术后30 min及60 min时,RSNA组及LSGA组ERP明显延长(P<0.05),而对照组不同时段ERP则无明显变化(P>0.05)。而RSNA组与LSGA组无明显差异(P>0.05)。详见图1。

表1 不同组别术后基础状态及术后60 min心率、收缩压对比
注:BS=基础状态。与Control组比较,**P<0.01
2.3三组心梗后室性心律失常的比较 心梗后三组均出现明显I-VBP、Salvo、VT等室性心律失常。与Control组比较,RSNA组及LSGA组I-VBP、Salvo、VT次数均明显减少,VT持续时间缩短,VF发生率降低(P均<0.05),但LSGA组与RSNA组之间无差异,见表2。
3 讨论
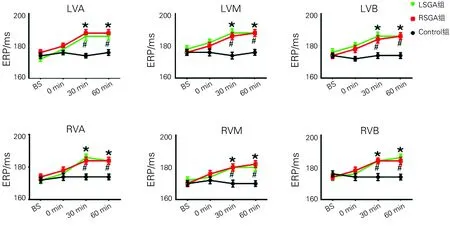
LVA=左室心尖部,LVM=左室中间部,LVB=左室基底部,RVA=右室心尖部,RVM=右室中间部,RVB=右室基底部。LSGA组与Control组比较,*P<0.05,RSNA组与Control组比较,#P<0.05
图1三组之间各部位心室ERP的比较
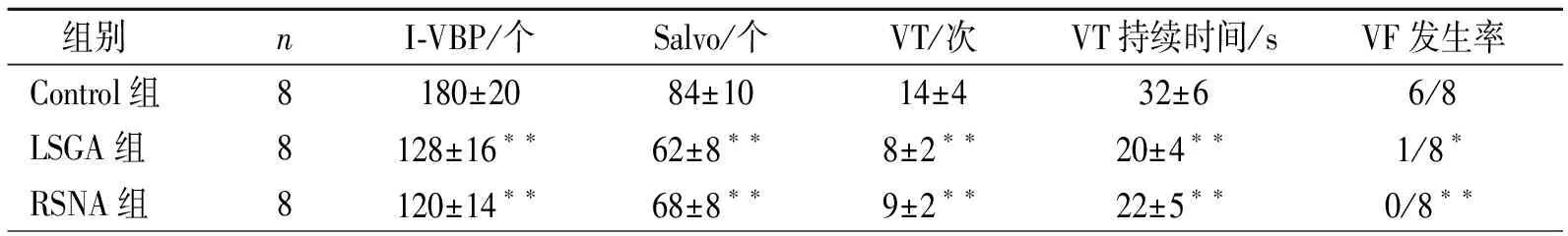
表2 不同组别心梗后1h内室性心律失常的比较
注:与对照组比较,*P<0.05; **P<0.01
大量临床数据及基础研究表明LSGA不仅可以减少I-VBP、Salvo、VT的出现,也可以有效减少心梗后室性电风暴、儿茶酚胺敏感性VT、长QT综合征并发VT等致命性室性心律失常的发生[6-9],目前临床上已有部分中心开展左侧星状神经节切除术来治疗上述疾病,并有确切效果。本研究结果与既往研究一致,行LSGA后,实验犬心室ERP明显延长,且心梗后室性心律失常的发生明显减少。
肾交感神经不仅在全身交感神经的调控中起重要作用,近年来研究表明肾交感神经对心脏也有调控作用,我们发现刺激肾交感神经可以增加左侧星状神经节活性并显著增加室性心律失常的发生[10],因此我们研究团队提出“心肾交感环路”的学说,认为心脏交感神经和肾交感神经之间存在交互作用,共同参与了对心脏自主神经的调控,肾交感神经可能通过传入神经进入中枢,中枢交感核团发出传入神经到达心脏进而调控心脏交感神经的活性[5, 11-12]。
本实验结果表明RSNA及LSGA后心率均显著下降,心室ERP明显延长,心梗后室性心律失常的发生均明显减少。因此,RSNA确实具有与LSGA相似的保护心梗后室性心律失常的作用。心梗后带来的心室重构及心功能的下降又是后期心力衰竭的重要原因,而交感神经活性的异常升高在其中发挥重要作用,RSNA除了如本实验所示可减少心梗急性期心律失常,对后期心室重构及心功能也可能发挥重要作用。
目前临床调控心脏交感神经手段有限,LSGA虽有确切效果,但因为左侧星状神经节内神经血管支配极为丰富,极易出现各种并发症,比如霍纳综合征、出血等,对操作者经验要求也较高,因此目前全球仅有极少数中心开展此术式。而RSNA不仅微创,且对心梗后室性心律失常具有与LSGA相似的作用,因此,对于临床心梗后频发室性电风暴的患者、恶性室性心律失常高危人群,RSNA或许是一种新的选择。
1 Meredith IT, BroughtonA, Jennings GL, et al. Evidence of a selective increase in cardiac sympathetic activity in patients with sustained ventricular arrhythmias [J]. The New England Journal of Medicine, 1991, 325(9): 618
2 Brodsky MA, Sato DA, Iseri LT, et al. Ventricular tachyarrhythmia associated with psychological stress. The role of the sympathetic nervous system [J]. JAMA, 1987, 257(15): 2 064
3 Wang S, Zhou X, Huang B, et al. Noninvasive low-frequency electromagnetic stimulation of the left stellate ganglion reduces myocardial infarction-induced ventricular arrhythmia [J]. Scientific Reports, 2016, 6:30 783
4 Asensio-Samper JM, Sanchis Lopen N, Valia Vera JC, et al. Left stellate ganglion block in treating electrical storm. Importance of ultrasonography [J]. Revista Espanola de Cardiologia, 2014, 67(1): 72
5 Huang B, Yu L, Jiang H. A potential link between left stellate ganglion and renal sympathetic nerve: an important mechanism for cardiac arrhythmias[J]? International Journal of Cardiology, 2015, 179:123
6 Wang S, Zhou X, Huang B, et al. Spinal cord stimulation protects against ventricular arrhythmias by suppressing left stellate ganglion neural activity in an acute myocardial infarction canine model [J]. Heart Rhythm,2015, 12(7): 1 628
7 Hofferberth SC, Cecchin F, Loberman D, et al. Left thoracoscopic sympathectomy for cardiac denervation in patients with life-threatening ventricular arrhythmias [J]. The Journal of Thoracic and Cardiovascular Surgery, 2014, 147(1): 404
8 Collura CA, Johnson JN, Moir C, et al. Left cardiac sympathetic denervation for the treatment of long QT syndrome and catecholaminergic polymorphic ventricular tachycardia using video-assisted thoracic surgery [J]. Heart Rhythm,2009, 6(6): 752
9 Schneider HE, Steinmetz M, Krause U, et al. Left cardiac sympathetic denervation for the management of life-threatening ventricular tachyarrhythmias in young patients with catecholaminergic polymorphic ventricular tachycardia and long QT syndrome [J]. Clinical Research in Cardiology,2013, 102(1): 33
10 Huang B, Yu L, Scherlag BJ, et al. Left renal nerves stimulation facilitates ischemia-induced ventricular arrhythmia by increasing nerve activity of left stellate ganglion [J]. Journal of Cardiovascular Electrophysiology, 2014, 25(11): 1 249
11 Yu L, Huang B, Zhou X, et al. Renal sympathetic stimulation and ablation affect ventricular arrhythmia by modulating autonomic activity in a cesium-induced long QT canine model [J]. Heart Rhythm,2017,14(6):912
12 Yu L, Huang B, Wang Z, et al. Impacts of renal sympathetic activation on atrial fibrillation: the potential role of the autonomic cross talk between kidney and heart [J]. Journal of the American Heart Association, 2017, 6(3).DOI: 10.1161/JAHA.116.004716

