雷诺定受体2在抑郁大鼠心房颤动中的作用*
储睿 殷瑛 周兴宇 石少波 朱刚艳
雷诺定受体2(RyR2)是位于心肌细胞肌浆网上重要的钙离子释放通道。Voigt等[1]研究发现心房颤动(简称房颤)发生时,RyR2功能改变,可介导肌浆网自发性钙释放增加,并引起持续性房颤。近年来临床数据证实焦虑、愤怒、压力、抑郁等应激相关情绪是房颤的独立危险因素[2]。焦虑、抑郁等直接影响心房电活动,触发房颤,其具体机制尚不清楚。笔者探讨RyR2在抑郁大鼠房颤发生中的作用,并运用RyR2拮抗剂丹曲林进行干预,旨在寻找房颤治疗新靶点。
1 材料与方法
1.1实验动物及分组 成年雄性SD大鼠70只,体重180~220 g,由武汉大学人民医院动物实验中心提供。所有动物在实验室适应性喂养1周后,采用完全随机设计方法将大鼠分为4组:正常对照组(CTL组,n=15),正常丹曲林组(DAN组,n=15),抑郁组(CUMS组,n=20),抑郁加丹曲林(C+D组,n=20)。CTL组和CUMS组每日腹腔注射2 ml/kg生理盐水,其余两组同时每日腹腔注射1%丹曲林(Sigam公司)药液2 ml/kg,连续4周。CUMS组和C+D组在给药的同时,给予不可预见的慢性温和刺激造成抑郁。
1.2抑郁模型制作 给予慢性不可预见性温和刺激(chronic unpredicted mild stress,CUMS)建立抑郁模型:禁食24 h,禁水24 h,夹尾1 min(夹在大鼠尾根部约1 cm处),鼠笼倾斜45° 24 h,潮湿垫料24 h,限制行为24 h,4℃冰水游泳5 min,42℃热水游泳5 min,持续光照24 h,捕食者声音30 min,摇晃鼠笼15 min。 将上述11种刺激随机安排到4周中,每天一种刺激。同种刺激不连续出现,使得动物不能预料刺激的发生,避免发生适应[3-4]。于实验前、实验中第7、14、21、28天测量大鼠体重。
1.3行为学评价 从第5周开始进行糖水消耗试验及强迫游泳实验(forced swimming test,FST)进行评估实验动物是否抑郁。糖水消耗实验参考文献[5],在实验前三天训练大鼠适应饮用糖水。每个鼠笼同时放置2个水瓶,第1天,两瓶均装1%的糖水:第二天,一瓶装1%的糖水,一瓶装纯水:随后禁水24 h,再进行大鼠的基础糖水/纯水消耗量。同时给予每只大鼠事先定量的1%糖水和纯水。2 h后,取两瓶水称量。计算动物的糖水偏爱百分比[糖水偏爱=糖水消耗/(糖水消耗+纯水消耗)×100%]。
FST参照文献[6],将大鼠放入直径为23 cm、高60 cm的测试桶中,桶中的水温为25℃±1℃。进行此实验前预先强迫大鼠游泳15 min,然后取出,用毛巾擦干身体上的水放回鼠笼。禁食但不禁水12 h后,再次强迫游泳6 min,前2 min让大鼠适应环境,记录后4 min中不动状态的时间。每只大鼠进行实验前更换桶中的水。
1.4离体灌流 实验动物在饲养4周结束,进行行为学评价后,开始进行离体灌流实验。具体方法如下:首先经腹腔注射肝素钠(华北制药有限公司)400 U对实验动物进行抗凝,10 min后腹腔注射2%苯巴比妥钠40 mg/kg,待大鼠深度麻醉后以颈椎脱臼处死。从胸骨左缘约1 cm处开胸,充分暴露心脏及主动脉根部,迅速取出心脏,置于100%氧饱和的4℃生理盐水中洗净残血,剪去心包膜及周围结缔组织,继而将灌流管插入主动脉根部连接灌流设备,经主动脉逆行灌注提前配置的台式液。灌流液保持37℃±0.5℃,并给予95%O2、5%CO2进行通气,灌流速度维持7~9 ml/min,灌注压维持80 mmH2O。对心脏进行修剪处理,剪去无法恢复自主节律的心脏组织。
1.5离体电生理研究 离体心脏组织在Langendorff装置中静待15 min,观察心脏的自主节律,待心脏自主节律稳定后,将刺激电极放置于右房,AgCl电极放置于左房位置记录心房的单相动作电位(monophasic action potential,MAP),MAP采用PowerLab放大器记录,并采用LabChart7.0软件分析。①有效不应期(effective refractory period,ERP)测定:连续发放8个起搏刺激波S1后发放早搏刺激波S2(S1S2=250 ms)。每次递减10 ms的降低S1S2间期,如果S2能诱发出动作电位,则继续以10 ms减少S1S2间期,当S2不能诱发出动作电位时,则将S1S2增加10 ms,然后以2 ms递减直至S2不能诱发出动作电位,此时S1S2间期即为左房的ERP。②连续发放8个起搏刺激S1(S1S1)分别给予250,200,150和100 ms周长(cycle length,CL)程控刺激,测心房的动作电位恢复90%的时程(APD90)。③运用Burst刺激诱发房颤,刺激电极和记录电极分别放置于右房和左房,刺激电极给予50 Hz持续时间2 s,间隔时间2 s的Trian刺激,总的刺激时间小于2 min,房性心律失常持续时间超过2 s即为可诱发。
1.6RyR2和磷酸化(P)-RyR2(2808)受体蛋白表达检测 取实验动物心房组织,迅速将标本放置于液氮中冷藏,防止蛋白变性,并置于-80℃冰箱冷冻保存至检测。按照蛋白抽提试剂盒说明书分离提取蛋白,配置相应浓度的PAGE胶,电泳后将蛋白转移至PVDF膜上,用5%的脱脂奶粉封闭,4℃孵育一抗过夜:RyR2 、P-RyR2(2808)。TBST洗涤后加入相应的氧化物酶(HRP)标记的二抗孵育,用ECL显影定影。以甘油醛-3-磷酸脱氢酶(GAPDH)作为上样内参,计算上述蛋白的相对表达量。抗体皆购买于Abcam公司,PVDF购于Millipore公司,HRP和GAPDH内参购买于杭州贤至生物有限公司。
1.7数据处理 用SPSS 21.0软件分析统计数据,计量资料用均数±标准差表示。两组间比较采用两个样本独立t检验,多组之间的比较用单因素方差分析;计数资料用百分率表示,两组间比较采用χ2检验。以P<0.05为差异有显著性。
2 结果
4周后,60只实验动物存活,CTL组、DAN组、CUMS组和C+D组最后分别入选13、14、15、18只大鼠,实验动物死亡率为14.3%。CTL组和DAN组大鼠在进行FST过程中死亡;CUMS组和C+D组大鼠在进行抑郁刺激过程中死亡。
2.14组动物体重和行为学结果比较 实验前,各组大鼠之间体重无差异,4周后,CUMS组体重增加较其他组少。4周后,CUMS组总的液体消耗量无明显变化而糖水消耗量明显减少,说明动物快感减少;C+D组糖水偏好百分比有所升高。CUMS组FST中静止时间明显长与其他组,C+D组实验结果有所改善。CTL组与DAN组各指标间无显著差异(P>0.05)。见表1。
2.2离体电生理结果 CTL组与DAN组之间ERP和APD90无差异(P>0.05)。与CTL组和DAN组比较,CUMS组中的ERP和APD90都减少(P<0.01),ERP/ APD90显著减少;C+D组ERP和APD90变化幅度较小(P<0.05)。与CTL和DAN组比较,C+D组上述指标降低;与CUMS组比较,C+D组,上述指标有所升高。见表2。
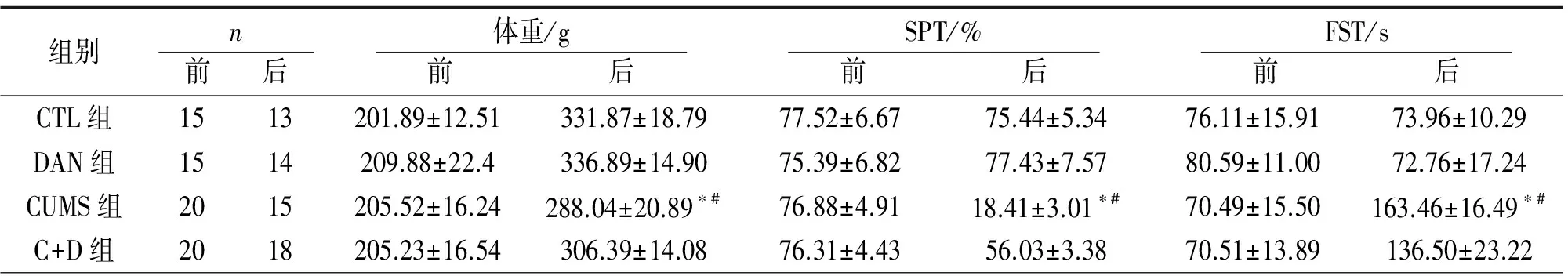
表1 4组动物体重和行为学评价结果比较
注:前=指开始进行4周刺激前;后=指4周刺激结束后;与CTL组比较,*P<0.05;与C+D组比较,#P<0.05
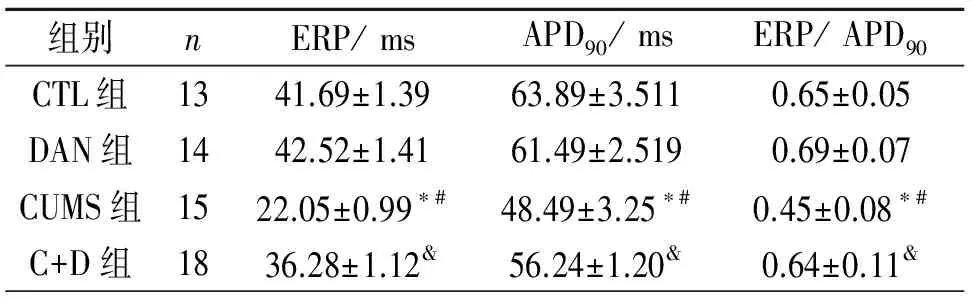
表2 4组动物相关电生理指标结果比较
注:ERP=有效不应期;APD90=90%动作电位时程;与CTL组比较:*P<0.05;与C+D组比较:#P<0.05;与CTL组和DAN组比较,&P<0.05
CUMS组大鼠房颤诱发率明显高于其他组(P<0.05);CTL组与DAN组无明显差异(0 vs 0,P>0.05);C+D组虽然可以诱发房颤,但房颤诱发率低于CUMS组(4/10 vs 10/10,P<0.05),而且停止Burst后,房颤自行停止时间较CUMS组短。见图1。
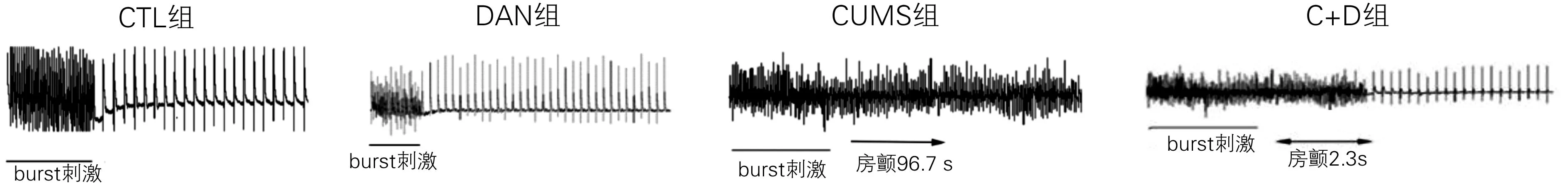
图1 4组Burst刺激下心电图
2.3蛋白表达水平检测 各组总RyR2受体表达量无显著差异(0.64±0.12 vs 0.62±0.08 vs 0.58±0.09 vs 0.59±0.10,P均>0.05);与CTL组比较,CUMS组P-RyR2(2808)表达量明显增加(0.64±0.11 vs 0.19±0.08,P<0.01),C+D组的P-RyR2(2808)较CUMS组有所减少(0.48±0.10 vs 0.64±0.11,P<0.01),CTL组和DAN组两者之间无明显差异(0.19±0.08 vs 0.21±0.06,P>0.05)。见图2。

图2 4组动物RyR2受体、P-RyR2(2808)表达量
3 讨论
国内外动物实验发现抑郁大鼠体内多项电生理指标异常,房颤诱发率增加,临床上也有相似的发现[7-8]。有研究表明,房颤发生时,RyR2功能改变,其介导的自发性钙释放增加,并引起持续性房颤[9-10]。RyR2是心肌细胞内肌质网(sarcoplasmic reticulum,SR)上重要的钙离子释放通道,可影响心肌细胞内游离钙离子浓度[11-12]。位于肌浆网上的RyR2功能异常可能是抑郁大鼠易于诱发房颤的重要原因。
本文旨在探究RyR2在抑郁大鼠房颤中的作用,并运用RyR2拮抗剂丹曲林进行干预,为房颤特别是应激诱导房颤的治疗提供新的指导。本实验采用目前国内外普遍接受的慢性应激抑郁模型,后期结果显示,抑郁大鼠活动度下降,体重增加减慢,糖水消耗量减少,FST静止时间增加;ERP反应心肌细胞膜去极化能力,而APD主要反映复极化速度;一般情况下,ERP/ APD90比值减小有利于心律失常的发生[13]。本研究中发现抑郁导致大鼠ERP/ APD90比值减小,并且房颤诱发率明显增加。抑郁模型中RyR2的S2808明显被磷酸化,丹曲林可以改善这种异常磷酸化;CTL与DAN组中上述蛋白无明显变化。文献表明丹曲林对正常离体心肌细胞肌浆网的RyR2无作用[14-15]。正常情况下,首先兴奋冲动传导到心肌细胞膜,激活细胞膜上钙诱导钙释放(Ca2+induced Ca2+release,CICR),继而为心肌收缩肌质网提供钙离子,引发心肌细胞兴奋收缩耦联(Ca2+induced Ca2+release,ECC)过程[16]。RyR2位于心肌细胞肌质网上钙离子释放通道,主要影响胞质内钙离子浓度。蛋白激酶A(protein kinase A; PKA)和钙调蛋白(calmodulimⅡ, CaMⅡ)分别可以过磷酸化RyR2上的ser2808,导致其功能异常出现舒张期钙漏[17-19]。
所以有理由推测RyR2功能异常是抑郁患者易于发生房颤的重要机制之一。本研究中抑郁组ser2808位点被过磷酸化,而用丹曲林治疗后过磷酸化情况好转。抑郁等应激刺激导致大鼠心脏RyR2受体功能异常,加用丹曲林可能通过阻断抑郁大鼠心肌肌浆网上功能异常RyR2受体,使得钙释放减少,从而减少大鼠房颤发生率,起到保护作用。
1 Voigt N, Heijman J, Nattel S. Calcium handling and atrial fibrillation[J]. Wiener Medizinische Wochenschrift, 2012, 162(13-14):287
2 Shi S, Tao L, Wang D, et al. Activation of N-methyl-d-aspartate receptors reduces heart rate variability and facilitates atrial fibrillation in rats[J]. Europace, 2016:euw086
3 刘金霞, 苗光新, 李建团,等. 皮下注射干扰素α大鼠抑郁模型的建立与鉴定[J]. 河北医学, 2017, 23(3):520
4 宋晓灵, 张芳, 曹莉莎,等. 氟西汀对抑郁大鼠模型海马CA1区、CA3区及齿状回区神经生长因子表达的影响[J]. 武汉大学学报(医学版), 2015, 36(2):185
5 张杨, 梁芯, 唐静,等. 抑郁症CUS模型大鼠海马内突触的改变及氟西汀对其作用的研究[C]. 中国体视学与图像分析学术会议. 2015
6 Porsolt RD, Bertin A, Jalfre M. Behavioral despair in mice: a primary screening test for antidepressants[J]. Archives Internationales De Pharmacodynamie Et De Thérapie, 1977, 229(2):327
7 苏立杰, 刘伟静, 吴先正,等. 焦虑、抑郁情绪对心房颤动患者生活质量的影响[J]. 临床内科杂志, 2013, 30(3):194
8 Patel D, Mc Conkey ND, Sohaney R, et al. A systematic review of depression and anxiety in patients with atrial fibrillation: the mind-heart link[J]. Cardiovascular Psychiatry & Neurology, 2013, 2013(2013):159 850
9 Dobrev D, Voigt N, Wehrens XH. The ryanodine receptor channel as a molecular motif in atrial fibrillation: pathophysiological and therapeutic implications.[J]. Cardiovascular Research, 2011, 89(4):734
10 Vest JA, Wehrens XH, Reiken SR, et al. Defective cardiac ryanodine receptor regulation during atrial fibrillation[J]. Circulation, 2005, 111(16):2 025
11 Bers DM. Ryanodine receptor S2808 phosphorylation in heart failure: smoking gun or red herring[J]. Circulation Research, 2012, 110(6):796
12 Dobrev D, Wehrens XH. Role of RyR2 phosphorylation in heart failure and arrhythmias: Controversies around ryanodine receptor phosphorylation in cardiac disease[J]. Circulation Research, 2014, 114(8):1 320
13 Frommeyer G, Kohnke A, Ellermann C, et al. Acute infusion of levosimendan enhances atrial fibrillation in an experimental whole-heart model[J]. International Journal of Cardiology, 2017,236(1):423
14 Paul-Pletzer K, Yamamoto T, Ikemoto N, et al. Probing a putative dantrolene-binding site on the cardiac ryanodine receptor[J]. Biochemical Journal, 2005, 387(Pt 3):905
15 Rueda A, de AlbaAguayo DR, Valdivia HH. Ryanodine receptor, calcium leak and arrhythmias[J]. Archivos De Cardiología De México, 2014, 84(3):191
16 Cheng H, Cannell M B. Calcium sparks - elementary events underlying excitation-con-traction coupling in heart muscle[J]. Science, 1993, 262(5134):740
17 Li N, Wang T, Wang W, et al. Inhibition of CaMKII phosphorylation of RyR2 prevents induction of atrial fibrillation in FKBP12.6 knock-out mice[J]. Circulation Research, 2012, 110(3):465
18 Curran J, Tang L, Roof SR, et al. Nitric oxide-dependent activation of CaMKII increases diastolic sarcoplasmic reticulum calcium release in cardiac myocytes in response to adrenergic stimulation[J]. Plos One, 2014, 9(2):e87 495
19 Voigt N, Li N, Wang Q, et al. Enhanced sarcoplasmic reticulum Ca2+leak and increased Na+-Ca2+exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation[J]. Circulation, 2012, 125(17):2 059

