微伏级T波电交替在急性心肌梗死不同再灌注时间中的临床意义
熊望琼 汪自龙
急性心肌梗死(acute myocardial infarction,AMI)再灌注后心律失常发病率达50%~80%,尤其是恶性室性心律失常(室性心动过速或室颤)会导致患者血流动力学改变,是缺血再灌注患者猝死的主要原因。目前已证实微伏级T波电交替(microvolt T-wave electrical alternation,MTWA)是预测恶性心律失常和心脏性猝死的一项无创检测方法[1]。本文采用动态心电图时域法测量AMI不同再灌注时间的MTWA,探讨其对恶性心律失常的预测价值以及对患者AMI后危险分层的影响。
1 资料与方法
1.1 一般资料
入选2018年1月至2019年10月我院收治的102例经皮冠状动脉介入(percutaneous coronary intervention,PCI)术后的AMI患者,其中男59例,女43例,年龄30~88(57.3±13.5)岁。AMI入选标准:心肌酶谱(主要是超敏肌钙蛋白)升高超过正常上限2倍,并伴有以下至少一项临床指征:① 缺血性胸痛或胸闷持续时间>30 min;② 新发生的缺血性心电图改变;③ 新的ST-T改变或左束支传导阻滞;④ 心电图病理性Q波形成;⑤ 影像学证据显示有新的心肌活性丧失或新发局部室壁运动异常[2-3]。
1.2 方法
AMI患者PCI术与安装Holter同时进行,24 h内行心脏超声检查,通过GE公司生产的MARS时域法MTWA分析系统,应用先进的量化至微伏级信号处理技术,对T波进行动态时域定量分析,以MTWA≥47 μV为阳性[4];同步检测心率变异、心率震荡。
心率变异主要分析SDNN(≤60 ms为阳性),心率震荡主要计算震荡初始和震荡斜率。震荡初始小于0表示室早后窦性心律的加速,等于0表示心率震荡消失,大于0表示室性早搏后初始窦性心律减慢。震荡斜率≤2.5 ms/R-R为阳性。血管造影由2名有经验的介入科医师实施,所有患者均成功再通,血流达到TIMI 3级别。根据Holter检查结果中有无室性心动过速(连续3个或以上的室性早搏,频率>100次/min),将患者分为室速组和非室速组。另以在本院体检中心进行体检各项指标显示正常的健康者100例作为对照组。分别比较AMI组与对照组、AMI患者PCI术后室速组、非室速组的MTWA最大值(maxMTWA)、射血分数(≤40%为阳性)、心率变异和心率震荡值;比较室速组、非室速组心肌肌钙蛋白、AMI部位以及冠状动脉病变(单支或多支)有无明显差异。最后将3组的上述心电生理参数及一般资料进行统计学分析,同时观察PCI术后24 h内哪些时段恶性心律失常发生率最高,出现恶性心律失常前多长时间MTWA最大、最具预测价值。
1.3 统计学分析
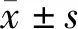
2 结果
AMI组maxMTWA明显高于对照组(P<0.05),震荡斜率、SDNN和射血分数值均显著低于对照组(P<0.05或<0.01),震荡初始间差异亦有统计学意义(P<0.05)。见表1。
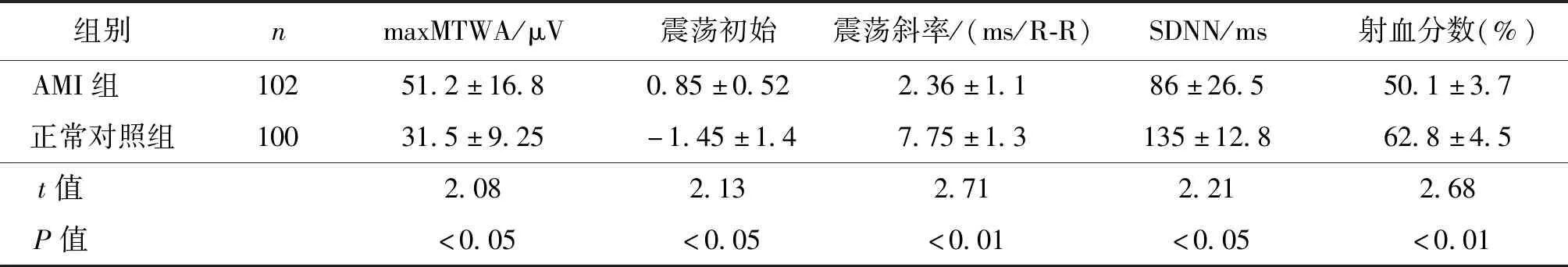
表1 AMI组与正常对照组的maxMTWA、震荡初始、震荡斜率、SDNN、射血分数比较
102例AMI患者中,47例(46.1%)出现室速(室速组),室速心率在100~202次/min,55例(53.9%)无室速(非室速组)。两组年龄、性别、高血压史、糖尿病史、罪犯血管、ST段抬高幅度均值间的差异均无统计学意义(P均>0.05);但室速组的平均心室率、超敏肌钙蛋白浓度均显著高于非室速组(P均<0.05)。见表2。
室速组maxMTWA、震荡初始明显高于非室速组,而射血分数、震荡斜率明显低于非室速组(P均<0.05);两组SDNN差异无统计学意义(P>0.05)。见表3。
室速组MTWA、震荡初始、震荡斜率、射血分数的阳性率明显高于非室速组(P均<0.01),SDNN阳性率无明显差异(P>0.05),见表4。上述参数对AMI患者发生室速的灵敏度、特异度、阳性预测值以及阴性预测值见表5,其中MTWA的灵敏度、特异度、阳性预测值以及阴性预测值最大。

表2 室速组与非室速组一般临床资料比较
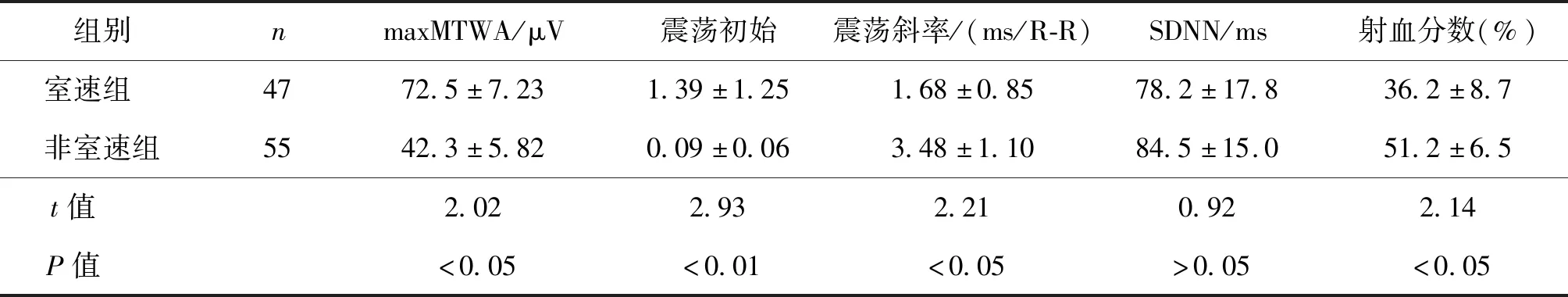
表3 室速组、非室速组急性心肌梗死患者maxMTWA、震荡初始、震荡斜率、SDNN、射血分数比较

表4 室速组、非室速组MTWA、震荡初始、震荡斜率、SDNN、射血分数阳性率比较

表5 MTWA、震荡初始、震荡斜率、SDNN、射血分数对AMI患者发生室速的预测价值
室速组最长一串室速出现前15 min的MTWA值为(82.9±10.2)μV,而30 min和60 min时的MTWA值分别为(65.3±11.5)μV、(57.2±9.5)μV。其中室速出现前15 min的MTWA值明显高于30 min和60 min(P均<0.01)。室速出现的时间节点多数集中在血流再通后1~3 h。
3 讨论
有文献报道,成功PCI且血流达TIMI 3级,ST段在30 min内恢复与室性心动过速不相关,相比之下,MTWA持续升高与室性心动过速正相关[5]。本文结果也符合这一观点,即室速组ST段抬高幅度与非室速组无统计学差异,室速组maxMTWA明显高于非室速组(P均<0.05)。本文通过对比分析室速组与非室速组maxMTWA、心率震荡、心率变异、射血分数等参数,发现室速组maxMTWA和震荡初始(代表室早后加速现象)明显高于非室速组,震荡斜率(代表其后的减速现象)和射血分数明显低于非室速组,两组SDNN则无明显差异。以MTWA≥47 μV、震荡初始>0、震荡斜率≤2.5 ms/R-R、SDNN≤60 ms、射血分数≤40%为阳性指标,室速组MTWA、震荡初始、震荡斜率、射血分数的阳性率明显高于非室速组,MTWA的灵敏度、特异度、阳性预测值、阴性预测值均最高。上述结果说明MTWA在预测室性心动过速中最有价值。心率变异受个体内、外神经体液因素影响较大,心率震荡为室性早搏后窦性心律先加速后减速的现象,主要是压力反射机制,若室性早搏很少则无意义。射血分数值与超声医师的技术相关,重复性较差。本文采用时域法(GE MARS动态心电图分析系统MTWA时域法分析程序),应用先进的量化至微伏级的信号处理技术,通过减少噪音、伪差、异位心搏等干扰,对T波进行动态的时域定量分析,在方法学及测量精准度等方面均优于以往的频域法,且24 h心电信息量大,同步观测MTWA与恶性室性心律失常,加之Holter普及率高,无需运动,所以被测试的人群更广,是为广大AMI患者在临床上提供预测恶性室性心律失常及心脏性猝死最具有价值的无创心电生理检测指标,可对AMI后高危人群进行危险分层,以便早期进行干预。
通过比较最长一串室速出现前15 min、30 min、60 min各时间段的MTWA值,发现室速出现前15 min MTWA值最大,且室速出现的时间节点多数集中在血流再通后1~3 h。这说明再灌注后1~3 h及室速出现前15 min心肌电活动最不稳定,心肌复极的离散度及不均一性最大;此时间段应格外注意抗心律失常(包括药物、电除颤)治疗。
MTWA主要发生机制是细胞内外游离钙离子循环障碍,心肌细胞内游离钙离子不能充分完成循环,钙离子浓度发生瞬间变化,会扰乱钙离子的正常分布,导致动作电位时程长短交替、心肌细胞复极的不均一性、交感神经活性增加。其反映心电不稳定是以上多因素相互作用的结果,而非仅心肌缺血一方面,如体内儿茶酚胺分泌增加、心肌瘢痕、畸形等[6]。心肌缺血时,引起有效不应期缩短,再灌注最初几秒钟内,使之更为缩短,进一步增加了缺血区和非缺血区间不应期的离散度和心电不稳定性,动作电位时程长短交替,心肌细胞复极不均一,所以发生折返的概率大,恶性室性心律失常发生率增高。另外,室速组平均心室率高于非室速组,说明交感神经兴奋,儿茶酚胺分泌增多,参与了电风暴的发生。
AMI患者早期PCI血流恢复与心电不稳定相关,心肌梗死后,室性心律失常的病理基础是微观、宏观水平的心脏重构,包括结构重构、电重构和神经重构[6]。最近,Takasugi等[7]研究了20例行急诊PCI手术的急性冠脉综合征(不稳定型心绞痛、非ST段抬高型心肌梗死、ST段抬高型心肌梗死)患者。约2/3的患者需要心脏电复律来治疗致命性心律失常,在事件的开始,V1和V5导联MTWA值分别为75 μV和105 μV。再灌注治疗之前,在这13例发生心血管事件的患者中,MTWA较没有快速心律失常的患者显著增高,发生恶性室性心律失常前15 min MTWA值最高,本文与此研究结果相符。而这些没有发生快速心律失常的患者,再灌注治疗前后,MTWA的水平均较低。因此,伴有室性心律失常的患者具有高水平MTWA,MTWA增高是室性心律失常需要电除颤治疗的先兆。再灌注损伤是AMI中最常见的临床问题,是影响AMI住院期间死亡率及远期预后的主要原因。对于MTWA阳性患者,再灌注前尤其血流再通后1~3 h可用胺碘酮等抗心律失常药物预防再灌注后恶性心律失常的发生,增加患者术后存活率,预防猝死发生。

