无标记筛选G-四链体小分子配体的荧光新方法
任有良, 刘道广, 张 悦, 温 恒, 乔成芳, 刘 萍*
(1.商洛学院化学工程与现代材料学院,陕西商洛 726000;2.陕西省尾矿资源综合利用重点实验室,陕西商洛 726000)
端粒DNA(GDNA)是富含G碱基的高度保守的重复核苷酸序列,在K+、Na+等阳离子以及一些药物小分子的存在下,通过Hoogsteen氢键形成稳定的G -四链体结构[1-4]。研究表明,能够诱导端粒DNA形成G -四链体结构的小分子化合物具有重大的抗肿瘤意义,而以G -四链体为抗肿瘤药物作用靶点筛选配体的方法是目前研究的热点。
寻找以端粒DNA为作用靶点,毒性低的抗肿瘤药物引起了科研工作者的极大的兴趣。目前人们采用紫外吸收光谱、荧光光谱、电化学、圆二色光谱、核磁共振波谱、X-射线衍射、表面等离子体共振等多种方法[5-10],从不同角度来研究GDNA与小分子配体的相互作用。荧光光谱法具有操作简单、灵敏度高、响应速度快,尤其是已经被广泛应用的基于构型转换的荧光共振能量转移(FRET)方法是研究GDNA与配体之间作用机理的一个重要方法。Simonsson和SjÖback研究小组[6]在单链GDNA的两端分别标记荧光基团和猝灭基团,在一些金属离子或者四链体配体的作用下,GDNA自身折叠形成G -四链体,引起荧光共振能量转移导致荧光强度减低,可以通过荧光强度的变化来检测G -四链体的形成。Jin等[11]基于荧光共振能量转移,用纳米金作为猝灭剂,5′标记荧光素(FAM)的人端粒DNA(F-GDNA)作为探针,设计了一端标记的、简单快速地筛选G -四链体配体的方法。虽然GDNA与小分子配体的荧光分析方法有很多,但是这些方法大多需要荧光标记,操作复杂,仪器昂贵,成本较高。因此非常有必要建立一些简单、快速并且能够被广泛应用的方法来筛选与G -四链体作用的配体。
中药单体是天然化合物的提取物,研究发现一些中药单体像槲皮素、芦丁、白杨素、大豆苷元等黄酮类化合物[12-15]对肿瘤治疗有一定的化学预防作用。本文以天然抗肿瘤中药单体槲皮素作为研究对象,基于GDNA结构的转变,构建了一种无标记荧光方法考察GDNA与槲皮素的相互作用,根据N-甲基卟啉二丙酸Ⅸ(NMM)/GDNA体系中加入槲皮素前后荧光强度的变化,快速有效地筛选能够诱导GDNA形成G -四链体结构的药物,为抗肿瘤药物的开发和研究以及肿瘤的临床治疗等提供重要的。
1 实验部分
1.1 仪器与试剂
F-4600型日立荧光分光光度计(日本,日立公司);UV-1600PC型紫外-可见分光光度计(上海美谱达仪器有限公司);pHS-3C型pH计(上海精密科学仪器有限公司);TGL-18C离心机(上海安亭科学仪器厂)。
人端粒DNA(F-GDNA):(5′-TTAGGGTTAGGGTTAGGGTTAGG-3′),RDNA:(5′-GTTCATGCCGCCCATGCTCG-3′)由上海生物工程有限公司合成,用TE缓冲溶液(10 mmol/L Tris-HCl,1 mmol/L EDTA,pH=7.2)配制成100 μmol/L的储备液;槲皮素、芦丁、大豆苷元、黄连素、木犀草素、山奈酚、苦参碱、绿原酸、黄连素、熊果酸等(上海金穗生物科技有限公司)均用无水乙醇溶解,用超纯水配制成浓度为100 μmol/L的母液;NMM(北京百灵威科技有限公司)、EDTA、无水乙醇等所用试剂均为分析纯。实验缓冲体系为pH=7.2的10 mmol/L Tris-HCl;用水均为Milli-Q(18.2 MΩ·cm)超纯水。
1.2 实验方法
1.2.1荧光光谱法取100 μL 5 μmol/L NMM溶液于微量比色皿中,测量其荧光光谱。向NMM溶液中加入1 μL 100 μmol/L GDNA,混合均匀后放置15 min,测定其荧光强度(F0);然后向体系中加入2 μL浓度为100 μmol/L槲皮素溶液,混合均匀后放置30 min,测定其荧光强度(F)。
激发光源采用氙灯激发,激发波长λex为610 nm,发射波长λem为600~700 nm,激发与发射光狭缝均为10 nm,光电倍增管电压950 V。
1.2.2紫外-可见吸光光谱法移取2 mL 8 μmol/L NMM溶液于1 cm为石英比色皿中,测量其紫外光谱。向NMM溶液中加入5 μmol/L GDNA,混合均匀后放置15 min,测量其紫外光谱,然后再分别加入浓度为2 μmol/L和10 μmol/L的槲皮素溶液,混合均匀后放置30 min,进行紫外检测。
2 结果与讨论
2.1 实验原理
NMM是一种特殊的阴离子卟啉化合物,能够与G -四链体特异性结合,而对单链、二链体、三链体都无特异性结合[16-17]。NMM游离状态时,荧光强度微弱,但NMM与G -四链体结合后,荧光强度显著增强[18-19]。NMM已经广泛应用于DNA[20]、核酸酶[18]和一些生物小分子检测。本文基于NMM与G -四链体的特异性结合,通过考察槲皮素与NMM/GDNA 作用前后体系荧光强度的变化,实现筛选 G -四链体小分子配体的目的。实验原理见图1。

图1 无标记筛选G -四链体小分子配体的实验原理Fig.1 Schematic illustration of label-free screening small molecule ligands of G-quadruplex
2.2 实验可行性分析
2.2.1荧光光谱为验证方法的可行性,我们选取槲皮素作为研究对象,分别测量了NMM、NMM/GDNA、NMM/GDNA+槲皮素体系的荧光强度。结果如图2所示,NMM溶液荧光强度很低,当与 GDNA结合后,NMM的荧光强度有所增加,可能是NMM的环境改变引起,加入槲皮素配体后,体系的荧光强度明显增强。可能是槲皮素诱导GDNA形成G -四链体结构,NMM嵌入G -四链体结构中后使体系荧光强度大大增强。
为验证实验体系荧光强度的增加是因为槲皮素与GDNA相互作用形成了G -四链体,选择了一条对照链RDNA,这条链含有少量鸟嘌呤G碱基,在其它条件不变的情况下,将GDNA换成RDNA,研究不同浓度槲皮素对NMM/RDNA的荧光强度的影响。结果表明,不同浓度的槲皮素不能使NMM/RDNA体系荧光强度增加。只有在NMM/GDNA体系里加入槲皮素,荧光强度才有明显的增加,这与实验原理相符合,即槲皮素能够诱导单链的端粒DNA折叠形成G -四链体,从而使体系的荧光强度大大增强。
为进一步验证实验原理,还考察了一种生物碱类小分子苦参碱(Matrine)与NMM/GDNA体系的作用,在其它条件不变的情况下,研究不同浓度苦参碱对NMM/GDNA的荧光强度的影响,实验所取条件与槲皮素相同,结果如图3所示。从图中可以看出,在NMM/GDNA体系中加入2、4、6、8和10 μmol/L的苦参碱以后,体系的荧光强度几乎没有改变,说明苦参碱不能诱导GDNA形成G -四链体结构。结果表明,苦参碱也不能使体系荧光强度增加,只有在NMM/GDNA体系中加入槲皮素,才能使体系的荧光强度得到增强,进一步说明槲皮素能够诱导GDNA形成G -四链体。

图2 NMM/GDNA体系与槲皮素作用的荧光光谱Fig.2 Fluorescence emission spectra of NMM/GDNA+Quercetina:5 μmol/L NMM;b:5 μmol/L NMM+1 μmol/L GDNA;c:b+2 μmol/L Quercetin.

图3 NMM/GDNA体系与苦参碱作用的荧光光谱Fig.3 Fluorescence emission spectra of NMM/GDNA+Matrinea:NMM;b:NMM/RDNA;c - g:2,4,6,8,10 μmol/L Matrine.
2.2.2紫外-可见吸收光谱实验还采用紫外-可见吸光光谱法来考察槲皮素与GDNA之间的相互作用。实验结果如图4所示,可以看出在NMM/GDNA体系中加入槲皮素后体系的吸收光谱发生了减色现象,可能是配体与G -四链体的氢键对发生π电子堆积,配体嵌插到G -四链体结构中,插入的配体π*空轨道与碱基的π电子轨道发生耦合,耦合后π*轨道因部分填充电子,使π-π*跃迁几率减小,产生了减色效应[5]。吸收光谱变化越大减色效应越明显,表明嵌入程度越强。实验结果也说明了槲皮素能诱导GDNA形成了G -四链体结构,并嵌插入G -四链体中从而引起减色效应。

图4 不同浓度的槲皮素与GDNA/NMM体系的紫外-可见(UV-Vis)吸收光谱Fig.4 UV-Vis absorption spectra of GDNA/NMM with different concentrations of Quercetina:8 μmol/L NMM;b:5 μmol/L GDNA;c:2 μmol/L Quercetin;d:8 μmol/L NMM+5 μmol/L GDNA;e:d+2 μmol/L Quercetin;f:d+10 μmol/L Quercetin.
2.3 实验条件的优化
2.3.1稳定时间的选择实验考察了槲皮素与NMM/GDNA体系荧光强度随时间的变化关系。5 μmol/L NMM+1 μmol/L GDNA,混匀放置15 min,向该体系中加入2 μmol/L槲皮素后,每隔5 min测量该体系的荧光强度。结果显示随着作用时间的增加,体系荧光强度逐渐增加,但到30 min时,荧光强度变化趋于稳定,说明槲皮素与NMM/GDNA已经充分作用,实验选择混合30 min后测定。
2.3.2NMM浓度的选择NMM的浓度对传感器的荧光信背比产生显著的影响。为了优化实验条件,考察了不同浓度NMM对体系荧光强度变化的影响。结果可以看出随着荧光染料的浓度逐渐增加,传感器的荧光变化值逐渐增加,当浓度增加为5 μmol/L后,传感器的荧光强度变化达到最大。若继续增加的浓度,传感器的背景信号也会增大,荧光强度变化反而减小,实验选择NMM的浓度为5 μmol/L。
2.4 槲皮素浓度变化对 NMM/GDNA体系荧光强度的影响
实验考察了槲皮素浓度与NMM/GDNA体系荧光强度变化之间的关系。结果如图5(A)、5(B)所示。从5(A)可以看出:随着槲皮素浓度逐渐增加,体系的荧光强度也在增强,这说明槲皮素的增加使得越来越多的GDNA形成了G -四链体,使得体系的荧光强度增大,同时也说明槲皮素是一种能够诱导GDNA形成G -四链体的小分子配体。图5(B)表示不同浓度槲皮素与体系荧光强度变化的点线图及线性关系。结果显示槲皮素浓度在2~10 nmol/L时与体系荧光强度变化呈良好的线性,检出限0.7 nmol/L,线性方程[(F-F0)/F0]=0.0473c+0.0157(c的单位为nmol/L),R=0.9972。
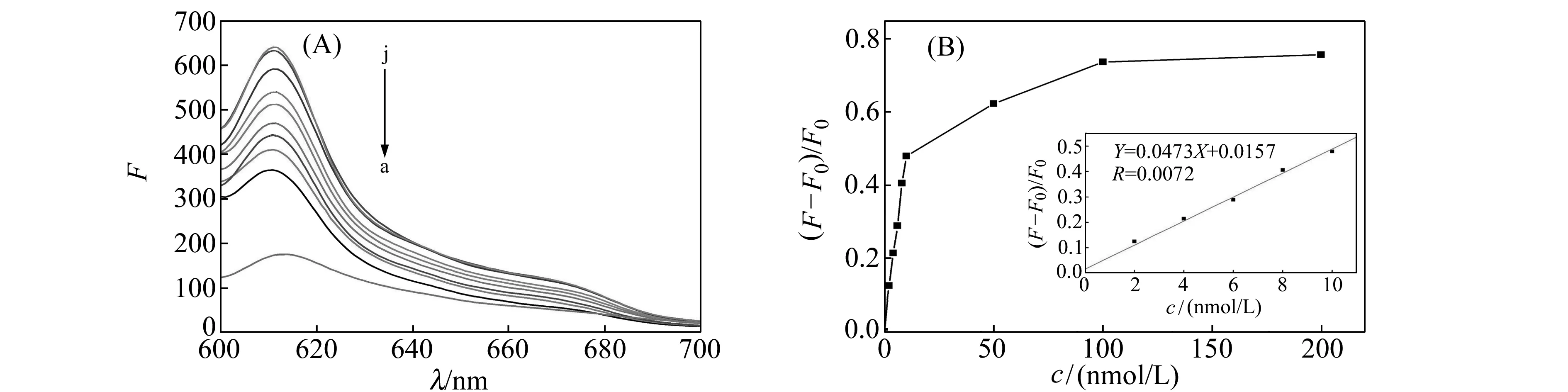
图5 (A)不同浓度槲皮素与GDNA/NMM体系作用荧光光谱;(B)槲皮素浓度与GDNA/NMM体系荧光强度变化的点线图和校准曲线Fig.5 (A) Fluorescence emission spectra of GDNA/NMM in presence of Quercetin with different concentration;(B)Point plots of change rate of fluorescence intensity GDNA/NMM with the increasing of Quercetin concentration and the calibration plots for QuercetinNMM:5 μmol/L;GDNA:1 μmol/L;Quercetin:b-f:0,2,4,6,8,10,100,200,1 000 nmol/L.
2.5 诱导GDNA形成G -四链体的小分子配体筛选
应用本方法考察了黄酮类化合物、生物碱、蒽醌类化合物和有机酸(表1)等小分子化合物,这些小分子化合物是从中药中提取出来的天然抗肿瘤药物小分子。通过考察加入药物前后NMM/GDNA体系荧光强度的变化来反映不同药物对体系的影响,从而来识别G -四链体的配体。表中ΔF=F-F0,其中F和F0分别表示不存在和存在药物的情况下NMM/GDNA体系的荧光强度。结果发现,在相同实验条件下黄酮类化合物都能使NMM/GDNA体系的荧光强度有一定程度的增加,而生物碱类、蒽醌类化合物(大黄素)及有机酸却变化不大。说明黄酮类化合物能促使GDNA形成G -四链体,而生物碱类、蒽醌类和有机酸等化合物难以诱导GDNA形成G -四链体结构。

表1 加入不同药物引起NMM/GDNA体系荧光强度变化
*The concentration of NMM,GDNA and ligands are 5 μmol/L,1 μmol/L and 2 μmol/L,respectively.
3 结论
本文以槲皮素为研究对象,荧光染料NMM为指示剂,利用其与G -四链体结构特异性结合的特点,构建了一种在均相溶液中筛选 G -四链体小分子配体的荧光新方法。研究发现黄酮类化合物能促使GDNA形成G -四链体,而生物碱类和有机酸等化合物难以诱导GDNA形成G -四链体结构。该方法不仅用于考察槲皮素与 GDNA 的作用,还可以用于筛选与 G -四链体作用的离子、蛋白质、合成的药物等小分子配体,对抗肿瘤药物的开发和研究,肿瘤的临床治疗等有重要的理论和实际意义。
参考文献:
[1] Blackburn E H,Szostak J W.Annual Review of Biochemistry,1984,53:163.
[2] Wag Y,Patl D J.Journal of Molecular Cell Biology,1993,4(234):1171.
[3] Ying L,Green J J,Li H,et al.Proceedings of the National Academy of Sciences,2003,100(25):14629.
[4] Guo L Q,Nie D D,Qiu C Y,et al.Biosensors and Bioelectronics,2012,1(35):123.
[5] Mei H Y,Barton J K.Journal of the American Chemical Society,1986,9(108):7414.
[6] Simonsson T,SjÖback R.Journal of Biological Chemistry,1999,24(274):17379.
[7] Balagurumoorthy P,Brahlnaehari S K,MohantyD,et al.Nucleic Acids Research,1992,15(20):4061.
[8] Redman James E.Methods,2007,4(43):302.
[9] Sun H X,Xiang J F,Tang Y L,et al.Biochemical and Biophysical Research Communications,2007,4(352):942.
[10] LIU P,CHEN F Y,XIONG Z D,et al.Journal of Analytical Science(刘萍,陈凤英,熊泽东,等.分析科学学报),2015,31(6):851
[11] Jin Y,Li H Y,Bai J Y,Analytical Chemistry,2009,81(14):5709.
[12] Sun H X,Tang Y L,Xiang J F,et al.Bioorganic & Medicinal Chemistry Letters,2006,13(16):3586.
[13] Sun H X,Xiang J F,Tang Y L,et al.Biochemical and Biophysical Research Communications,2007,4(352):942.
[14] Cushnie T P T,Lamb A J.Antimicrob Lamb,International Journal of Anti-Microbial Agents,2005,5(26):343.
[15] Spedding G,Ratty A,Middleton E.Antiviral Research,1989,2(12):99.
[16] Sayal A,Aydin A,Savaser A,et al.Toxicology Letters,2008,180:81.
[17] Guo L Q,Nie D N,Qiu C Y,et al.Biosensors and Bioelectronic,2011,1(35):123.
[18] Hu D,Huang Z Z,Pu F,et al.Chemistry A European Journal,2011,17(5):1635.
[19] Qin H,Ren J,Wang J,et al.Chemical Communications,2010,46(39):7385.
[20] Zhao C Q ,Wu L,Ren J S,et al.Chemical Communications,2011,47(19):5461.

