适用于黄酒米浆水处理的酵母菌的筛选
孙士勇 , 曹 钰 *,2, 陆 健 ,, 蔡国林 , 马素梅
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;3.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
米浆水是黄酒酿造过程中浸米工序的副产物,传统黄酒酿造,浸米时间比较长,比如传统的摊饭法酿酒时,浸米时间就长达16~20 d。现在机械化黄酒生产工艺中一般采用较高的温度保温浸米,浸米的时间减少,但是仍需要4~5 d[1]。程斐等使用生物酸化浸米的方法,人工接种乳酸菌进行浸米,快速提高米浆水的酸度,将浸米时间缩短为2 d[2-3]。米浆水中含有十分丰富的淀粉、蛋白质、糖类、有机酸等,其中氨基酸的种类多达18种,还有微量元素、B族维生素和矿物质等[4]。米浆水产量非常巨大,生产1 t黄酒大约要产生0.65 t米浆水。2014年我国黄酒产量达到330万t左右,按照测算总共产生约214.5万t米浆水。采用厌氧-好氧方式处理米浆水,每吨大约花费2元以上,加上设备购置和维护费用,米浆水的处理带来了很大的负担,同时也是对营养物质的浪费。
目前对米浆水的资源化利用还比较局限,俞关松等[5]把新鲜的米浆水作为复制糟香型白酒的投料用水,但受到酿造季节的约束,有一定的局限性。周高峰等[6]添加75%的米浆水来代替自来水制作黄酒熟麦曲。姜佳丽等[7]考察了用米浆水来替代制曲配料用水制备酱油生产用米曲霉、黑曲霉和红曲霉的制曲效果。但作为制曲用水,整体消耗量较小。
类胡萝卜素是一类广泛存在于动植物和微生物体内的脂溶性色素,已被用于药物、保健食品、饲料和化妆品的生产中[8-12]。类胡萝卜素对动物和人体具有十分重要的作用,不仅可以作为维生素A的前体[13],同时还具有很强的抗氧化性,能清除体内的自由基[14],动物和人体内的类胡萝卜素只能从外界获取[15-16]。可以产生类胡萝卜素的酵母主要有红酵母属(Rhodotorula),锁掷酵母属(Sporidiobolus),法夫酵母属(Phaffia),掷孢酵母属(Sporobolomyces)和红冬孢酵母属(Rhodosporidium)[17-21]。采用酵母生产类胡萝卜素具有营养要求简单、发酵周期短和发酵条件易于控制等优点[22]。
作者在环境中分离筛选了一株近玫色锁掷酵母,一方面可以利用米浆水中的营养物质,降低米浆水的COD,大大减轻废水处理压力,另一方面也可以生产单细胞蛋白(SCP)和类胡萝卜素,提高了经济效益。
1 材料与方法
1.1 培养基
YPD培养基:蛋白胨20 g/dL,酵母膏10 g/dL,葡萄糖20 g/dL,pH自然;
富集培养基:蛋白胨20 g/dL,酵母膏10 g/dL,葡萄糖20 g/dL,链霉素0.005 g/dL,pH自然;
酸性YPD培养基:蛋白胨20 g/dL,酵母膏10 g/dL,葡萄糖20 g/dL,调pH至 3.5;
淀粉培养基:(NH4)2SO40.5 g/dL,KH2PO40.1 g/dL,NaCl 0.01 g/dL,MgSO4·7H2O 0.05 g/dL,CaCl20.01 g/dL,酵母膏 0.02 g/dL,淀粉 2 g/dL,pH6.5;
乳酸培养基:(NH4)2SO40.5 g/dL,KH2PO40.1 g/dL,NaCl 0.01 g/dL,MgSO4·7H2O 0.05 g/dL,CaCl20.01 g/dL,酵母膏 0.02 g/dL,用乳酸调 pH 至 3.5~3.7;
MRS培养基:葡萄糖2 g/dL,蛋白胨1 g/dL,乙酸钠0.5 g/dL,牛肉膏1 g/dL,柠檬酸氢二铵0.2 g/dL,酵母膏 0.5 g/dL,MgSO4·7H2O 0.058 g/dL,吐温80 0.1 g/dL,MnSO4·4H2O 0.025 g/dL,K2HPO40.2 g/dL,pH 6.2~6.4。
1.2 生物酸化浸米浆水(BAS)的制备及成分分析
称取一定质量糯米,按1∶1.25的米水比加水,接种植物乳杆菌进行生物酸化浸米,30℃浸渍2 d后,过滤得到生物酸化浸米浆水(BAS,Bio-acidified Seriflux)。测定米浆水的pH、总酸、总糖、淀粉、蛋白质、氨基酸态氮、氨态氮和COD。
1.3 菌株的分离
1.3.1 一级筛选 在学校及附近生活区采集水样、土样、花草、食品样本,于富集培养基中富集过夜,涂布于YPD固体培养基,30℃培养2 d,挑取红色菌落,镜检观察是否为酵母菌。
1.3.2 二级筛选 将第一步筛选到的产色素酵母菌株接种到酸性YPD培养基中,30℃、200r/min振荡培养72 h,测定培养后的pH、生物量、色素产量,同时将菌液离心后用无菌水洗涤两次,用等体积无菌水重悬,30℃放置2 h进行饥饿处理,滴加在乳酸平板和淀粉平板上,30℃培养72 h,观察菌株对乳酸和淀粉的利用情况,综合考虑,筛选出性能较优的菌株。
1.3.3 三级筛选 将上一步筛选的酵母菌株接种到YPD培养基过夜作为种子液,将菌液离心后用无菌水洗涤两次,用等体积无菌水重悬,以5%的接种体积分数接种于BAS(装液量20%)中,30℃,200r/min培养48 h,测定pH、细胞数、色素产量、COD去除率,选择综合性能最优的菌株。
1.4 菌株R-70的形态特征
显微形态:挑取酵母菌培养液稀释一定倍数,吸取一滴在洁净的载玻片上,盖上盖玻片,用高倍镜观察细胞的形状、大小和生殖方式。
菌落形态:将新鲜培养的酵母菌在YPD平板上划线,30℃培养3 d,观察菌落的颜色、质地、表面和边缘形状等特征。
1.5 菌株R-70的生理学特征
对酵母菌进行糖发酵、碳源同化、氮源同化、脲酶试验和生长温度试验,方法参照《酵母菌的特征与鉴定手册》[23]。
1.6 菌株R-70的分子生物学鉴定
使用酵母基因组DNA快速抽提试剂盒提取酵母的总DNA, 使用通用引物NL-1 (5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL-4(5'-GGTCCGTGTTTCAAGACGG-3') 对菌株 26S rDNA近5'端的D1/D2区域进行PCR扩增,目标产物的长度大约为600 bp,PCR反应条件为:94℃变性 1 min,53℃退火 1 min,72℃延伸 1 min,36个循环。PCR产物经琼脂糖凝胶电泳分析,回收后纯化,由上海生物工程有限公司进行序列测定,根据测序结果,在NCBI上用BLASTN对扩增序列进行同源性比较,用MEGA5.0软件中的Neighbor-Joining分析方法进行分子系统分析,构建系统发育树,并进行1 000次的Bootstraps检验。
1.7 菌株R-70在BAS中的生长情况
将筛选的红酵母接种到经过60℃处理30 min的BAS中,30℃、200r/min振荡培养72 h,每隔4小时取样,血球计数板法测定细胞数,R-70菌株的色素为胞内色素,使用酸热法破壁后用丙酮提取色素并测定[24],离心后烘箱法[25]测定上清液的COD。
1.8 BAS中接种菌株R-70培养后的成分变化
将筛选的红酵母接种到经过60℃处理30 min的BAS中,30℃、200r/min振荡培养72 h,每隔4小时取样,测定培养液的pH,靛酚蓝-分光光度法[26]测定氨态氮质量浓度,测定培养液的还原糖和氨基酸态氮,测定方法参考国标GB/T 13662-2008。
2 结果与讨论
2.1 生物酸化浸米浆水(BAS)的成分分析
自然浸渍的米浆水受到米种类、产地来源、水温等多种因素影响,其组成和COD存在差异和波动显著现象。为保障研究工作的开展,作者采用生物酸化浸米浆水进行实验。称取一定质量糯米,按1∶1.25的米水比加水,接种植物乳杆菌进行生物酸化浸米,30℃放置2 d后,过滤得到BAS,测定成分,结果见表1。
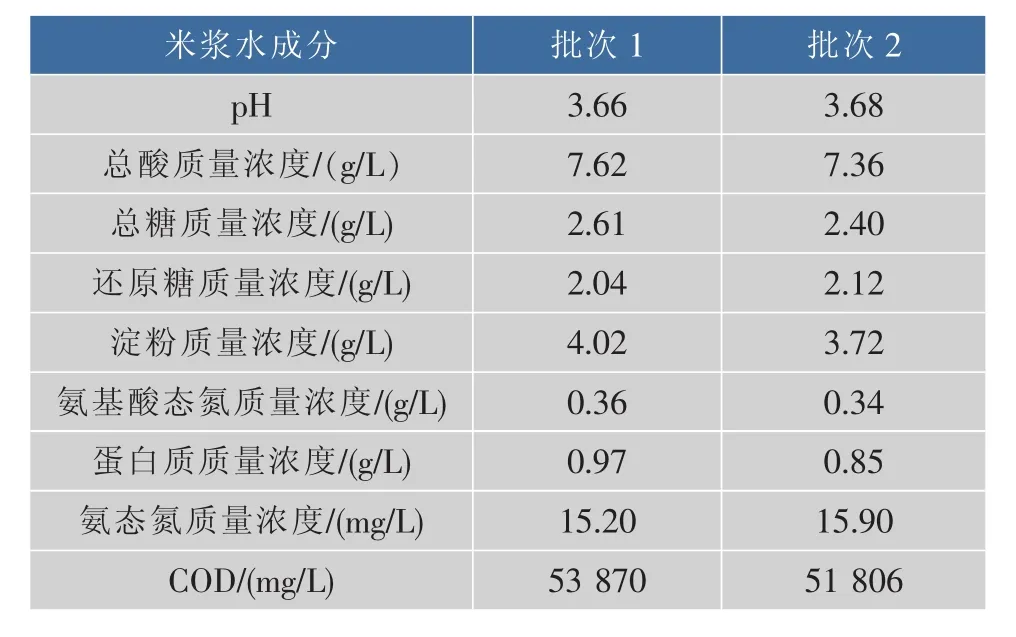
表1 BAS的成分分析Table 1 Component analysis of Bio-acidified Seriflux
由表1可以看出,米浆水营养丰富,经过生物酸化浸米的米浆水,成分比较稳定,有利于后期发酵过程的稳定性。生物酸化浸米得到的米浆水,pH较低,含有一定的淀粉和有机酸,其中有机酸主要为乳酸,约占88.98%,在后期的筛菌过程中,除生长情况和COD降解率外,也考察菌株对淀粉和乳酸的利用情况。
2.2 菌株的筛选
在环境中分离筛选到108株红色酵母菌株,测定菌株的生物量、色素产量和色素质量分数,并且考察了各菌株对淀粉和乳酸的利用能力,部分筛选结果见表2。
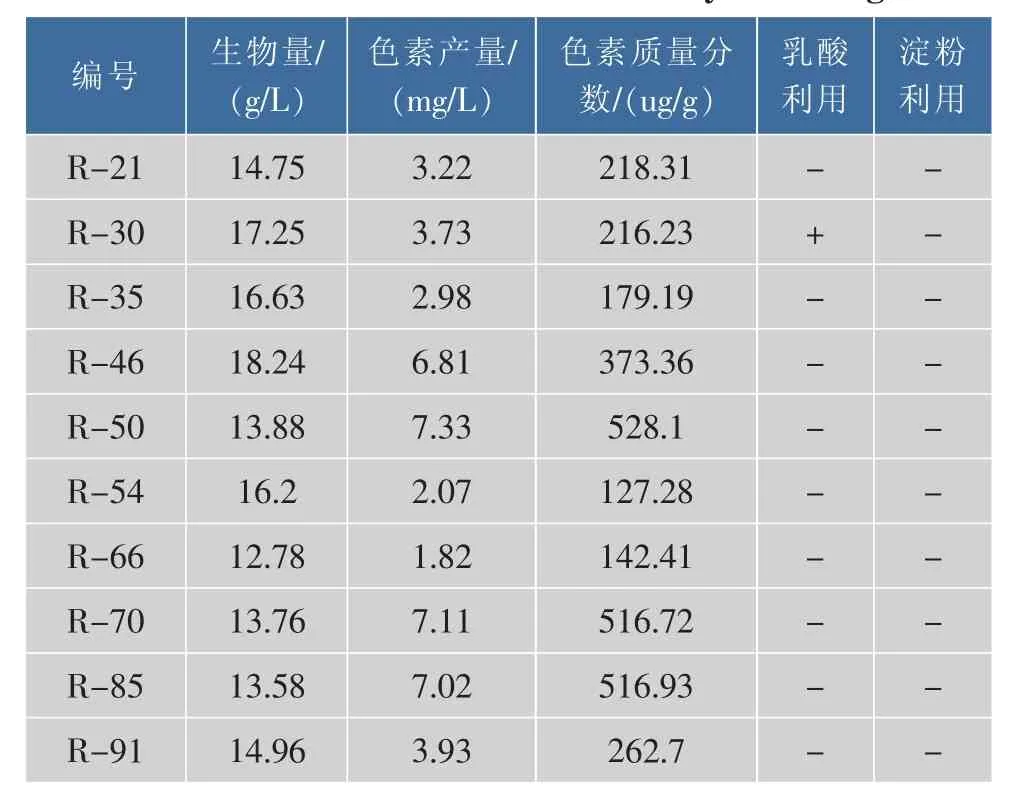
表2 二级筛选的部分结果Table 2 Part of results of secondary screening
R-30可以以乳酸为惟一碳源,R-46、R-50、R-70和R-85菌株的产色素能力较强,选择这5株相对较优的酵母菌株进入下一步筛选。
分别接种到YPD液体培养基中,振荡培养24 h,用无菌水洗涤2次,制备种子液。以5%的接种体积分数接种于BAS中,30℃、200r/min振荡培养48 h,分别测定培养前后的米浆水各个指标,结果见表3。
R-70菌株对米浆水COD的降解率最高,达到90.38%,色素产量也是最高,达到5.57 mg/L,处理后的发酵液pH相较于其他四株酵母都要低,为8.41。此外,R-30菌株可以以乳酸为惟一碳源生长,但是其他特性相对较差。综合考虑,选择R-70菌株作为利用米浆水的最优菌株。
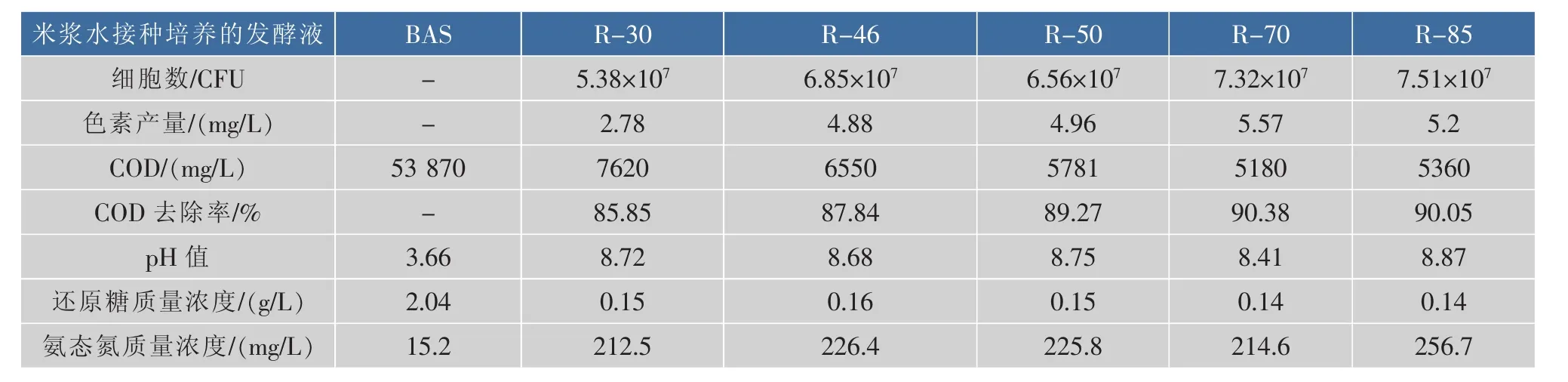
表3 菌株在BAS中的培养筛选结果Table 3 Results of strain inoculated in BAS
2.3 菌株的形态特征
R-70菌株菌落呈橘红色,表面湿润,边缘平滑,易挑起。菌体呈椭球形,大小约为(3.0~4.5)μm×(6.0~9.5) μm,以出芽方式进行繁殖,见图 1。
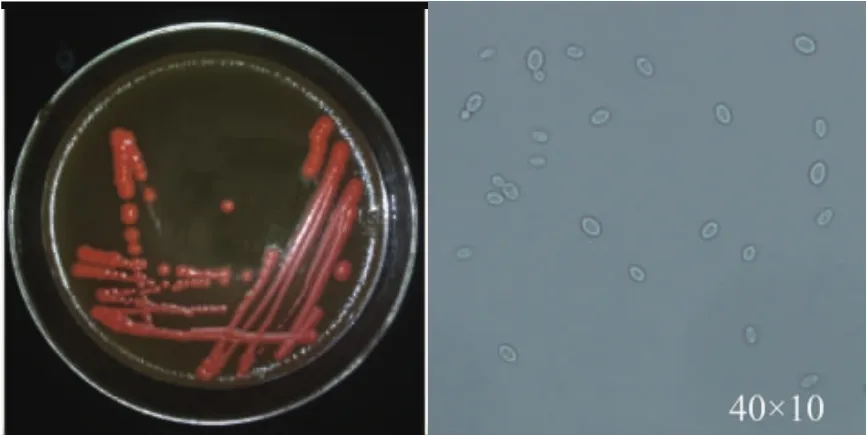
图1 R-70菌株的形态特征Fig.1 Morphological character of R-70
2.4 序列分析和系统发育树的构建
以通用引物进行PCR扩增,经1 g/dL琼脂糖凝胶电泳,得到片段长度大约为600 bp的扩增产物,见图2。
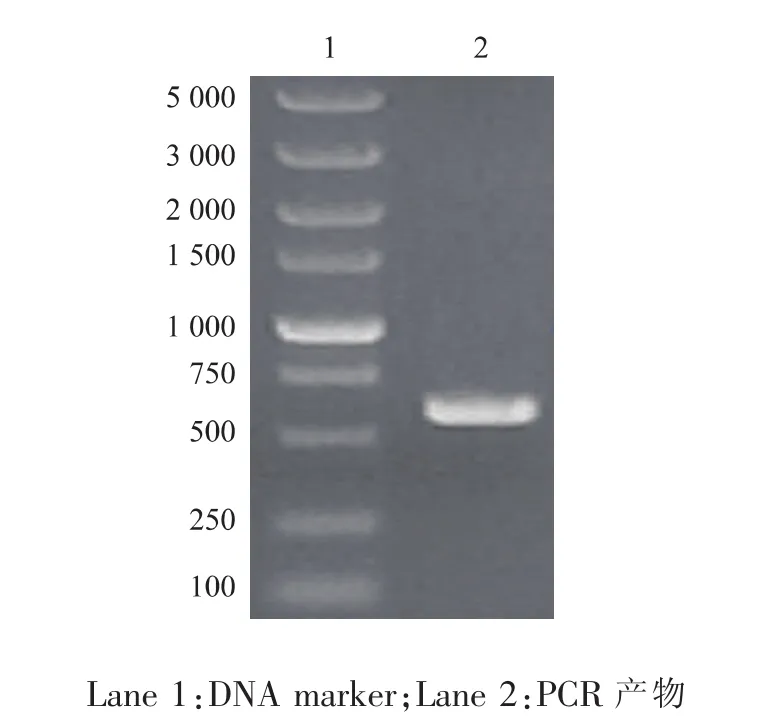
图2 菌株R-70的26S rDNA的PCR产物电泳图Fig.2 Electrophoresis of PCR products of 26S rRNA of R-70
回收并纯化PCR产物,进行测序。将测得的DNA序列在NCBI上用BLASTN进行同源性比较,用MEGA5.0软件中的Neighbor-Joining分析方法进行分子系统分析,构建系统发育树构建系统发育树,结果见图3。

图3 R-70的系统发育进化树Fig.3 Phylogenetic tree of strain R-70
结果表明,菌株R-70与Sporidiobolus pararoseusNL8208205的同源性达到97%,亲缘关系最近,由此可初步确定R-70菌株为Sporidiobolus pararoseus(近玫色锁掷酵母)。
2.5 菌株的的生理学特征
2.5.1 糖发酵实验 参考《酵母菌的特征与鉴定手册》,对R-70进行了糖的发酵实验,结果见表4。R-70菌株对这几种糖都不发酵产气。
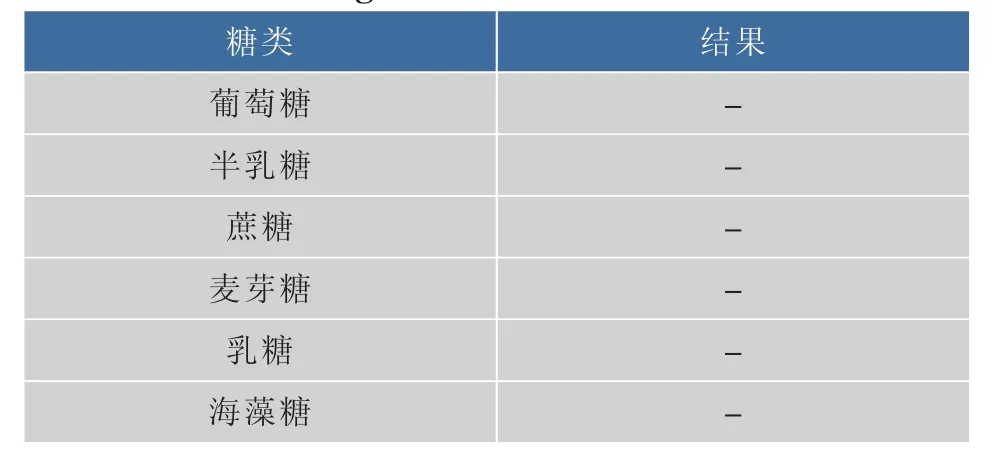
表4 R-70的糖发酵实验Table 4 Sugar fermentation tests of R-70
2.5.2 碳氮源同化实验及其他生理特征 对R-70菌株进行碳源、氮源同化实验,脲酶试验和生长温度试验,结果见表5。
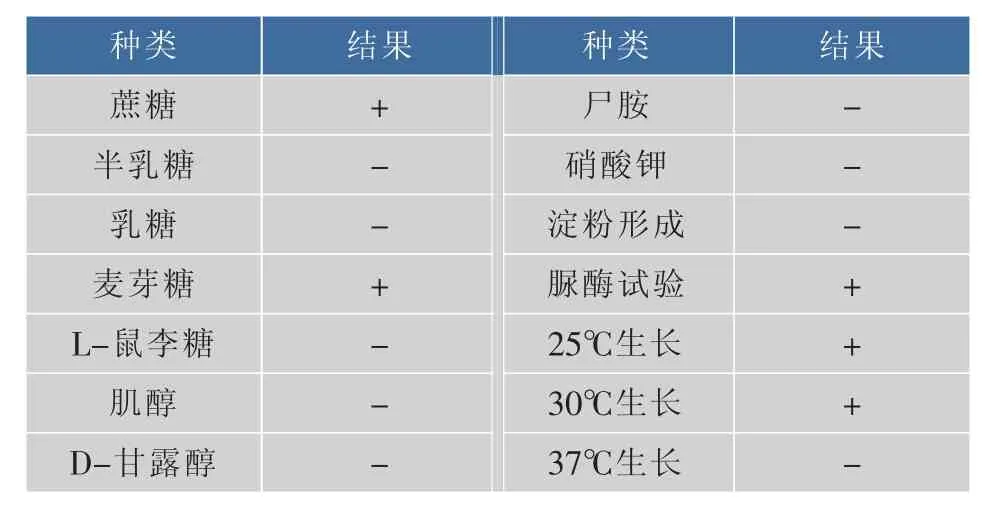
表5 R-70的生理生化特征Table 5 Physiological characteristic of R-70
通过比对 《酵母菌的特征与鉴定手册》,菌株R-70的生理特征鉴定结果为近玫色锁掷酵母,与经26S rDNA分子鉴定的结果一致。
2.6 R-70菌株在BAS中的生长情况
将近玫色锁掷酵母R-70接种到YPD培养基中,30℃、200r/min培养过夜,作为种子液,用无菌水洗涤两次,以6%的接种体积分数接种到经过60℃处理30 min的BAS中,30℃、200r/min振荡培养72 h,每隔4小时取样,测定细胞数、色素产量、pH,结果见图4。
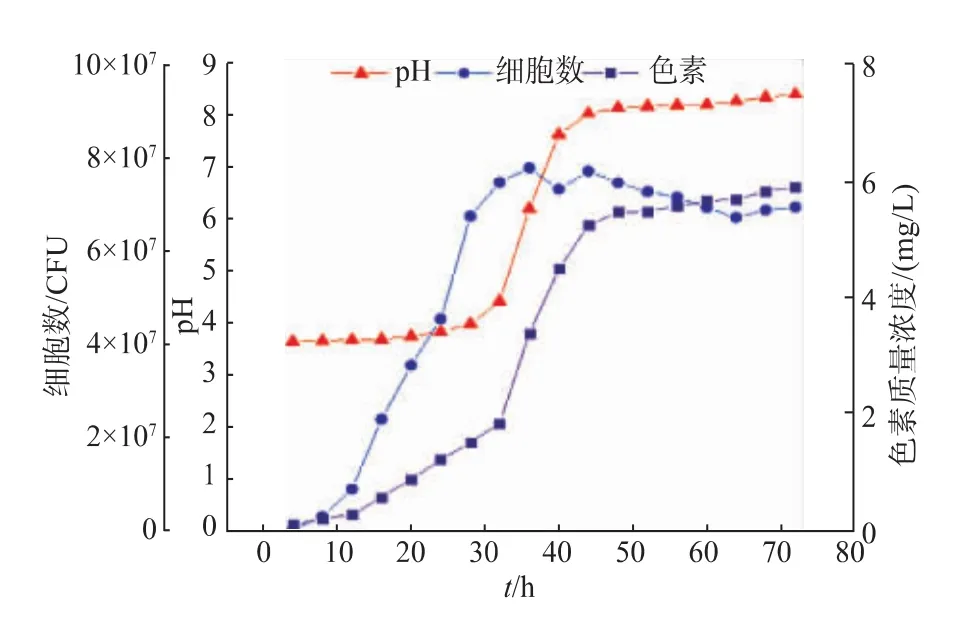
图4 R-70在米浆水中的生长情况Fig.4 Growth curves of R-70 inoculated in BAS
由图4可以看出,酵母数在36 h达到最大,为7.8×107/mL,之后呈缓慢下降趋势,R-70所产色素主要是类胡萝卜素,属于次级代谢产物,36 h开始有一个较快的增加速度,在44 h达到一个较高值5.26 mg/L,之后缓慢增加,72 h的色素产量为5.92 mg/L。米浆水的初始pH为3.68,随着培养时间的增加,米浆水的pH呈上升趋势,在28 h左右pH升高速度加快,在44 h左右之后趋于平缓,升高速度变慢,72 h的pH达到8.44,可能与R-70产脲酶有关,R-70在生长过程中产氨,使pH升高。
2.7 米浆水成分的变化
将R-70菌株接种YPD培养基中,30℃、200r/min培养过夜,作为种子液,用无菌水洗涤两次,以6%的接种体积分数接种到经过60℃处理30 min的BAS中,30℃、200r/min振荡培养72 h,每隔4小时取样,8 000 r/min离心5 min,测定上清液中的COD、还原糖和氨态氮,结果见图5。
BAS的初始COD为51 806 mg/L,接种R-70培养后上清液的COD变化见图5。到44 h达到最低,COD为4 600 mg/L,COD去除率达到91.12%,之后呈升高趋势。还原糖呈现下降趋势,40 h下降到一个较低值,之后基本保持不变。上清液中氨态氮质量浓度的变化与R-70菌株产脲酶有关,在前期质量浓度较低,随着培养时间的延长而缓慢增加,40 h左右之后增加速度加快,72 h的氨态氮质量浓度为1.45 g/L,R-70在发酵过程中产氨的量可以将米浆水中的乳酸中和并且氨过量,使发酵液呈碱性。
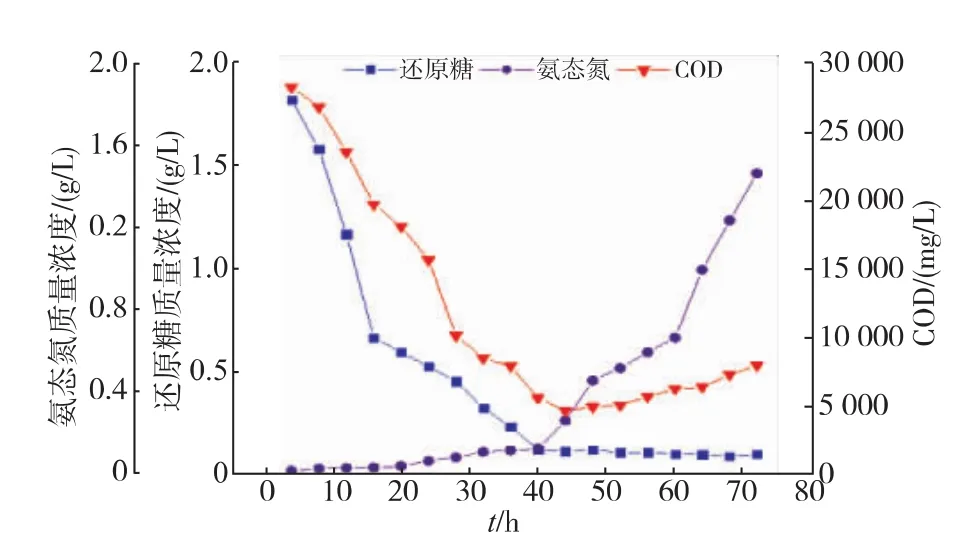
图5 BAS发酵后上清液成分的变化情况Fig.5 Change of composition in BAS supernatant
3 结 语
黄酒生产中的浸米浆水产量大,营养物质丰富。从环境中筛选到一株红色酵母R-70,经过26S rDNA分子鉴定,确定该酵母为近玫色锁掷酵母,在米浆水中培养,可以有效地降解米浆水的COD,减轻废水处理的压力,而且可以产生高附加值的单细胞蛋白和类胡萝卜素,具有良好的应用价值。
参考文献:
[1]谢广发.黄酒酿造技术[M].北京:中国轻工业出版社,2010.
[2]CHENG Fei,ZHOU Gaofeng,XIE Guangfa,et al.Screening of lactic acid bacteria suitable for biological acidification of rice soaking in Chinese rice wine[J].Journal of Food Science and Biotechnology,2013(10):1079-1084.(in Chinese)
[3]XIE Guangfa,CAO Yu,CHENG Fei,et al.Effect of biological acidification soaking technology on Chinese rice wine brewing[J].Journal of Food Science and Biotechnology,2014(2):217-223.(in Chinese)
[4]LI Haixia,HE Guoqing,LOU Fengming,et al.Studies on the organics composition and microbes enrichment of rice seriflux during Yellow rice wine production[J].Journal of Chinese Institute of Food Science and Technology,2011,11(8):168-174.(in Chinese)
[5]YU Guansong,MAO Qingzhon.The baptist rice seriflux of Chinese rice wine for the water back to the copy bad xiang bad liquor feed water research[J].Liquor Making,2012,39(5):71-72.(in Chinese)
[6]ZHOUGaofeng,CHENGFei,ZHANGBo.Theapplicationofricemilkintheproductionofcookedwheatstarter[J].Liquor-Making Science & Technology,2015(3):38-42.(in Chinese)
[7]JIANG Jiali,LI Pinger,QIU Xianzhong,et al.Study onAspergilluscultivation in soy sauce with rice milk[J].China Condiment,2013,38(7):54-58.(in Chinese)
[8]FRENGOVA G I,BESHKOVA D M.Carotenoids from Rhodotorula and Phaffia:yeasts of biotechnological importance[J].Journal of Industrial Microbiology&Biotechnology,2009,36(2):163-180.
[9]KIM J H,KIM S W,NGUYEN D,et al.Production of β-carotene by recombinantEscherichia coliwith engineered whole mevalonate pathway in batch and fed-batch cultures[J].Biotechnology and Bioprocess Engineering,2009,14(5):559-564.
[10]JIMENEZ E A,JIMENEZ J I,SANCHEZ M C.Evaluation of free radical scavenging of dietary carotenoids by the stable radical 2,2-diphenyl-1-picrylhydrazyl[J].Journal of the Science of Food&Agriculture,2000,80(11):1686-1690.
[11]KIOKIAS S,GORDON M H.Antioxidant properties of carotenoids in vitro and in vivo[J].Food Reviews International,2004,20(2):99-121.
[12]LEE J H,OZCELIK B,MIN D B.Electron donation mechanisms of β-carotene as a free radical scavenger[J].Journal of Food Science,2003,68(3):861-865.
[13]CARLO D,RIEDL K,SURESHBABU N,et al.The human enzyme that converts dietary provitamin A carotenoids to vitamin A is a dioxygenase[J].Journal of Biological Chemistry,2014,289(19):13661-13666.
[14]SLADJANA S,GORDANA C,JASNA C B,et al.Tomato waste:carotenoids content antioxidant and cell growth activities[J].Food Chemistry,2015,172:225-32.
[15]OLSON J A.Biological actions of carotenoids[J].Faseb Journal,1989,3(8):1927-1932.
[16]YANG Boyuan,HUI Boli.Carotenoids in the natural food chain[J].China Food Additives,2013,1:189-197.(in Chinese)
[17]BUZZINI P.Batch and fed-batch carotenoid production byRhodotorula glutinis-Debaryomyces castellii co-cultures in corn syrup[J].Journal of Applied Microbiology,2001,90(5):843-847.
[18]BHOSALE P,GADRE R V.β-Carotene production in sugarcane molasses by aRhodotorula glutinismutant[J].Journal of Industrial Microbiology&Biotechnology,2001(26):327-332.
[19]BHOSALE P,GADRE R V.Manipulation of temperature and illumination conditions for enhanced beta-carotene production by mutant 32 ofRhodotorula glutinis[J].Lett Appl Microbiol,2002(34):349-353.
[20]DAVOLI P,MIERAU V,WEBER R S.Carotenoids and fatty acids in red yeastsSporobolomyces roseus and Rhodotorula glutinis[J].Appl Biochem and Microbiol,2004,40(4):392-397.
[21]GOODWIN T W.Carotenoids in fungi and non-photosynthetic bacteria[J].Progress in Industrial Microbiology,1972,11:29-88.
[22]HAN Mei,GE Xiangyang,QIAN He,et al.Study on carotenoids fermentation conditions bySporidiobolussp.[J].Science and Technology of Food Industry,2011,12:239-242.
[23]巴尼特.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991.
[24]WANG Suilou,WEI Jun,CHEN Chuntao,et al.Study on the fermentation of carotenoids in Red Yeast[J].Journal of Zhengzhou Institute of Light Industry,2000(2):3-7.(in Chinese)
[25]BI Huizhen.The fast method to determine the chemical oxygen demand(COD)for water quality[J].Environmental Protection and Technology,2012,18(1):31-33.(in Chinese)
[26]LIANG Jianguang,ZHU Ling,XU Zhengjun.Study on the determination of NH4+-N content in microbial fermentation liquor by indophenol blue spectrophotometric method[J].Food and Fermentation Industries,2006,32(9):134-137.(in Chinese)

