7种生物菌剂对西瓜枯萎病的防治作用
翟子鹤 李伟强 傅士杰 庞建文 张晓腾 吕桂云
(河北农业大学园艺学院,河北保定 071001)
西 瓜〔Citrullus lanatus(Thunb.)Matsum &Nadai〕是一种世界性园艺作物,也是世界十大果品之一,我国是世界上最大的西瓜生产国和消费国。西瓜枯萎病是半知菌亚门镰孢属尖孢镰刀菌西瓜专化型(Fusarium oxysporumf. sp.niveum,FON)寄生引起的一种世界范围的真菌土传病害(Martyn,2014),病菌从根毛的细胞间隙或根部伤口进入植物根系,并在寄主的维管束大量繁殖,分解破坏寄主的细胞结构,以致导管堵塞,影响水分传递,导致植株萎蔫(L ü et al.,2011,2014),从幼苗至西瓜成熟均可发生,以开花、抽蔓到结瓜期发病最重,病田一般减产30%左右,更严重的高达50%,甚至绝产,已成为限制西瓜产业可持续发展的主要因素之一(Zhang et al.,2005;Martyn,2014)。对于该病的防治主要有抗病育种、轮作换茬、嫁接及药剂防治等。由于土地资源有限,轮作方法不易实施;嫁接操作繁琐,成本高,易影响其品质;目前市场上虽然部分品种对西瓜枯萎病菌生理小种1表现抗性,但还没有一个品种能抗西瓜枯萎病的所有生理小种;化学防治易产生环境污染、农药抗性及农药残留等问题,且迄今为止还没有一种化学农药可以有效地控制枯萎病的发生(Zhang et al.,2005;L ü et al.,2011)。因此针对西瓜枯萎病,生物防治成为了新的研究方向。
西瓜枯萎病的生防菌主要包括真菌、细菌、放线菌等。应用于防治西瓜枯萎病的真菌有木霉属真菌(Trichoderma)、丛枝菌根真菌(Arbuscular Mycorrhize,AM)、非致病尖孢镰刀菌等;细菌有芽孢杆菌(Bacillusspp.)、假单胞菌(Pseudomonasspp.)、内生细菌;其他的生防因子还有细菌和真菌联合、抗生素等。生防菌通过重寄生、抗生作用、溶菌作用、竞争作用、促进植物生长和诱导植物增加抗性等机理提高西瓜对Fusarium oxysporum. f.sp.niveum的抗性(纪明山 等,2002;Ling et al.,2011;Zhao et al.,2012;Faheem et al.,2015;Raza et al.,2015)。河北农业大学园艺学院蔬菜栽培课题组在前期研究中发现,西瓜的抗、感品种根系都可被枯萎病菌侵染,抗、感的差异主要在病菌的侵染数量上(L ü et al.,2014),而生物防治可以维持生防因子与枯萎病菌之间的某种平衡,较长期地降低病原菌密度,达到控制病害的目的。前人的研究多集中在某一种生防菌的作用上,本试验在前人的研究结果基础上,同时比较了木霉、枯草芽孢杆菌、放线菌等多种菌剂对西瓜枯萎病的防治效果,旨在为西瓜土传枯萎病生物防治提供理论依据和技术支持。
1 材料和方法
1.1 试验材料
供试西瓜品种选用对枯萎病表现不同抗性的西瓜品种西农8号(中抗)和早佳8424(高感);枯萎病菌生理小种1(Fusarium oxysporumf. sp.niveumrace1),采自北京市通州区西瓜枯萎病病株,由北京市农林科学院蔬菜研究中心许勇研究员惠赠;生物菌剂及对应的菌株由其相应的公司提供(表1)。其中S5和S7均为放线菌菌剂,但菌株不同;S4和S6的菌株一样,但S6在菌剂中添加了一些生长调节剂和营养元素,S4枯草芽孢杆菌菌剂含枯草芽孢杆菌300亿个·g-1;S6西瓜专用菌剂:枯草芽孢杆菌益生菌≥300亿个·g-1,另含有抗病因子、生长因子及多种活性微量元素Si、K、Ca、Mg、Fe、Zn、Cu、Mo、Mn、Sr、Ni、V、Li、Se、Co、Cr等。

表1 生物菌剂
1.2 试验方法
1.2.1 西瓜种子处理 取饱满优质的西农8号和早佳8424西瓜种子放入0.5%的NaClO溶液中消毒20 min,浸种6 h后置于27~29 ℃恒温箱中催芽,种子露白后播种。
1.2.2 育苗 育苗基质为草炭∶蛭石=2V∶1V,各菌剂按使用说明与育苗基质混合,每个处理25株,3次重复,以不加菌剂的育苗基质为对照,采用营养钵育苗,常规管理。
植株三叶一心时,各处理随机取样10株,测定株高(茎基部到植株顶部的距离)、茎粗(用游标卡尺测定茎基部上方1 cm 处直径)、叶片数、地上部鲜质量、地下部鲜质量、地上部干质量、地下部干质量,并计算根冠比和壮苗指数。

1.2.3 接种西瓜枯萎病菌 植株三叶一心时进行接种处理,用西瓜枯萎病菌孢子悬浮液(浓度为5×106个孢子·mL-1)10 mL灌根,灌根前先疏松幼苗根系土壤。每个处理10株,3次重复,以清水处理为对照。接种15 d后统计病情指数(吕桂云 等,2010)及防病效果(甘良 等,2015)。

1.2.4 生防菌株对西瓜枯萎病菌生长的影响 采用平板对峙法,将生防菌和西瓜枯萎病菌各取直径约5 mm的菌片,枯萎病菌置于PDA平板直径1/3处,平板另一侧1/3处接生防菌,二者进行对峙培养。每个菌种3次重复,以只接入枯萎病菌的处理为对照,置于25 ℃条件下培养,待对照长满全皿时,测量西瓜枯萎病菌菌株的菌落直径并计算抑菌率(甘良 等,2015)。

用提前灭好菌的毛笔,将对峙培养中西瓜枯萎病菌的孢子分别轻轻扫至烧杯中,加入25 mL蒸馏水,配成孢子悬浮液,取100 μL涂布于PDA平板上,25 ℃培养4 d,计数病原菌菌落个数,以正常病原菌的孢子为对照,每个处理3次重复。将平板对峙试验中被抑制的西瓜枯萎病菌菌丝接种到PDA平板正中央,置于恒温箱中25 ℃条件下培养,以正常生长的西瓜枯萎病菌菌丝作为对照,连续观察6 d。测量并记录病原菌菌落直径,以确定被抑制的西瓜枯萎病菌菌丝的再生长能力。每个处理3次重复。
1.3 数据分析
试验数据采用Excel 2010和SPSS 20.0软件分析处理。LSD显著性在0.05水平上检测。
2 结果与分析
2.1 不同生物菌剂对西瓜苗期生长发育的影响
对于西瓜品种早佳8424(表2),综合株高、茎粗、地上部鲜质量、根冠比、壮苗指数等几个指标,S1、S4和S6处理的促生效果较为显著。株高以S6处理的效果最明显,其株高比对照显著增加了12.7%;茎粗,S1处理效果最显著,比对照显著增加了45.5%;根冠比,最大为S4处理,较对照显著增加了45.0%;壮苗指数,S4处理最大,较对照显著增加了72.2%。
对于西农8号(表3),综合株高、茎粗、地上部鲜质量、根冠比、壮苗指数等几个指标,S1、S2、S4和S6处理效果较为显著。株高以S1处理的效果最明显,其株高比对照显著增加了9.4%;茎粗,S2处理的效果最显著,比对照显著增加了20.0%;根冠比,S1处理的效果最显著,较对照显著增加了170.5%;壮苗指数,S2处理最大,较对照显著增加了120.8%。
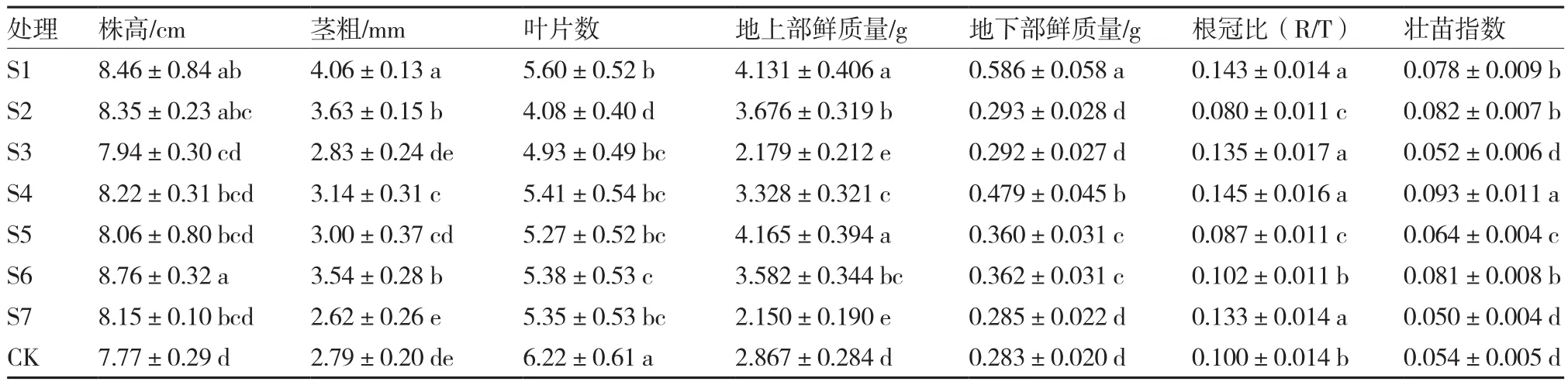
表2 不同生物菌剂对早佳8424苗期生长发育的影响

表3 不同生物菌剂对西农8号苗期生长发育的影响
以上结果表明:对2个西瓜品种促生效果均较为显著的为处理S1、S4和S6。
2.2 不同生物菌剂对西瓜苗期枯萎病的防治效果
如图1和图2所示,不同生物菌剂对西瓜苗期枯萎病都有一定的防治效果。对于西瓜品种早佳8424,在接种枯萎病菌条件下,使用生物菌剂与对照相比,病情指数降低了76.2~92.8,且S6效果最好,防病效果达到94.9%;S7、S4和S1效果次之,防病效果达到87.0%~90.9%。

图1 不同生物菌剂对早佳8424苗期枯萎病病情指数的影响
对于西瓜品种西农8号,在接种枯萎病菌条件下,使用生物菌剂与对照相比,病情指数降低了37.0~54.6,S6效果最好,防病效果达到87.6%;S1、S7和S4效果次之,防病效果达到79.3%~87.2%。结果表明,生物菌剂的防治效果在感病品种上效果更明显,且对于2个品种的防病效果均以S6最为显著。
2.3 生防菌株对西瓜枯萎病菌生长的影响
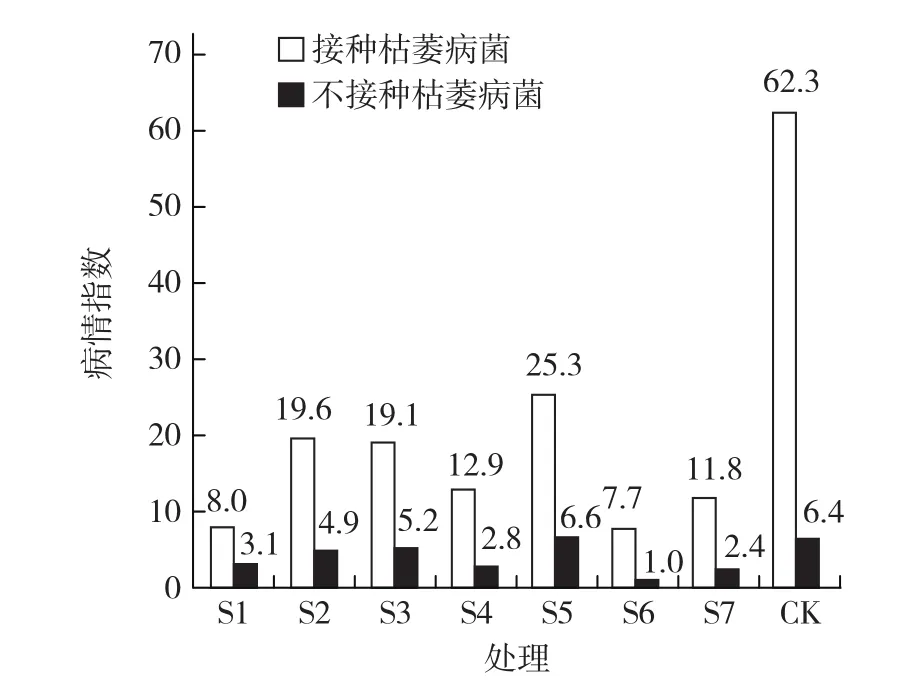
图2 不同生物菌剂对西农8号苗期枯萎病病情指数的影响
根据上述试验结果,筛选出绿色木霉菌(S1)、枯草芽孢杆菌(S4、S6)、放线菌(S7)生物菌剂,进一步研究对应的菌株对西瓜枯萎病菌生长的影响。结果表明,本试验选用的绿色木霉菌、放线菌和枯草芽孢杆菌菌株均对西瓜枯萎病菌生理小种1有明显抑制作用。各菌株的皿内对峙培养菌丝生长抑制率均在60%以上,枯草芽孢杆菌抑菌率最高,为67.75%,对峙培养后的病原菌孢子萌发数目仅为对照的24.4%(表4)。通过对受抑制的生理小种1菌丝再生能力的测定,可以看出(表5),对峙培养后的西瓜枯萎病菌菌丝生长能力均有一定程度减弱,表明各生防菌株对病原菌均有一定的持续抑菌能力。与枯草芽孢杆菌对峙培养后的枯萎病菌培养1 d的菌落直径仅为6.7 mm,从一开始就表现出良好的抑制效果,培养6 d后菌落直径仅为34.2 mm,约为对照的49.3%,与对照菌落直径差异最大,表明枯草芽孢杆菌对西瓜枯萎病菌持续抑制作用最为显著。
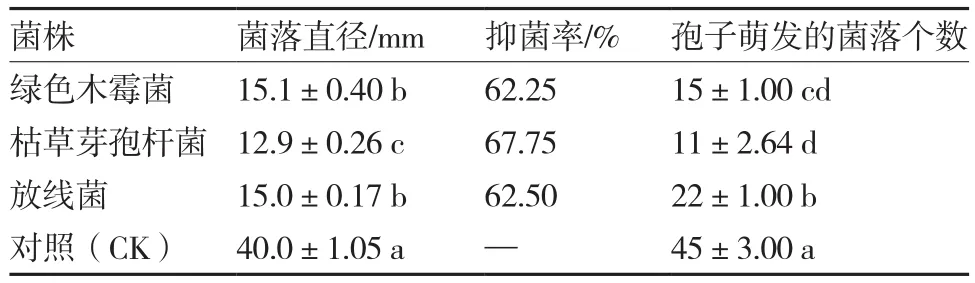
表4 生防菌对西瓜枯萎病菌生长的影响

表5 受抑制的西瓜枯萎病菌菌丝的再生能力
3 结论与讨论
生物防治主要是利用对植物无毒无害的环境友好型微生物,降低致病菌的数量从而达到防控的目的(Gava & Pinto,2016)。Faheem等(2015)将链霉菌YCXU与猪粪堆肥发酵施用到盆栽西瓜中,其对西瓜枯萎病菌的防治效果可以达到67%。Tziros等(2007)发现绿针假单胞菌(Pseudomonas chlororaphis)PCL1391可以显著降低西瓜枯萎病的发生程度。张洪涛等(2007)发现内生菌XJUL-12对西瓜枯萎病具有较强抗性,并将XJUL- 12鉴定为枯草芽孢杆菌。李欢等(2012)利用放线菌进行拌种处理,显著降低了西瓜枯萎病的发病率,在育苗期接种放线菌Act1后,最佳防治效果达到了52.17%。孙正祥等(2013)发现枯草芽孢杆菌菌株XG-1不仅可以有效防治西瓜枯萎病菌,还能促进西瓜种子萌发和植株生长。Ling等(2011)发现接种生防菌多粘类芽孢杆菌(Paenibacillus polymyxa)SQR-21的西瓜植株根系分泌物可明显抑制FON 孢子的萌发。本试验采用育苗接种生物菌剂的方法,研究了7种生物菌剂对2个西瓜品种苗期生长发育的影响和对枯萎病的防治效果。不同的生物菌剂对西瓜苗期枯萎病都有一定的防治效果,尤其是对感病品种早佳8424,其病情指数可以降低76.2~92.8,其中以S6效果最为显著,防病效果可达到94.9%。进一步研究发现,S6的枯草芽孢杆菌菌株对西瓜枯萎病菌生理小种1有明显抑制作用,对峙培养抑菌率达67.75%,分生孢子萌发数目仅为对照的24.4%,对病原菌的持续抑制作用达49.3%。综上,S6在西瓜促生和防治西瓜枯萎病两方面的综合效果最好,且其菌株对西瓜枯萎病菌生长和孢子萌发有明显的抑制作用,但具体的抑菌机理还有待于进一步的研究。
通过对生防菌株与其他因子的复配混合可以更有效地防治植物枯萎病(Cuppels et al.,2013)。庄敬华和刘王付(2005)将绿色木霉T23菌株添加少量营养元素,对田间和温室甜瓜枯萎病的防治效果达到76%。本试验中,枯草芽孢杆菌菌剂S4和西瓜专用菌剂S6,都是以枯草芽孢杆菌为主要菌株,S6在菌剂中添加了一些生长调节剂和营养元素,其在西瓜促生和防治西瓜枯萎病两方面的综合效果优于不添加的S4。
综上所述,本试验中不同生防菌对西瓜枯萎病都有一定的防治作用,其中枯草芽孢杆菌的效果最显著,其菌株能显著抑制病原菌生长和孢子萌发。此外,在选择合适的生防菌的基础上添加促进植株生长和恢复的生长激素或营养元素,效果会更理想。
甘良,蓝星杰,戴蓬博,刘继红,王阳,宗兆锋.2015.放线菌混合菌剂对西瓜枯萎病的防治作用研究.中国生物防治学报,31(4):516-523.
纪明山,王英姿,程根武,李博强,张国辉,李艳丽,回文广.2002.西瓜枯萎病拮抗菌株筛选及田间防效试验.中国生物防治,(2):71-74.
李欢,刘建辉,冯宁宁,薛泉宏.2012.放线菌Act1对连作西瓜枯萎病的防治效果.北方园艺,(15):144-147.
吕桂云,郭绍贵,张海英,耿丽华,许勇.2010.西瓜与枯萎病菌非亲和互作的表达序列标签分析.中国农业科学,43(9):1883-1894.
孙正祥,鲁红学,周燚,王丰.2013.枯草芽孢杆菌XG-1对西瓜枯萎病防效初报.中国植保导刊,33(4):12-15.
张洪涛,赵国玉,于频频,吾甫尔·米吉提,艾山江·阿布都拉,徐田枚.2007.西瓜枯萎病高效拮抗菌XJUL-12的筛选与鉴定.生物技术,(4):77-80.
庄敬华,刘王付.2005.木霉菌多功能生防菌剂对瓜类枯萎病的防治效果.北方园艺,(5):90-91.
Cuppels D A,Higham J,Traquair J A.2013.Efficacy of selected streptomycetes and a streptomycete + pseudomonad combination in the management of selected bacterial and fungal diseases of field tomatoes.Biological Control,67(3):361-372.
Faheem M,Raza W,Zhong W,Nan Z,Shen Q,Xu Y.2015.Evaluation of the biocontrol potential ofStreptomyces goshikiensisYCXU againstFusarium oxysporumf. sp.niveum.Biological Control,81(10):101-110.
Gava C A T,Pinto J M.2016.Biocontrol of melon wilt caused byFusarium oxysporumSchlect f. sp.melonisusing seed treatment withTrichodermaspp.and liquid compost.Biological Control,97:13-20.
Ling N,Huang Q,Guo S,She Q.2011.Paenibacillus polymyxaSQR-21 systemically affects root exudates of watermelon to decrease the conidial germination ofFusarium oxysporumf. sp.niveum.Plant and Soil,341(1-2):485-493.
L ü G,Guo S,Zhang H,Geng L,Song F,Fei Z,Xu Y.2011.Transcriptional profiling of watermelon during its incompatible interaction withFusarium oxysporumf. sp.niveum.European Journal of Plant Pathology,131(4):585-601.
L ü G,Guo S,Zhang H,Geng L,Martyn R D,Xu Y.2014.Colonization of Fusarium wilt-resistant and susceptible watermelon roots by a green-fluorescent-protein-tagged isolate ofFusarium oxysporumf. sp.niveum.Journal of Phytopathology,162(4):228-237.
Martyn R D.2014.Fusarium wilt of watermelon:120 years of research.Horticulturale Reviews,42:349-442.
Raza W,Yuan J,Ling N,Huang Q,Shen Q.2015.Production of volatile organic compounds by an antagonistic strainPaenibacillus polymyxaWR-2 in the presence of root exudates and organic fertilizer and their antifungal activity againstFusarium oxysporumf.sp.niveum.Biological Control,80:89-95.
Tziros G T,Lagopodi A L,Tzavella-Klonari K.2007.Reduction of Fusarium wilt in watermelon byPseudomonas chlororaphisPCL1391 andP.fluorescens WCS365.Phytopathologia Mediterranea,46(3):320-323.
Zhang Z,Zhang J,Wang Y,Zheng X.2005.Molecular detection ofFusarium oxysporumf. sp.niveum and Mycosphaerella melonisin infected plant tissues and soil.FEMS Microbiol Letters,249(1):39-47.
Zhao S,Du C M,Tian C Y.2012.Suppression ofFusarium oxysporumand induced resistance of plants involved in the biocontrol of cucumber Fusarium wilt byStreptomyces bikiniensisHD-087.World Journal of Microbiology & Biotechnology,28(9):2919-2927.

