加工番茄细菌性斑点病抗性评价体系的建立及微生物防治菌剂筛选
郭威涛周俊国吴长柳柴阿丽李宝聚*
(1河南科技学院,河南新乡 453000;2中国农业科学院蔬菜花卉研究所,北京 100081)
加工番茄是普通番茄中的一种栽培类型,其番茄红素、可溶性固形物、胡萝卜素含量高,可深加工为番茄酱、番茄干、番茄粉等制品。目前加工番茄主要生产国为美国、法国、希腊、意大利等,美国是主要消费国家,年人均消费量为33 kg(李君明 等,2001)。近年来我国对番茄制品的需求日益增大,2014年全国加工番茄种植面积达7万hm2。随着加工番茄种植面积的扩大、栽培管理措施及环境条件等影响,加工番茄细菌性斑点病(Pseudomonas syringaepv. tomato)发生日趋严重,产量和品质受到了影响。该病害自1933年首次报道以来,在全球各地均有发生,是一种严重危害全世界番茄生产的重要病害之一,可造成5%~75%的产量损失(Yunis et al.,1980)。近年在我国内蒙古、甘肃、新疆等地发生,主要为害叶片、果实和茎秆(王晓辉 等,2006;李志栋,2010;柴阿丽 等,2014)。
选育抗病品种是一种高效且环保的防治番茄细菌性斑点病的方法,筛选适宜的番茄细菌性斑点病人工接种鉴定方法是抗病品种选育的基础(赵廷昌等,2000;张国丽 等,2011)。本试验采用喷雾法、涂抹法、灌根法、叶腋针刺法和茎上针刺法等5种接种方法对209份醋栗番茄品种进行番茄细菌性斑点病的抗性评价,以期建立加工番茄细菌性斑点病抗性鉴定技术,并在此基础上筛选出抗细菌性斑点病的醋栗番茄品种资源。
近年来,番茄细菌性斑点病的防治主要以化学药剂防治为主,由于菜农长期单一使用同一种药剂,病菌易出现抗药性,防治效果下降,菜农在生产中超浓度、超剂量滥用农药的现象时有发生,造成药害和蔬菜、土壤农药残留超标,并对环境造成污染,导致蔬菜质量和安全性的下降。随着可持续农业发展战略的实施,使用微生物菌剂及其复配制剂防治细菌性斑点病是今后的主要发展方向(杨春泉,2008;范广华 等,2011)。本试验选用23种微生物菌剂进行室内盆栽药效试验,筛选出对番茄细菌性斑点病有效的微生物菌剂,以期为微生物菌剂对番茄细菌性斑点病的预防、治疗和推广提供依据。
1 材料与方法
1.1 试验材料
供试菌株:加工番茄细菌性斑点病菌丁香假单孢番茄致病变种(Pseudomonas syringaepv.tomato)具有强致病性的菌株,编号FQ13080301,保存于中国农业科学院蔬菜花卉研究所蔬菜综合防治课题组。
供试培养基为营养琼脂培养基(nutrient agar,NA):蛋白胨10.0 g,牛肉粉3.0 g,NaCl 5.0 g,琼脂15~25 g,蒸馏水1 000 mL,pH=7.0;营养肉汤培养基(nutrient broth,NB):蛋白胨10.0 g,牛肉粉 3.0 g,NaCl 5.0 g,蒸馏水 1 000 mL,pH=7.0。NA固体培养基用于病原细菌单菌落划线,获得菌株纯培养;NB液体培养基用于病原细菌扩繁,制备接种菌悬液。
供试番茄品种为209份醋栗番茄(Solanum pimpinellifolium)种质资源材料,由中国农业科学院蔬菜花卉研究所加工番茄课题组提供。
供试药剂为23种枯草芽孢杆菌(Bacillus subtilis)微生物菌剂,含活芽孢200亿个·g-1,由中国农业科学院蔬菜花卉研究所筛选制备。60%溴硝醇可湿性粉剂购自辽宁省丹东市农药总厂,20%叶枯唑可湿性粉剂购自山东利邦农化有限公司,30%琥胶肥酸铜可湿性粉剂购自陕西美邦农药有限公司。
1.2 试验方法
1.2.1 接种体制备 将保存的番茄细菌性斑点病菌菌株从4 ℃冰箱试管内取出,使用已灭菌的接种环挑取单菌落,于NA固体培养基上进行划线,然后置于细菌培养箱中28 ℃培养24 h,当培养基上出现单菌落时挑取单菌落,转移到NB液体培养基中,28 ℃下260 r·min-1振荡培养24 h,用无菌水配制成浓度为1×108cfu·mL-1的菌悬液,备用。
1.2.2 不同接种方法比较 待醋栗番茄幼苗长至3~4片真叶,使用上述制备好的浓度为1×108cfu·mL-1的菌悬液,分别采用喷雾、涂抹、叶腋针刺、茎上针刺、灌根等5种方法进行接种。具体接种方法如下。
喷雾接种法:即用小型喷雾器将接种菌悬液均匀地喷雾到每片叶片的正反面,以不形成水滴流淌为度,以喷雾清水接种为对照(赵廷昌 等,2001)。
涂抹接种法:用毛笔蘸取菌悬液涂抹于叶片正反面,每株苗涂抹4片真叶并做好标记,套袋保湿24 h(李志栋,2010),以涂抹清水接种为对照。
叶腋针刺接种法:用注射器吸取菌悬液针刺接种到植株叶腋处,每株苗注射3个叶腋处(刘秋 等,2002),以注射清水接种为对照。
茎上针刺接种法:用注射器吸取菌悬液针刺接种到主茎上,从下至上每隔1 cm进行针刺,共针刺3处,以针刺清水接种为对照。
灌根接种法:在每株幼苗根部灌入50 mL菌悬液,以灌入清水接种为对照。
每种接种方法3次重复,每次重复20株。接种后将植株置于鉴定室内保湿(RH为90%~100%)48 h,以后每天白天光照12~14 h,晚上继续保湿(RH为80%~90%)。接种期内温度控制在白天26~28 ℃,晚上20~22 ℃,土壤湿度85%~90%。接种7 d后进行发病情况调查。
1.2.3 醋栗番茄品种对细菌性斑点病的抗性鉴定
醋栗番茄幼苗长至3~4片真叶期采用喷雾法接种209份醋栗番茄品种,以感病品种石番15号为对照。待对照发病后进行病情分级调查。
1.2.4 醋栗番茄细菌性斑点病病情分级及抗性评价标准 喷雾法和涂抹法接种,病情分级标准:0级,叶片上无病斑;1级,0<病斑面积≤5%;3级,5%<病斑面积≤10%;5级,10%<病斑面积≤25%;7级,25%<病斑面积≤50%;9级,50%<病斑面积≤100%(杨春泉,2008;韩盛 等,2010)。
喷雾法和涂抹法接种病情指数计算:

叶腋针刺法和茎上针刺法接种,病情分级标准:0级,无病斑;1级,植株轻度萎蔫,病斑≤0.5 cm;2级,植株50%叶片萎蔫,0.5 cm<病斑≤1 cm;3级,除新叶外的其余叶片萎蔫,1 cm<病斑≤2 cm;4级,叶片严重萎蔫,植株腐烂死亡。
灌根法接种,病情分级标准:0级,未出现叶片萎蔫或茎坏死;1级,叶片轻度变黄或萎蔫;2级,叶片中度萎蔫或茎轻度坏死;3级,叶片严重萎蔫或茎严重坏死;4级,植株死亡。
叶腋针刺法、茎上针刺法和灌根法接种病情指数计算:

抗性评价标准:免疫(I),病情指数为0;抗病(R),0<病情指数≤20;中抗(MR),20<病情指数≤40;感病(S),40<病情指数≤60;高感(HS),病情指数>60。
1.2.5 微生物菌剂对醋栗番茄细菌性斑点病的预防和治疗效果评价 预防效果评价:于醋栗番茄幼苗3~4片真叶期,先喷雾微生物菌剂(含活芽孢0.2亿个·g-1),对照药剂为20%叶枯唑可湿性粉剂500倍液、60%溴硝醇可湿性粉剂800倍液、30%琥胶肥酸铜可湿性粉剂(1 080 g·hm-2)。间隔24 h后采用喷雾法接种细菌性斑点病菌。接种后放置于保湿柜里25~28 ℃下进行常规管理,待清水对照发病后调查病情指数,并计算防效。
治疗效果评价:于醋栗番茄幼苗3~4片真叶期,先采用喷雾法接种细菌性斑点病菌,置于保湿柜中保湿处理。接种24 h后,喷雾微生物菌剂(含活芽孢0.2亿个·g-1),对照药剂为20%叶枯唑可湿性粉剂500倍液、60%溴硝醇可湿性粉剂800倍液、30%琥胶肥酸铜可湿性粉剂(1 080 g·hm-2)。待清水对照发病后调查病情指数,并计算防效。

1.3 数据处理
采用Microsoft 2010软件和SPSS 17.0统计软件处理试验数据,利用Duncan氏新复极差法进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 番茄细菌性斑点病不同接种方法比较
由表1和图1可以看出,采用喷雾法和涂抹法进行接种,番茄细菌性斑点病发病率高达100.00%,接种3 d后表现症状;灌根法、茎上针刺法和叶腋针刺法接种的发病率分别为73.33%、86.67%和76.67%,潜育期为4~5 d。5种接种方法中,采用喷雾法、茎上针刺法接种的平均病情指数都高于65,显著高于叶腋针刺法,且二者的植株发病率均高于80%,但茎上针刺法的植株发病率低于喷雾法,且操作较复杂。综合盆栽试验结果,喷雾法是加工番茄细菌性斑点病抗性鉴定技术的最佳接种方法,简单有效,适用于种质资源材料的抗性鉴定。

表1 番茄细菌性斑点病不同接种方法比较

图1 番茄细菌性斑点病不同接种方法的发病情况

表2 209份醋栗番茄品种细菌性斑点病抗性鉴定结果
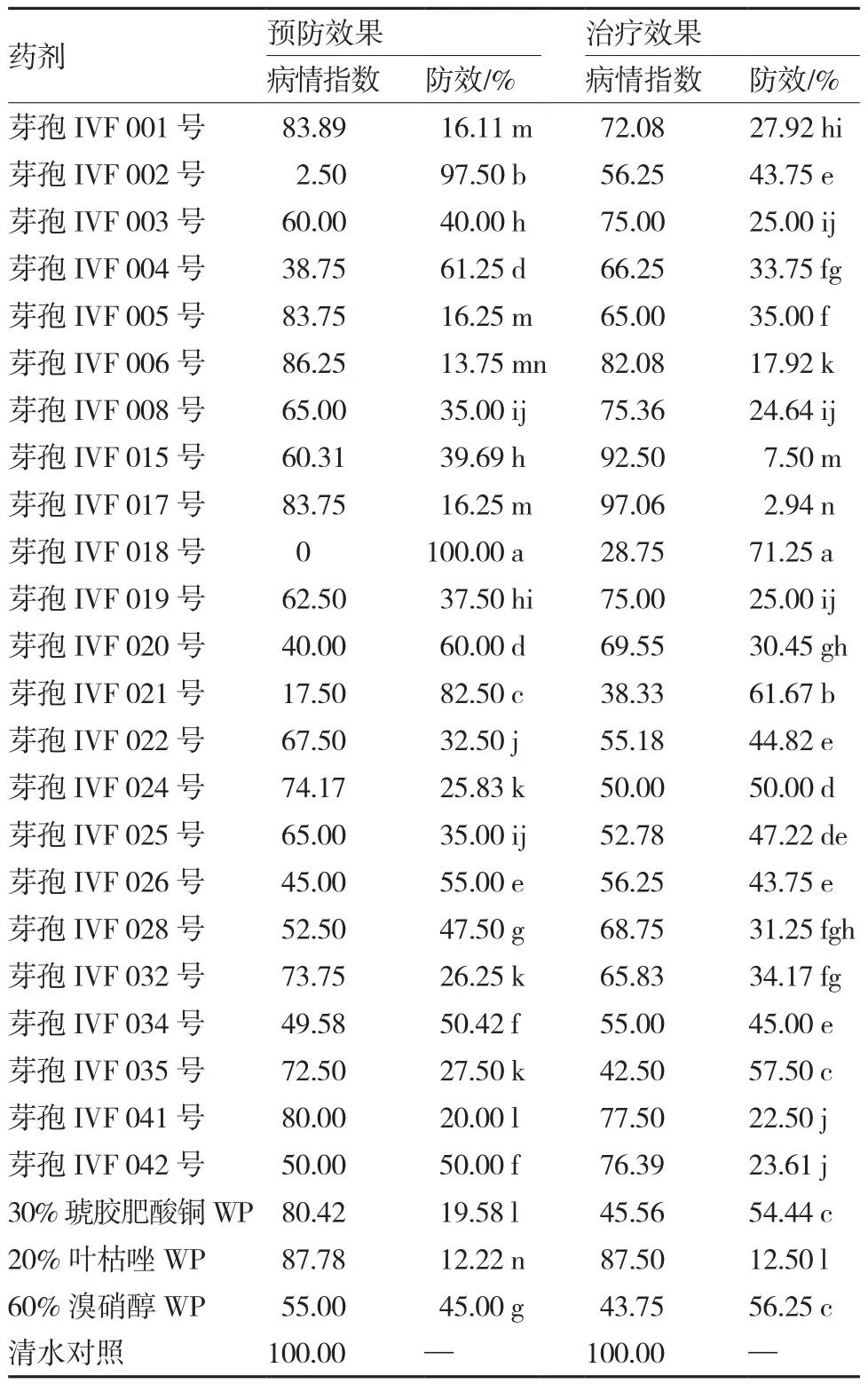
表3 23种新型生物杀细菌剂对加工番茄细菌性斑点病的防治效果
2.2 醋栗番茄品种对细菌性斑点病的抗性鉴定
采用喷雾法接种209份醋栗番茄品种,接种3 d后叶片上产生深褐色至黑色不规则斑点,斑点周围有时会出现黄色晕圈。接种7 d后调查番茄细菌性斑点病发病情况,209份醋栗番茄品种均发病,但发病程度有差异(表2),其中中抗品种22份,感病品种57份,高感品种130份,未发现免疫和抗病品种,对照石番15号的病情指数>90,属高感品种。
2.3 微生物菌剂对细菌性斑点病的防治效果
从表3可以看出,在对番茄细菌性斑点病的预防效果上,3种微生物菌剂芽孢IVF 018号、芽孢IVF 002号和芽孢IVF 021号防效最佳,防效分别为100.00%、97.50%和82.50%;芽孢IVF 004号和芽孢IVF 020号的防效也达到或超过60%。在治疗效果上,微生物菌剂IVF 018号和IVF 021号的防效最佳,防效分别为71.25%和61.67%;芽孢IVF 035号和芽孢IVF 024号的防效也达到或超过50%。
试验结果表明,芽孢IVF 018号菌剂和IVF 021号菌剂的预防和治疗效果较好,且预防效果明显高于治疗效果,可作为防治番茄细菌性斑点病的备选药剂。
3 结论与讨论
番茄细菌性斑点病由丁香假单胞番茄致病变种侵染引起,在番茄幼苗期至收获期都可以发生,为害番茄的叶、茎、花、叶柄和果实(赵廷昌 等,2001),该病害一旦发生,传播速度很快,严重影响加工番茄的产量和品质,给生产带来一定的经济损失。
番茄细菌性斑点病菌可以侵染番茄叶片、叶柄和茎秆,病原菌可以在土壤中存活至少7个月(Blancard,2012),成为翌年初侵染源,根据病害症状和初侵染源,笔者选择了喷雾法、涂抹法、叶腋针刺法、茎上针刺法和灌根法进行接种。其中,喷雾法、涂抹法和叶腋针刺法的操作方法和发病症状与已报道方法相同(赵廷昌 等,2000;杨春泉,2008;李志栋,2010)。而灌根法和茎上针刺接种法尚未见报道,笔者采用这两种方法接种后,发病植株分别表现为茎段和茎基部变黑褐色,与田间自然发病症状相同。本试验采用5种方法接种后,加工番茄植株都表现出相应症状,发病率均在70%以上,后续应用中可以根据不同的需求选择不同的接种方法。在品种抗病性评价和生物菌剂筛选中,选择应用喷雾法,接种后发病率为100%,平均病情指数66.56,且操作简单,发病均匀。
醋栗番茄是番茄的野生种,与其他野生种相比,醋栗番茄与栽培番茄(S. lycopersicum)的亲缘关系最近(Grandillo et al.,2011),可与栽培种直接杂交,而且具有抗生物胁迫和非生物胁迫的特性。国内外学者已从醋栗番茄品种中鉴定出多个抗真菌和细菌病害的基因,其中抗真菌病害的基因包括高抗枯萎病的I基因和I2基因(Stall & Walter,1965), 抗 灰 叶 斑 病 的Sm基 因(Bashi et al.,1973),抗晚疫病的Ph-1、Ph-2、Ph-3和Ph-5基因(Chunwongse et al.,2002;Merk et al.,2012);抗细菌病害的基因包括抗细菌性斑点病的pto、pti和prf基 因(Pitblado et al.,1984;Stockinger &Walling,1994),抗细菌性疮痂病的Rx-4基因(Robbins et al.,2009)等。鉴于醋栗番茄抗性资源易于转育和利用,笔者对209份醋栗番茄品种进行细菌性斑点病抗性评价筛选,鉴定出中抗品种22份,占鉴定总数的10.52%,感病品种57份,占鉴定总数的27.27%,高感品种130份,占鉴定总数的62.20%。虽然本试验没有获得抗性种质资源,但是积累的方法可以为以后抗性资源鉴定提供技术支持。
加工番茄细菌性斑点病传播侵染速度快,一旦发生很难防治。目前以使用化学农药防治为主,生产中常用的药剂有氢氧化铜、噻菌灵、噻唑锌、中生菌素等(赵廷昌 等,2004;李宝聚 等,2008)。由于防治药剂单一,种植户缺乏用药安全意识,存在过量滥用农药的现象,导致病原菌产生抗药性,造成对环境的极大破坏。随着人们环境保护意识的提高,使用新型微生物菌剂为主的防治措施研究应用渐多(王文桥 等,2011;路粉和王文桥,2017)。芽孢杆菌(Bacillussp.)是目前生防细菌中研究较多的一类,因其能够产生耐热、耐旱、抗紫外线和有机溶剂的内生孢子,是理想的生防菌筛选对象(Emmert & Handelsman,1999;Ye et al.,2013)。本试验从23种微生物菌剂中筛选出对加工番茄细菌性斑点病预防和治疗效果最佳的芽孢IVF 018号、芽孢IVF 021号菌剂,预防和治疗效果分别达到100.00%、82.50%和71.25%、61.67%,预防效果高于治疗效果,说明田间防治应以预防为主。微生物菌剂防治番茄细菌性斑点病具有环保、安全、成本低、控制效果显著、持效期长等特点,既能有效控制该病害的发生及为害,又能避免化学农药对生态环境和蔬菜产品的污染(魏春妹和张春明,1994;董艳 等,2015)。本试验筛选出的微生物菌剂芽孢IVF 018号和芽孢IVF 021号,有望成为加工番茄细菌性病害防治的高效菌剂。
柴阿丽,吴兰平,迟庆勇,王惠军,史有国,楚金萍,李守明,李宝聚.2014.加工番茄病害主要类型及防治建议.中国蔬菜,(10):62-64.
董艳,陈永福,张和平.2015.番茄早疫病害微生物防治研究进展.中国农学通报,31(17):111-115.
范广华,董英,赵文路,宋清斌,李冬刚,马燕.2011.几种新型生物药剂防治黄瓜白粉病田间药效试验.山东农业科学,(8):93-94.
韩盛,杨渡,徐万里,孙保成,张云舒,孙肃民,马永尚.2010.8种生物源和矿物源农药防治加工番茄细菌性斑点病试验.新疆农业科学,47(11):2258-2261.
李宝聚,朱辉,石延霞.2008.番茄细菌性斑点病的识别与防治.长江蔬菜,(13):23-24.
李君明,徐和金,周永健.2001.加工番茄生产的现状及品种遗传改良浅析.中国蔬菜,(6):52-53.
李志栋.2010.内蒙古加工型番茄细菌性斑点病病原鉴定及种子带菌检测技术的研究〔硕士论文〕.呼和浩特:内蒙古农业大学.
刘秋,田秀铃,孟祥林,杜春梅,祁岑.2002.番茄细菌性斑点病病原鉴定的初步研究.辽宁农业科学,(1):42-43.
路粉,王文桥.2017.我国蔬菜杀菌剂及其应用状况.中国蔬菜,(10):6-13.
王晓辉,李国英,任毓忠,薛小伟,黄素芳.2006.加工番茄品种对细菌性斑点病的抗性鉴定.北方园艺,(3):5-6.
王文桥,马平,张小风,李社增,韩秀英,马志强.2011.生物源杀菌剂与化学药剂协调防控番茄病害.植物保护学报,38(1):75-80.
魏春妹,张春明.1994.利用微生物制剂防治番茄青枯病.上海农业科技,(1):24.
杨春泉.2008.番茄细菌性斑点病的病原鉴定和内生生防菌的筛选〔硕士论文〕.福州:福建农林大学.
张国丽,任毓忠,张莉,李国英.2011.加工番茄品种对番茄细菌性斑点病的抗性鉴定.新疆农业科学,48(11):2050-2053.
赵廷昌,孙福在,冯凌云,韩文华,许文奎.2000.番茄品种对番茄细菌性斑点病的抗性鉴定.植物保护,(4):49-50.
赵廷昌,孙福在,宋文生.2001.番茄细菌性斑点病病原菌鉴定.植物病理学报,31(1):37-42.
赵廷昌,孙福在,李明远,张贵峰,戴春重,崔元纡,杨华,王万力.2004.番茄细菌性斑点病的发生与防治.中国蔬菜,(4):31.
Bashi E,Pilowsky M,Rotem J.1973.Resistance in tomatoes toStemphylium floridanumandS.botryosumf.sp.lycopersici.Phytopathology,63:1542-1544.
Blancard D.2012.Tomato Diseases,Identification,Biology and Control:A Colour Handbook.Boca Raton:CRC Press.
Chunwongse J,Chunwongse C,Black L,Hanson P.2002.Molecular mapping of thePh-3gene for late blight resistance in tomato. The Journal of Horticultural Science and Biotechnology,77(3):281-286.
Emmert E A,Handelsman J.1999.Biocontrol of plant disease:a(gram-) positive perspective.Fems Microbiology Letters,171(1):1-9.
Grandillo S,Chetelat R,Knapp S,Spooner D,Peralta I,Cammareri M,Perez O,Termolino P,Tripodi P,Chiusano M L,Ercolano M R,Frusciante L,Monti L,Pignone D.2011.Solanum sect.Lycopersicon.Wild Crop Relatives:Genomic and Breeding Resources.Germany:Springer Berlin Heidelberg:129-215.
Merk H L,Ashrafi H,Foolad M R.2012.Selective genotyping to identify late blight resistance genes in an accession of the tomato wild speciesSolanum pimpinellifolium.Euphytica,187(1):63-75.
Pitblado R E,MacNeill B H,Kerr E A.1984.Chromosomal identity and linkage relationships ofPto,a gene for resistance toPseudomonas syringaepv.tomatoin tomato. Canadian Journal of Plant Pathology,6(1):48-53.
Robbins M D,Darrigues A,Sim S C,Masud M A T,Francis D M.2009.Characterization of hypersensitive resistance to bacterial spot race T3(Xanthomonas perforans)from tomato accession PI 128216.Phytopathology,99(9):1037-1044.
Stall R E,Walter J M.1965.Selection and inheritance of resistance in tomato to isolates of race 1 and 2 of the Fusarium wilt organism.Phytopathology,55:1213-1215.
Stockinger E J,Walling L L.1994.Pto3andpto4:novel genes fromLycopersicon hirsutumvar.glabratumthat confer resistance toPseudomonas syringaepv.tomato.Theoretical and Applied Geneticics,89:879-884.
Ye J J,Cao N N,Zhang J F,Yin H,Wu J M,Hu Z Z.2013.Research application progress on theBacillussp.in plant pathogenic fungi biocontrol.Agricultural Science and Technology,14(5):695-698.
Yunis H,Bashan Y,Okon Y,Henis Y.1980.Weather dependence,yield losses,and control of bacterial speck of tomato caused byPseudomonas tomato.Plant Disease,64:937-939.

