收获期霉变与正常燕麦籽粒表面菌群差异分析
刘龙龙,马名川,张丽君,崔 林,韩渊怀,2,周建萍
(1.山西省农业科学院农作物品种资源研究所/农业部黄土高原作物基因资源与种质创制重点实验室/特色杂粮种质资源发掘与育种山西省重点实验室,山西太原 030031;2.山西农业大学农学院,山西太谷 030801)
作物收获期出现连阴雨时,田间透气性差、湿度大,成熟的籽粒为田间微生物生长提供了丰富的营养基质,若这一时期温湿度适宜,田间微生物会迅速繁殖,导致作物籽粒霉变[1-2],造成严重的产量损失[3-4]。由于我国燕麦主产区独特的气候条件,燕麦成熟期处于多雨季节,常常由于阴雨天气而无法及时收获,加之我国种植的主要为裸燕麦,籽粒表面有一层绒毛,在收获期和储存过程中易受微生物感染而出现霉变[5]。燕麦霉变会影响其产量和品质,霉菌产生的毒素可通过食物链对人体和动物健康产生危害[6]。了解引起燕麦籽粒霉变的主要菌群对燕麦安全生产具有重要意义。
用传统的培养分离方法从环境中分离出的微生物仅占总量的 1%~10%[7],无法完整地解析样品中微生物的组成和丰富度,对确定导致作物霉变的特异性菌种带来一定困难。分子生态学技术的快速发展使完整分析环境中微生物菌群的结构成为可能。宏基因组学学科的发展,克服了普通分子生态学技术的局限性,使低丰富度物种能被正确检测出来,海量的数据也使得物种的分类更加准确[8-9]。
目前,关于燕麦收获期连阴雨造成籽粒田间霉变的研究报道较少,对引起燕麦收获期籽粒霉变的主要菌群尚不清楚。本试验选取收获期正常和霉变的品燕2号籽粒,通过表面菌群的宏基因组检测,比较正常和霉变燕麦籽粒表面菌群和丰度差异,以期确定引起收获期燕麦籽粒霉变的主要菌群,为燕麦霉变的生物防治提供理论依据。
1 材料与方法
1.1 材 料
供试燕麦品种为品燕2号。2015年9月分别在岢岚县神堂坪乡黑峪村(籽粒正常)和高家会乡西会村(籽粒霉变)收获燕麦籽粒(图1),每个地点重复取样三次,每次取样500 g,取样后迅速放入4 ℃冰箱保存。

图1 正常籽粒(左)与霉变籽粒(右)
1.2 方 法
1.2.1 总DNA的提取和测定
取样品10 g,用PBS缓冲液冲洗燕麦籽粒表面三次,收集籽粒表面菌体,12 000 r·min-1离心30 s,弃上清后,采用天根粪便基因组DNA提取试剂盒进行总DNA提取。采用紫外分光光度计进行DNA浓度检测。采用 0.8%琼脂糖凝胶电泳检测 DNA 样品的完整性。
1.2.2 宏基因组测序
细菌宏基因组16S V4 区和真菌宏基因组ITS 区的扩增及测序由上海派森诺生物科技有限公司完成。细菌和真菌多样性的测定参考Caporaso等[10]的方法。
1.2.3 生物信息学分析
测序得到的原始数据经质量过滤后利用Flash对通过质量过滤的序列进行连接,最后根据 index 信息提取每个样品的有效序列;运用 Qiime[11](version 1.7.0,http://qiime.org/)进行序列过滤,运用 mothur[12](version 1.31.2,http://www.mothur.org/)软件中 uchime[13]的方法去除嵌合体序列,得到最终用于后续分析的优质序列。在 Qiime 中调用 uclust[14]的方法对优质序列按相似度 0.97 进行聚类,选取每个类最长的序列为代表序列,在 Qiime 中采用 blast[15]的方法对序列数据库进行比对,获得每个 OTU 分类学信息,并对 OTU 的代表序列构建系统发育树,利用 mothur 软件生成样本间OTU 的维恩图。对每个样品的 OTU 按照丰度从大到小排序,对各个丰度值取 log2 作为纵坐标,OTU的序数作为横坐标,做丰度分布曲线图。根据 OTU 列表中的各样品物种丰度情况,应用软件 mothur 中的 summary.single 命令,计算 4 种常用的生物多样性指数。对 OTU 表利用 Qiime 生成不同分类水平上(门、纲、目、科、属、种)的物种丰度表和分布图。应用软件 mothur 中的 metastats(http://metastats.cbcb.umd.edu/)命令进行差异显著性分析。采用SPSS 16.0软件进行t检验及相关性分析。
2 结果与分析
2.1 正常籽粒与霉变籽粒表面微生物多样性分析
用维恩图中OTUs重叠数多少说明正常籽粒与霉变籽粒微生物多样性相关程度(图2),正常籽粒与霉变籽粒中细菌OTUs总数分别为1 063和2 040,两个样品独有的OTUs分别为494和1 471,占各自OTUs总数的46.47%和72.11%;正常籽粒与霉变籽粒中真菌OTUs总数分别为98和112,两个样品独有的OTUs分别50和64,占各自OTUs总数的51.20%和57.14%。结果表明,籽粒表面细菌的OTUs数比真菌的高;霉变籽粒表面真菌OTUs数的组成相似度比细菌高;霉变籽粒中细菌物种的差异程度比真菌大。
为了比较正常籽粒与霉变籽粒细菌、真菌群落在物种丰度和均匀度上的差异, 进行了细菌和真菌的Rank-abundance分析(图3)。霉变籽粒细菌和真菌OTUs数目均大于正常籽粒,说明霉变籽粒细菌和真菌物种丰度均高于正常籽粒,其中,细菌的物种丰度差异更为明显,两个样品中细菌和真菌物种均匀度(曲线形状)较相近。
由表1可知,正常籽粒与霉变籽粒细菌群落多样性均高于真菌,霉变籽粒的物种多样性高于正常籽粒。
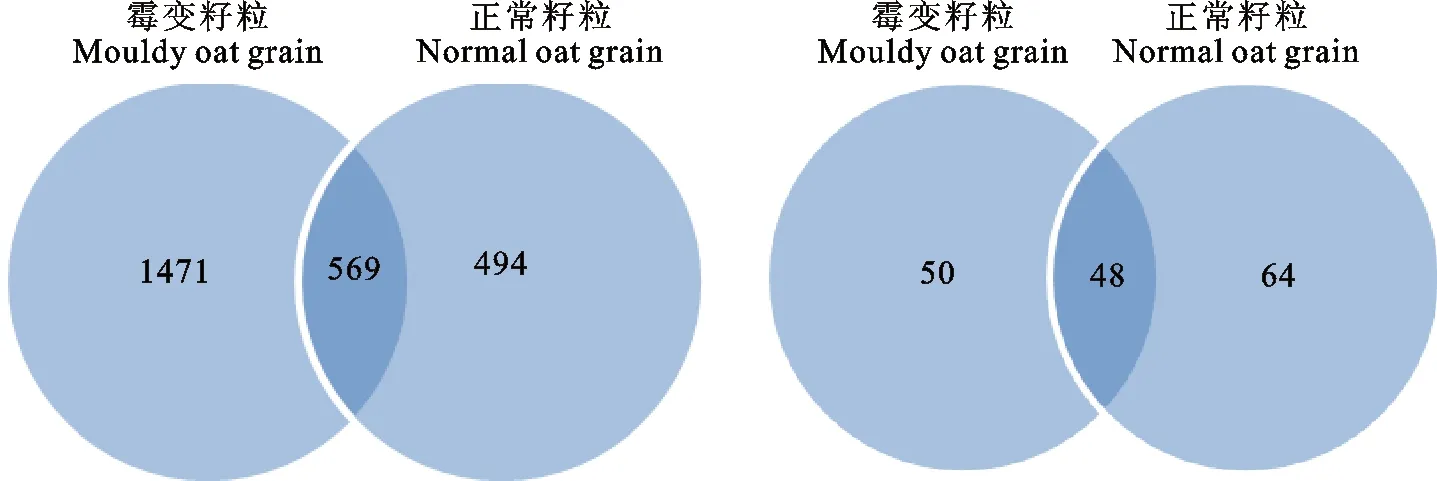
图2 正常籽粒与霉变籽粒微生物OTUs维恩图(左:细菌,右:真菌)
2.2 正常籽粒与霉变籽粒表面菌群组成分析
从门的分类水平看,两个样品中已确定的表面真菌主要隶属于2个门,正常籽粒的中子囊菌门(Ascomycota)真菌占44.3%,担子菌门(Basidiomycota)占3.4%;霉变籽粒的中子囊菌门(Ascomycota)占76%,担子菌门(Basidiomycota)占0.9%。两个样品中均有未确定分类的真菌,正常籽粒未确定真菌(unidentified)占52.3%,霉变籽粒中unidentified占23.1%(图4A、B)。正常籽粒表面共检出细菌37个门,优势菌群隶属于变形菌门(Proteobacteria,60%)、蓝菌门(Cyanobacteria,30%)、拟杆菌门(Bacteroidetes,3.94%)、放线菌门(Actinobacteria,2.51%)、厚壁菌门(Firmicutes,1.34%)(图4C);霉变籽粒表面共检出细菌31个门,优势菌群隶属于变形菌门(Proteobacteria,75%)、拟杆菌门(Bacteroidetes,8.43%)、放线菌门(Actinobacteria,6.76%)、蓝菌门(Cyanobacteria,4.80%)、厚壁菌门(Firmicutes,1.34%)(图4D)。正常籽粒和霉变籽粒中,细菌和真菌在门水平的组成比例存在明显差异。就细菌而言,两个样品中占比最大的都是变形菌门,但在霉变籽粒中的占比明显高于正常籽粒;正常籽粒中蓝菌门的占比明显高于霉变籽粒,而霉变籽粒中拟杆菌门和放线菌门明显高于正常籽粒。就真菌来说,正常籽粒中担子菌门和未确定分类地位的真菌比例显著高于霉变籽粒,而霉变籽粒中子囊菌门的占比显著高于正常籽粒。
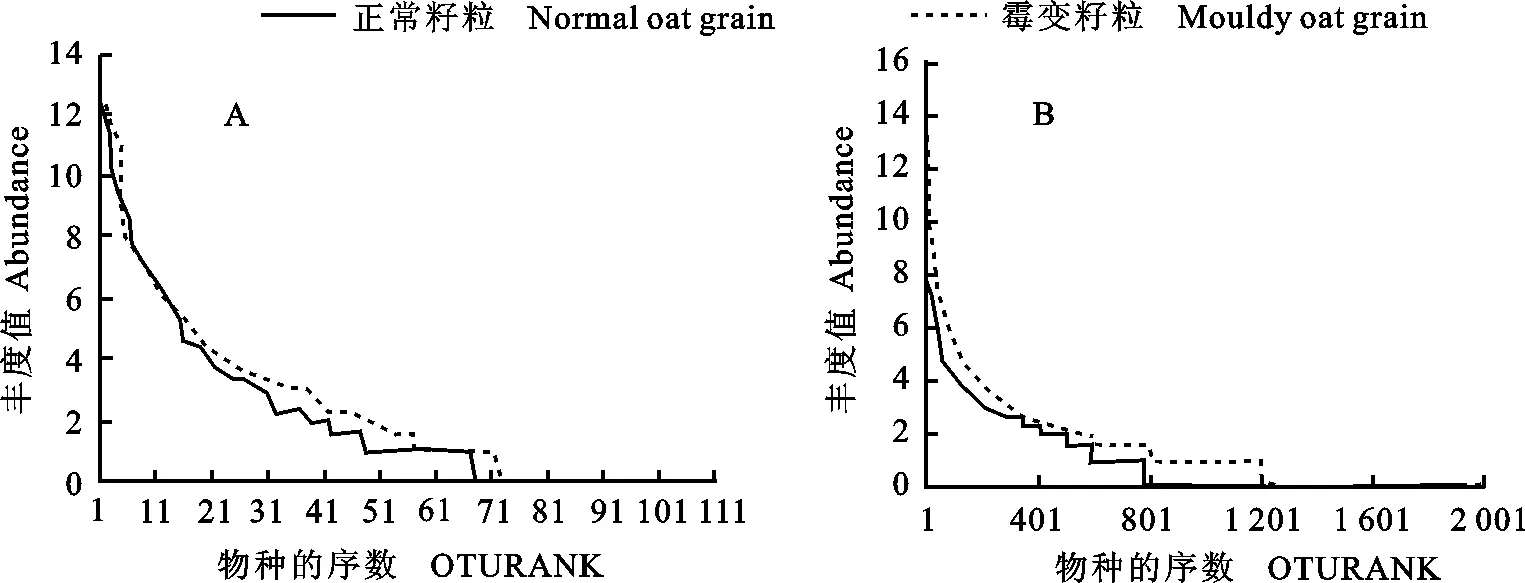
图3 正常籽粒与霉变籽粒表面真菌(A)和细菌(B)丰度分布曲线
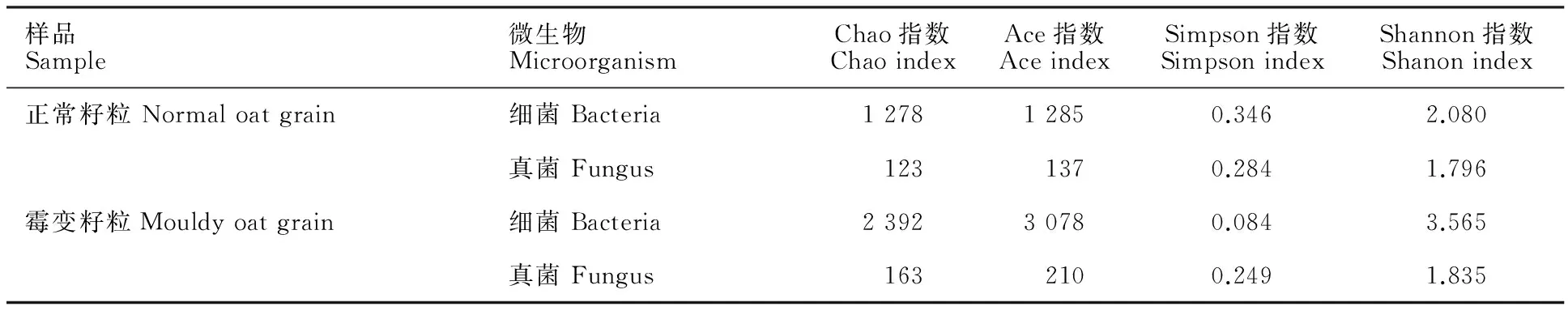
样品Sample微生物MicroorganismChao指数ChaoindexAce指数AceindexSimpson指数SimpsonindexShannon指数Shanonindex正常籽粒Normaloatgrain细菌Bacteria127812850.3462.080真菌Fungus1231370.2841.796霉变籽粒Mouldyoatgrain细菌Bacteria239230780.0843.565真菌Fungus1632100.2491.835
从属的分类水平来看,正常籽粒表面共检出真菌43个属,其中,已确定分类地位的优势真菌隶属于核腔菌属(Pyrenophora,21.7%)、链格孢属(Alternaria,7.6%)、Radulidium(7.4%)、Davidiella(3.9%)、赤霉菌属(Gibberella,1.24%)、隐球菌属(Cryptococcus,1.1%)、非优势菌总和(others)占4.76%(图4E);霉变籽粒表面共检出真菌43个属,其中,已确定分类地位的优势菌隶属于链格孢属(Alternaria,38.7%)、核腔菌属(Pyrenophora,25.2%)、赤霉菌属(Gibberella,7.2%)、Davidiella(2.39%),非优势菌总和(others)占3.41%(图4F)。分类未确定的真菌,正常籽粒占52.3%,霉变籽粒占23.1%。正常籽粒表面真菌中未确定分类的优势真菌丰度均高于霉变籽粒。正常籽粒表面共检出细菌409个属,已确定分类的优势菌隶属于薄层菌属(Hymenobacter,2.1%)、欧文氏菌属(Erwinia,1.8%)、假单胞菌属 (Pseudomonas,1.4%),非优势菌(others)总和占12.7%(图4G);霉变籽粒表面共检出细菌548个属,已确定分类的优势菌隶属于欧文氏菌属(Erwinia,20%)、假单胞菌属(Pseudomonas,15%)、克雷白氏杆菌属(Klebsiella,6%)、金黄杆菌属(Chryseobacterium,3.7%)、Ramlibacter(2.6%)、农杆菌属(Agrobacterium,1.9%)、短小杆菌属(Curtobacterium,1.6%)、类芽孢杆菌属(Paenibacillus,1.6%)、土地杆菌属(Pedobacter,1.3%),非优势菌(others)总和为24.9%(图4H)。属水平两者均有未确定分类的细菌,正常籽粒中,两个优势菌分别属于 α-变形杆菌的Alphaproteobacteria(52%)和蓝藻门的Cvanobacteria(30%);霉变籽粒中分别为Alphaproteobacteria(12%)、Cvanobacteria(4.8%)、黄单胞菌科Xanthomonadaceae(4.6%)。从属的角度看,正常籽粒和霉变籽粒间细菌和真菌群落的组成比例有明显差异。在正常籽粒中为优势菌群,而在霉变籽粒中不是优势菌群的有:薄层菌属、Radulidium、隐球菌属。在霉变籽粒中为优势菌株,而在正常籽粒中不是优势菌株的有克雷白氏杆菌属、Xanthomonadaceae、金黄杆菌属、Ramlibacter、农杆菌属、短小杆菌属、类芽孢杆菌属、土地杆菌属。通过计算两个样品中属水平上的优势细菌和真菌的丰度倍数差异发现,除核腔菌属外,两样品中的其他优势菌群差异均显著(表2)。
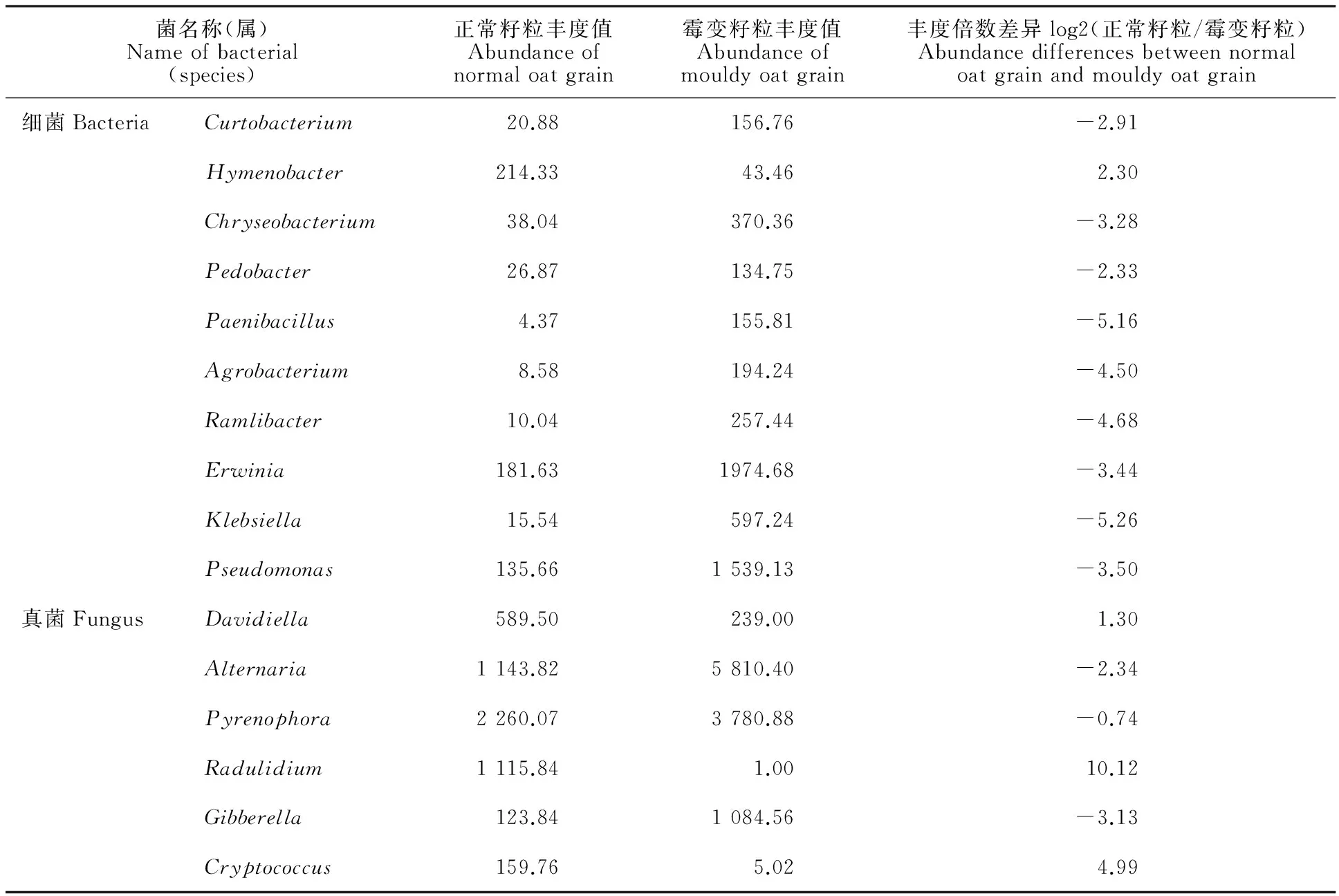
表2 属水平优势菌的差异性比较Table 2 Abundance differences of bacteria and fungus between normal oat grain and mouldy oat grain
倍数差异大于1或小于-1 则说明样品之间物种丰度差异显著。
The number in the column of abundance differences between normal oat grain and mouldy oat grain, more than 1 or less than -1 indicates the difference in species abundance between samples is significantly different.
3 讨 论
本研究中,霉变籽粒的菌群丰度和物种多样性均高于正常籽粒。所采集样品在收获期均遭受连阴雨天气,正常籽粒采集于高海拔山区,在收获期夜间气温5~10 ℃,白天温度15 ℃左右,山地不易积水,风大,田间湿度相对较小,整体环境不利于菌群生长;霉变籽粒采集于平地,收获期夜间气温8~13 ℃,白天温度15~25 ℃,同时平地易积水,田间湿度较大,整体环境有利于菌群生长。这些气候条件的差异可能是引起收获期燕麦籽粒表面菌群多样性和丰度差异的主要因素,为了避免收获期燕麦籽粒发生霉变,建议燕麦种植在高海拔坡地。
本研究中,在属水平细菌中,Pseudomonas、Erwinia在正常籽粒和霉变籽粒中的丰度差异显著,在霉变籽粒的丰度值为1 539和1 975,在正常籽粒中仅为136和182;真菌中,Alternaria、Pyrenophora、Gibberella在正常籽粒和霉变籽粒中的丰度差异显著,在霉变籽粒中丰度值分别达到5 810、3 781、1 085,在正常籽粒中丰度值分别为1 144、2 260、124。而未确定分类地位的优势真菌和细菌,在正常籽粒中高于霉变籽粒。燕麦籽粒霉变现象为表面变黑,以上已确定属的菌中仅链格孢菌菌丝和孢子为黑色,推测Alternaria是引起收获期燕麦籽粒霉变的主要原因。已有研究发现,链格孢菌广泛分布于自然界中,对环境与寄主的适应性很强,是引起植物病害的一个重要真菌类群[16];90%以上的链格孢菌可以兼性寄生在不同科的植物上,能够引起包括小麦、玉米、油菜等几十种农作物的真菌性病害,造成经济损失[17-20]。
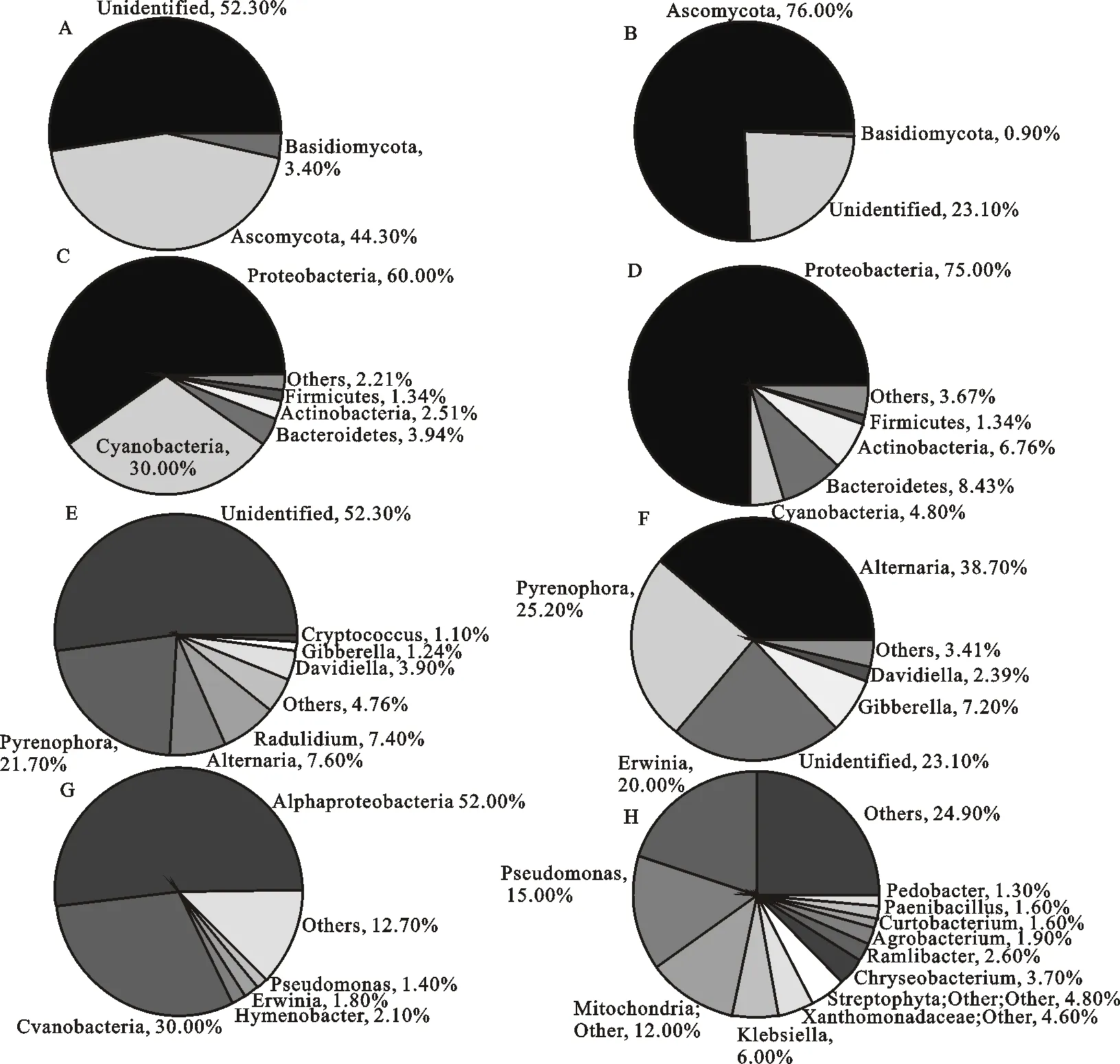
A:正常籽粒门水平上优势真菌菌群分布;B:霉变籽粒门水平上优势真菌菌群分布;C:正常籽粒门水平上优势细菌菌群分布;D:霉变籽粒门水平上优势细菌菌群分布;E:正常籽粒属水平上优势真菌菌群分布;F:霉变籽粒属水平上优势真菌菌群分布;G:正常籽粒属水平上优势细菌菌群分布;H:霉变籽粒属水平上优势细菌菌群分布。
a:Normal oat grain phyla fungus; B:Mouldy oat grain phyla fungus; C:Normal oat grain phyla bacteria; D:Mouldy oat grain phyla bacteria; E:Normal oat grain genus fungus; F:Mouldy oat grain genus fungus; G:Normal oat grain genus bacteria; H:Mouldy oat grain genus bacteria.
图4优势微生物群落门类组成分布图
Fig.4Relativedistributionofthemostabundantmicrobefromdifferentphylaandgenusinthetwosamples
燕麦作为一种具有保健功能的食品,生育后期多雨会导致籽粒表面出现不同程度霉变现象,严重影响燕麦产品品质,要预防该病害的发生,除了选择适宜的种植区,应进一步确定引起霉变的菌种,加强拮抗菌的研究,利用生物防治以确保生产合格的燕麦原料。
参考文献:
[1] 许孟会,赵 辉,王 晋,等.春季低温连阴雨对农业生产的影响及防御[J].湖南农业科学,2009(6):65.
XU M H,ZHAO H,WANG J,etal. Effects of low temperature and continuous rain on crops in spring and its preventive strategies [J].HunanAgriculturalSciences,2009(6):65.
[2] 吴洪颜,高 苹,赵 凯.春季连阴雨对江苏省夏收作物产量的影响[J].灾害学,2003,18(3):46.
WU H Y,GAO P,ZHAO K. The impact of continuous rain in spring on the summer harvest in Jiangsu Province [J].JournalofCatastrophology,2003,18(3):46.
[3] MCMULLEN M,JONES R,GALLENBERG D.Scab of wheat and barley:A re-emerging disease of devastating impact [J].PlantDisease,1997,81(12):1342.
[4] 陈晓娟,文成敬.四川省玉米穗腐病研究初报[J].西南农业大学学报(自然科学版),2002,24(1):23.
CHEN X J,WEN C J. Preliminary study of maize ear rot in Sichuan [J].JournalofSouthwestAgriculturalUniversity,2002,24(1):23.
[5] 邹小波,赵杰文. 电子鼻快速检测谷物霉变的研究[J].农业工程学报,2004,20(4):121.
ZOU X B,ZHAO J W. Rapid identification of moldy corn by electronic nose [J].TransactionsoftheChineseSocietyofAgriculturalEngineering,2004,20(4):121.
[6] 尹芳缘,黄 洁,王敏敏,等.用电子鼻区分霉变燕麦及其传感器阵列优化[J].农业工程学报,2013,29(20):263.
YING F Y,HUANG J,WANG M M,etal. Discrimination of mildewed oats using electronic nose and optimization of its sensor array [J].TransactionsoftheChineseSocietyofAgriculturalEngineering,2013,29(20):263.
[7] HANDELSMAN J. Metagenomics:Application of genomics to uncultured microorganisms [J].MicrobiologyandMolecularBiologyReviews,2004,68(4):671.
[8] 王 鹏,陈 波,张 华. 基于高通量测序的鄱阳湖典型湿地土壤细菌群落特征分析[J].生态学报,2017,37(5):1653.
WANG P,CHEN B,ZHANG H. High throughput sequencing analysis of bacterial communities in soils of a typical Poyang Lake wetland [J].ActaEcologySinica,2017,37(5):1653.
[9] 滕嘉玲,贾荣亮,赵 芸.沙埋对干旱沙区真藓结皮层细菌群落结构和多样性的影响[J].生态学报,2017,37(7):2181.
TANG J L,JIA R L,ZHAO Y. Impact of sand burial on bacterial community structure and diversity within biocrusts dominated byBryumargenteum[J].ActaEcologicaSinica,2017,37(5):2181.
[10] CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,etal. QIIME allows analysis of high-throughput community sequencing data [J].NatureMethods,2001,7(5):335.
[11] SCHLOSS P D,WESTCOTT S L,RYABIN T,etal. Introducing mothur:Open-source,platform-independent,community-supported software for describing and comparing microbial communities [J].Applied&EnvironmentalMicrobiology,2009,75(23):7538.
[12] EDGAR R C,HAAS B J,CLEMENTE J C,etal. UCHIME improves sensitivity and speed of chimera detection [J].Bioinformatics,2011,27(16):2197.
[13] EDGAR R C. Search and clustering orders of magnitude faster than BLAST [J].Bioinformatics,2010,26(19):2460.
[14] ALTSCHUL S F,GISH W,MILLER W,etal. Basic local alignment search tool [J].JournalofMolecularBiology,1990,215(3):406.
[15] WHITE J R,NAGARAJAN N ,POP M.Statistical methods for detecting differentially abundant features in clinical metagenomic samples [J].PlosComputationalBiology,2009,5(4):e1000352.
[16] 张天宇.中国真菌志(第十六卷)链格孢属[M].北京:科学出版社, 2003:96.
ZHANG T Y.Flora fungorum sinicorun(Vol.16)Alternaria[M].Beijing:Science Press,2003:96.
[17] FARR D F,BILLS G F,CHAMURIS G P,etal.Fungi on plants and plant products in the United States [J].Mycologia,1989,42(3):244.
[18] 李文强,程雪莲,赵海梅等.宁夏小麦黑胚病的病原鉴定[J].宁夏农学院学报,2001,22(3):19.
LI W Q,CHENG X L,ZHAO H M,etal.The pathogenetic fungi of the black embryo disease of wheat in Ningxia [J].JournalofNingxiaAgriculturalCollege,2001,22(3):19.
[19] 马桂珍,暴增海,杨文兰,等.河北省冬小麦种子表面粘附真菌的分离鉴定[J].种子,2002(4):16.
MA G Z,BAO Z H,YANG W L,etal.Separation and identification of seed surface carrier fungus in winter wheat from Hebei Province [J].Seed,2002(4):16.
[20] 金程凡,朱宏建,高必达,等. 湖南省油菜品种的种传链格孢菌检测[J].中国油料作物学报,2014,36(4):502.
JIN C F,ZHU H J,GAO B D,etal.SeedborneAlternariadetection of rapeseed cultivars in Hunan Province [J].ChineseJournalofOilCropSciences,2014,36(4):502.

