溶致液晶在经皮及黏膜给药系统研究的策略
郝天云,高 缘,魏元锋,张建军,钱 帅*
(中国药科大学 1中药学院;2药学院,南京211198)
经皮及黏膜给药系统是指药物以一定速率通过皮肤和经口腔黏膜、鼻腔黏膜及阴道黏膜等被吸收入血液循环而产生药效的一类制剂。经皮及黏膜给药作为一种无创伤性给药方式,具有用药方便、避免首过效应、可长时间稳定给药、不良反应小及可随时停止用药等优点。因此,经皮及黏膜给药被认为是具有良好发展前景的给药方式。目前常用的药物经皮及黏膜给药制剂包括微乳[1-2]、脂质纳米粒[3-4]、胶束[5-6]、壳聚糖纳米粒[7]等。但是,经皮及黏膜给药也存在着一定的局限性。增加制剂的生物黏附性、提高药物经皮及黏膜的透过速率,提高经皮及黏膜制剂对蛋白类药物或多种药物的载药特性,以及增加经皮及黏膜制剂的用途一直是该类制剂研究者们追求的目标。
溶致液晶(lyotropic liquid crystal)是由两亲性分子溶解在极性溶剂中形成的体系[8]。药学中常用的溶致液晶材料(如单油酸甘油酯(glyceryl monooleate,GMO)[9]、壳聚糖(chitosan,CS)[10]在体内可被降解成易吸收的物质,生物相容性好,且具良好的生物黏附性、膜渗透性和载药特性(可包裹极性或非极性药物[11-12],小分子药物、多肽类[13]、蛋白类及核酸类药物[14]等)。因此,近年来溶致液晶作为药物载体在经皮及黏膜给药领域被广泛研究。与现有的经皮及黏膜给药载体相比,溶致液晶具有较低的流动性和较大的生物黏附性,可持久黏附于皮肤或黏膜表面,提高药物的吸收,具有一定的研究及应用价值[15-16]。
笔者结合近几年来的相关文献研究及课题组对该领域的研究成果与思考,从溶致液晶作为经皮及黏膜给药载体角度出发,对溶致液晶在经皮及黏膜给药制剂研究的策略进行探讨。
1 液晶的简介
1888年,Reinitzer等[17]在加热胆甾醇苯甲酸酯晶体时,最早观察到液晶现象。次年,Lehmann等[18]采用偏光显微镜对这些酯类化合物进行深入研究,发现其具有液体流动性和连续性的同时,又具有晶体的各向异性,并将这类物质命名为“液晶”。液晶是指在一定温度范围内兼有液体和晶体特性的物质。根据形成液晶的条件及组成,可将液晶分为热致液晶(thermotropic liquid crystal)和溶致液晶(lyotropic liquid crystal)。热致液晶一般是由单一组分形成的纯化合物或多组分形成的均匀混合物,该类液晶的相变是由温度变化引起的,在一定温度范围内存在并随温度的变化而改变。目前,热致液晶广泛用于航天航空、电子电器、光通讯等科学技术领域[19]。溶致液晶一般是由具有特殊结构的有机化合物溶解于极性溶剂中,并自发形成的热力学体系[20],最常见的溶致液晶是由两亲性分子溶解于水中形成的。随两亲性分子的浓度变化,溶致液晶的结构也可能发生变化,进而包裹不同极性的药物,常作为载体被广泛应用于药物传递系统的研究[21-22]。
2 溶致液晶结构
溶致液晶通常是两亲性分子与溶剂(如水、乙醇)在一定比例范围内形成的体系。当两亲性分子以非常低的浓度加入到溶剂中时,分子以单体形式存在或吸附在液体界面。当两亲性分子浓度超过临界胶束浓度时,分子进行自组装或相互缔合成层状、球状或圆柱状胶束。其中,胶束中极性基团朝向溶剂,非极性链相互缔合。随着两亲性分子的浓度继续增加,胶束按一定规律进行排列,从而形成溶致液晶[23]。常见的溶致液晶主要有层状液晶、立方相液晶及六角相液晶(见图1)。

Figure 1 Lamellar(A),cubic(B)and hexagonal(C)phase of liquid crystal
2.1 层状液晶
在层状液晶内部,两亲性分子与水分子形成层状堆积结构,二者彼此平行排列并被水分隔,在一维方向上表现出长程有序的结构特点,宏观表现为较小的黏度及良好的流动性。然而,层状液晶在大量水中具有较差的稳定性,容易向稳定性的立方液晶或六角相液晶转变[24-25]。
2.2 立方相液晶
立方相液晶是由两亲性分子所形成的球形胶束在三维空间上进行立方堆积而得到。立方相液晶包括正相和反相两种:前者的亲水基团位于球形胶束外表面,疏水基团位于内部;后者的亲水基团位于球形胶束内部,疏水基团位于球形胶束外表面。立方相液晶具有完全分隔开的水性通道和脂性通道。立方相液晶黏度大,流动性差,能在大量水中稳定存在,宏观上表现为凝胶状,通常被用作药物缓慢释放的良好载体[26]。
2.3 六角相液晶
六角相液晶是由两亲性分子在水中所形成圆柱形胶束进一步缔合得到平行排列的六角堆积。与立方相液晶相似,六角相液晶也包括正相和反相两种。前者的亲水基团位于圆柱形胶束外表面,疏水基团位于内部;后者的亲水基团位于圆柱形胶束内部,疏水基团位于圆柱形胶束外表面,这是一种脂性通道和水性通道在二维方向上交替排列的液晶结构[27]。在宏观上,六角相液晶的流动性介于层状液晶和立方相液晶之间,也常作为药物缓慢释放的良好载体。
一般来说,两亲性分子与溶剂形成哪种相态的溶致液晶主要受两亲性分子的结构、溶剂性质、外界温度、压力、pH及添加物性质等因素影响。例如,GMO和油醇甘油酸酯(oleyl glyceride,OG)具有相同的相对分子质量,但二者分子结构中羰基所处位置不同使得二者在过量水中表现出较大差异,GMO在过量水中形成立方相液晶[28-29],而 OG在过量水中只能形成反向六角相液晶[29]。本课题组在研究GMO/水体系时,发现当水含量小于5%时,体系为反向胶束相;含水量为5%~20%时,体系为层状相液晶;含水量为为20%~35%时,体系为立方相液晶,且当含水量继续增加,立方相液晶与过量水可以共存。此外,本课题组还发现油酸和单硝酸异山梨酯的加入可改变GMO/水液晶体系的内部结构和所包裹药物的释放行为[30]。
3 溶致液晶材料及其改性
3.1 常规液晶材料
溶致液晶的形成,通常要求体系中具有两亲性分子:即分子一端具有亲水性,另一端具有亲脂性。在药学领域[8,22],常见的形成溶致液晶的两性物质有两类:一类是脂肪酸盐、油酸盐、烷基磺酸盐等,其亲水部分如羧基、磺酸基等与长链疏水基团相连;另一类是具有两亲性基团的化合物,如磷脂类、OG、PG(phytanylglycerate)、GMO及植烷三醇(phytantriol,PT)、表面活性剂等。
在形成溶致液晶的材料中,被广泛研究的主要有GMO和PT。与PT相比,GMO因具有更优良的生物相容性和易降解性,口服或外用具有更低的毒性和刺激性,是溶致液晶研究领域的首选材料[31-32]。PT所形成溶致液晶尽管具有结构稳定的优势,但却有着一定的细胞毒性。PT形成的液晶纳米粒对人肺泡基底细胞膜的完整性具有一定的破坏作用,且可通过胞饮作用抑制细胞膜的重建,而GMO则具有较好的安全性[33]。此外,GMO在FDA食品添加剂中的分类为GRAS(generally recognized as safe,GRAS),认为属于安全性添加剂,且归类于FDA非活性成分指南中[34]。
3.2 改性液晶材料
GMO具有良好的形成溶致液晶的能力及良好生物相容性,作为溶致液晶材料具有显著的优势,然而其分子结构内含有酯键,在体内胃肠环境中容易被分解。为了提高GMO所形成溶致液晶的稳定性,并进一步改进其透皮渗透性、生物黏附性及靶向性等特点,目前已有研究对GMO进行一定衍生化以达到更优越的药学应用性能,如在GMO的分子结构上或GMO所形成的溶致液晶纳米粒表面交联一些具有靶向性的化合物(如氨基酸、多糖等),使包裹药物的液晶小粒子在特定部位释放药物。本课题组将GMO制备成氧化型GMO(OGMO),并通过亚胺键(-C=N-)与壳聚糖进行枝接形成OGMO-CS聚合物,发现该聚合物的抗酯解能力得到显著改善[35]。本课题组还将GMO与CS的2-位氨基进行枝接形成GMO-壳聚糖聚合物,并以辛伐他汀为模型药物,与GMO液晶纳米粒相比,交联CS的液晶纳米粒不仅具有更强的抗酯解能力,而且可更持久的释放药物[36]。此外,也可通过添加稳定剂[如泊洛沙姆407、维生素E聚乙二醇琥珀酸酯、聚(环氧乙烷)硬脂酸酯等]以提高PT、GMO等液晶材料的性能,从而改善所形成液晶体系的稳定性[37]。
4 溶致液晶在经皮及黏膜给药的研究策略探讨
溶致液晶因其独特的内在结构和理化性质而在经皮及黏膜给药方面具有明显的优势,主要包括:①具有良好的透皮渗透性,可携带所包裹药物穿过角质层屏障进入深层皮下组织,或穿过细胞膜的磷脂双分子层,进而增加药物在血液、细胞及组织中的浓度;②具有良好的生物黏附性,可很好地黏附于皮肤或黏膜表面,长久释放药物;③具有良好的药物包裹适用性,既可包裹大分子药物,又可包裹小分子药物,既可包裹极性药物,又可包裹非极性药物,具有广泛的候选药物范围。溶致液晶的这种特点不仅适用于包裹各种类型的化学药物单体,而且适用于包裹多种不同类型的化学药物、具有复杂成分的中药提取物及成分更为复杂的中药复方,具有显著的载药优势;④立方相和六角相液晶属于热力学稳定体系,在过量水中可稳定存在,具有良好的稳定性;⑤形成溶致液晶的材料往往为脂质分子,与细胞膜磷脂双分子层具有相似的结构,所以形成的溶致液晶具有良好的生物相容性。
4.1 经皮给药系统(transdermal administration)
溶致液晶中的立方相和六角相液晶具有良好的生物黏附性和较低的流动性,外观凝胶状,适用于制备成凝胶制剂,可直接涂抹于皮肤患处,不仅与皮肤表面具有良好的亲和性,而且用药结束后更易于洗除。
在药物的经皮吸收过程中,角质层是阻碍该过程的主要屏障[38],而GMO、聚氧乙烯20十六烷醇等双亲分子可与角质层脂质相互作用,使溶致液晶穿过角质层,进而释放药物(图 2)[15]。如 Zhang等[39]将难溶于水且易水解的黄芩苷载入由GMO、二甘醇单乙醚(Transcotol P)、水形成的立方相液晶凝胶(cubic phase gel,CPG)内。体外皮肤渗透性实验表明,该立方相液晶凝胶内,黄芩苷12 h的经皮通量较基于卡波姆(Carbopol)的黄芩苷非液晶水凝胶(HDG)提高了76.7~200.2倍,也较黄芩苷层状液晶(lamellar phase gel,LPG)提高了 6.7~17.6倍。在大鼠体内微透析实验的研究中,CPG内黄芩苷的AUC0-10h较 HDG提高约1.6倍。此外,将该立方液晶体系置于常温环境放置90 d,液晶的结构及黄芩苷的含量无明显变化,说明该立方液晶凝胶具有良好的稳定性。
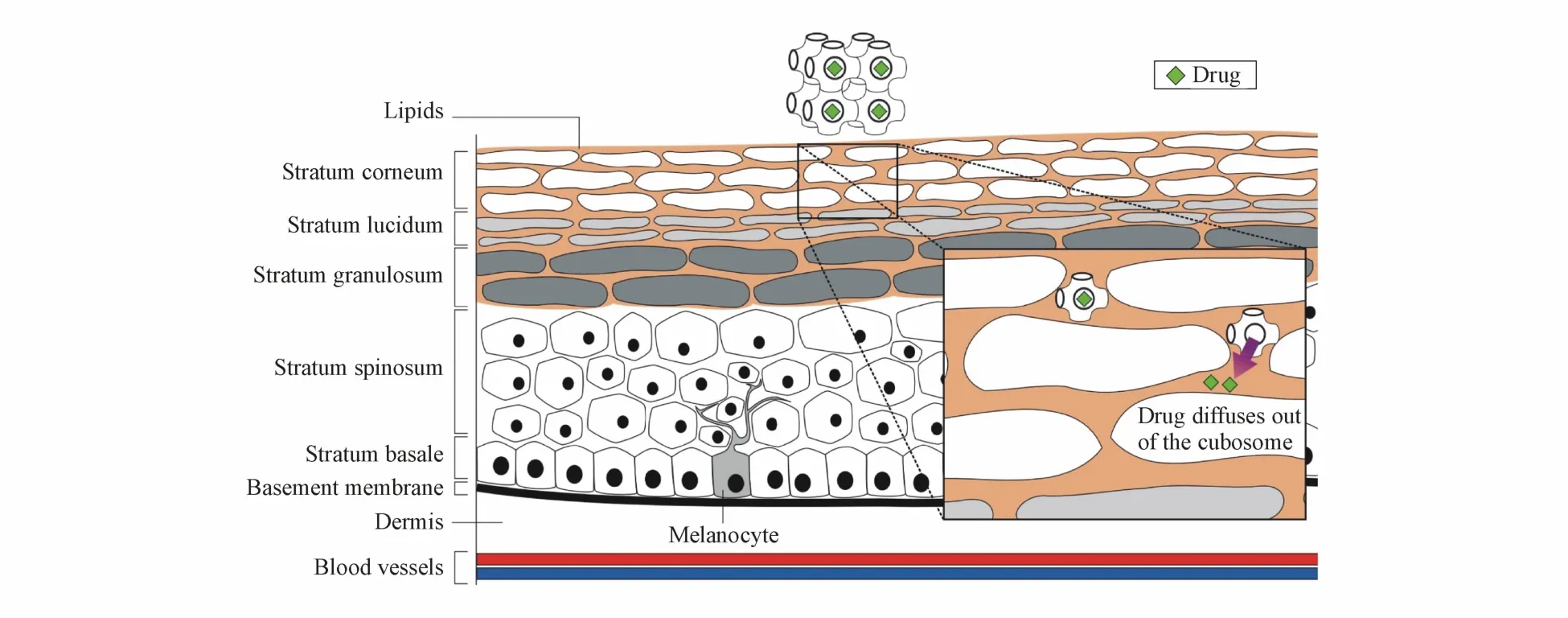
Figure 2 Transdermal drug delivery using liquid crystal(Note:Representative primitive bicontinuous cubic phase is shown)
虽然液晶凝胶制剂表现出显著的优势,但是凝胶制剂通常具有较大的黏度,这使得制剂的流动性差,而难溶性药物(如黄芩苷[39])的加入可使溶致液晶凝胶的黏度进一步增大。若直接用药,可能会由于药物释放速率过慢使得血药浓度上升缓慢,疗效变差或延迟。这可通过降低体系黏度、增加药物(尤其是脂溶性药物)的释放来解决,通常可以采用以下策略:①将立方相和六角相液晶经机械分散和高压均质成液晶纳米粒,以增加体系流动性,同时增加释药速率,在制剂的设计上可制备成使用更加灵活的制剂(如纳米粒洗剂、擦剂或涂抹剂等)。例如Li等[40]将丹皮酚载入GMO与水形成的立方液晶凝胶中,采用机械分散和高压均质法将其制备成粒径小于100 nm的液晶纳米粒,小角度X射线散射(small-angle X-ray scattering,SAXS)表征所得纳米粒的液晶结构仍为立方相。稳定性试验表明该纳米粒在4和25℃条件下具有良好的稳定性。此外,经皮扩散实验结果表明,丹皮酚立方液晶纳米粒可持续释药24 h,而且较市售丹皮酚软膏(非液晶体系)具有更高的经皮吸收量,对新西兰兔背部皮肤的刺激性较市售软膏也显著降低。②采取其他液晶材料,例如,Kadhum等[11]分别采用GMO和 C17-单甘油酯(C17-monoglycerol ester,MGE)与 4种不同极性的药物(氨甲环酸、4-甲氧基-水杨酸、儿茶素及钙黄绿素)载入两种基质的溶致液晶,得到 GMO-液晶(GMO-LC)和 MGE-液晶(MGE-LC),SAXS表征两种液晶均为六角相,且具有相同的粒径分布和电位。然而,相较于GMO-LC,MGE-LC具有更低的黏度(~3 500mPa·svs~2 000mPa·s)、更快的药物释放速率(约1.7倍)及更好的经皮渗透性(约1.8倍)。③加入其他物质(如油、表面活性剂等[12]),制备成液晶乳剂,减小体系黏度,增加释药速率和患者用药顺应性,如Kang等[41]将棕榈酸视黄酯加入层状液晶形成乳剂,所得液晶乳剂不仅在体外细胞扩散试验中扩散效果显著提高,而且流动性与普通乳剂相近。
对于大分子药物(如多肽类、蛋白质类及核酸类等),溶致液晶同样可增加药物的经皮渗透性,具有显著的载药优势。在大分子药物经皮给药的研究领域,经皮免疫是近几年来被重点关注的一种给药策略[42-43],主要是将抗原与佐剂通过皮肤吸收后诱导全身产生免疫反应,避免注射带来的疼痛和潜在的感染及传播疾病的风险,可作为替代注射等胃肠外免疫的一种有效方法,具有广阔的应用前景。例如,Rattanapak等[44]将蛋白抗原分别包裹于脂质体和立方液晶纳米粒中,在体外猪仔皮肤渗透性研究中发现,未包封的脂质体纳米粒内蛋白抗原主要分布在皮肤毛囊附近,而立方液晶纳米粒中蛋白抗原可透过角质层并分布于皮肤组织内部,表现出良好的经皮渗透性。此外,以溶致液晶作为药物贮库,联合微针技术可进一步增加药物渗透性,进而使经皮免疫疗法更具有研究与应用前景。如Rattanapak等[45]采用微针对猪仔皮肤进行预处理,然后考察立方液晶纳米粒作为载体对蛋白抗原经皮渗透性的影响。结果表明,与未经微针预处理相比,采用微针预处理后,立方液晶纳米粒中蛋白抗原的渗透性得到显著提高。
4.2 黏膜给药系统(mucosal administration)
与经皮给药相似,溶致液晶在黏膜给药系统的应用同样具备生物黏附性良好、控制药物释放及避免胃肠道首过效应等优势。此外,黏膜给药后药物的吸收还不受角质层等屏障阻碍,更易于吸收入血,且液晶体系往往还可以吸收黏膜表面的水分而发生内部结构的改变,可进一步增大黏性及延长释药时间,具有较为重要的研究价值。
4.2.1 鼻腔黏膜给药(nasalmucosal administration)
(1)溶致液晶在经鼻腔黏膜给药后,因液晶载体具有较强的生物黏附性和促药物透皮渗透性,所包裹药物往往很快吸收入血。例如Carvalho等[46]将抗病毒药齐夫多定(zidovudine,AZT)包裹于由PPG-5-鲸蜡醇聚醚-20(Procetyl®AWS)、油酸及水形成的液晶前体制剂,偏光显微镜表征该前体制剂不具有液晶结构,但将其与等量的人造鼻黏膜液体混合后则形成了具有马耳他十字状的层状液晶;黏附力实验结果表明该层状液晶的黏性是前体制剂的3倍,体外渗透性结果表明其渗透性是AZT水溶液的19倍;体内药代动力学结果表明,该前体制剂经鼻腔给药后的达峰时间仅为6.7 min,与静注齐夫多定溶液(5 min)相近,具有较快的药物吸收速率。
(2)鼻腔-脑靶向-液晶给药系统的研究。一般来说,药物进入脑组织的途径有两条:第一是先进入体循环,然后通过血-脑脊液屏障进入脑组织;第二是通过鼻腔嗅觉通路直接进入脑组织[47]。近年来,治疗脑部疾病的药物可通过鼻腔给药实现药物的靶向性,提高药物进入脑部组织的浓度,从而达到治疗脑部疾病的目的,而溶致液晶可促进药物进入脑组织。如Abdel-Bar等[48]将治疗中枢神经系统疾病的药物氯硝西泮载入由卵磷脂、吐温80、乙醇和水形成的层状液晶微乳液中,控制乳液粒径小于100 nm,通过鼻腔内嗅觉部位给药后发现,药物进入血液循环的达峰时间(tmax)约为30 min,而进入脑组织的tmax仅为10 min,较通过静脉给药氯硝西泮后的tmax(~30 min)显著缩短,脑组织浓度-时间曲线下面积(AUC0-∞)较静脉注射提高约7.2倍。药物脑靶向效率和鼻腔到脑组织的药物传送实验结果表明:与注射给药相比,经鼻腔给予液晶纳米粒后药物具有更好的脑靶向特性。此外,鼻黏膜刺激性实验表明,该液晶微乳液不具有黏膜刺激性,是一种较安全、高效的药物传递系统。
本课题组首先将小分子药物他克林(tacrine,THA)载入由普流罗尼克F-127、壳聚糖及聚乙二醇8000等形成的非液晶凝胶(T-Gel)中,发现相比于口服THA水溶液,凝胶中THA在经鼻腔黏膜给药后可获得显著提高血浆中cmax(约2.0倍)、AUC0-6h(2.1倍)及脑组织中cmax(约 3.5倍)、AUC0-6h(约 3.0倍)[49]。在后续研究中,本课题组将GMO、THA及泊洛沙姆(poloxamer 407)分散于水中,通过超声分散法制备成粒径约为100 nm的立方液晶纳米粒,然后将CS和PEG的醋酸水溶液加入到纳米粒中制备得到稳定性良好的他克林液晶纳米粒(T-PEG-CS-LCNPs)。通过对脑组织中药物浓度检测发现,与T-Gel相比,T-PEG-CS-LCNPs中THA具有更快的达峰时间(60 minvs25 min),且AUC0-8h提高约2.3倍。此外,本课题组还成功将多肽神经营养因子β-NGF包裹于上述空白液晶纳米粒(PEG-CS-LCNPs)中,在鼻腔黏膜给药后发现,脑组织中β-NGF的浓度较β-NGF的卡波姆水基质(非液晶体系)得到显著性提高(约2.8倍),且释药时间长达24 h,这可能成为治疗阿尔茨海默病的“新希望”。因此,以溶致液晶为药物载体,联合鼻腔黏膜给药方式可能会成为替代注射给药和口服给药的一种有效策略,具有重要的研究价值。
4.2.2 口腔黏膜给药(oralmucosal administration)
与鼻腔黏膜给药相似,溶致液晶及其前体制剂也可以用于口腔黏膜给药,以治疗口腔疾病,如Souza等[50]将抗菌药物聚(六亚甲基双胍)盐酸盐[poly(hexamethylenebiguanide)hydrochloride,PHMB]载入GMO/水形成的层状液晶中,发现在pH 7.4的等渗磷酸盐缓冲液中,与相同浓度的PHMB溶液相比,虽然层状液晶中PHMB的释放度显著降低,却具有同等浓度PHMB溶液相同的抗金黄色葡萄球菌和白色念珠菌活性。究其原因,GMO在接触细胞表面时会对细胞膜脂质层造成暂时的紊乱,并在抗菌活性上起到协同作用。这可减轻因长期使用PHMB治疗而带来的不良反应。因此,GMO等两亲性分子所形成的载药溶致液晶在治疗疾病时可能与药物具有一定的药效协同作用。利用该特点可以降低给药剂量,具有良好的临床应用价值。
4.2.3 阴道黏膜给药(vaginalmucosal administration) 溶致液晶材料与水形成的液晶体系通常具有较低的刺激性,安全性高,可用于阴道给药。然而立方相、六角相液晶因具有非常差的流动性,阴道用药顺应性差。采用前体制剂给药策略,即将液晶以流动性大的前体制剂给药,前体制剂一旦与阴道黏膜接触,即可吸收水分而形成黏度大的立方相或六角相液晶,黏附于阴道黏膜表面,缓慢释放药物,这种制剂策略可减少用药次数,增加患者用药顺应性。例如,Salmazi等[51]将具有抗炎活性的中药单体姜黄素包裹于由聚氧丙烯-5-聚氧乙烯-20鲸蜡醇、油酸、壳聚糖及泊洛沙姆407形成的各向同性的前体制剂,发现该前体制剂与等量人造阴道黏液混合可转变成各向异性的六角相液晶,流动性降低,黏附性增加。在体外抗真菌活性研究中,与姜黄素溶液相比,该前体制剂中姜黄素具有更强的抗白色念珠菌活性。
4.3 溶致液晶在中药经皮或黏膜给药的研究与应用策略
自古以来,中药提取物或中药复方被广泛用于慢性疾病的治疗,发挥着不可替代的作用。然而,中药提取物或中药复方中成分复杂,大多数活性成分,如鞣质和皂苷类化合物等,具有较好的水溶性,但不能穿过细胞的脂质膜,而脂溶性分子(如黄酮苷元、萜类化合物等)却具有较差的溶解和溶出特性,这阻碍了中药制剂的研究与开发。因此,寻找一种可同时包裹多种类型药物的载体成为制剂开发的关键。立方相和六角相液晶内部具有互不相通的水性通道和脂性通道,可同时包裹不同极性药物,具有较强的载药包容性、较高的载药量,这也使其在包裹含复杂成分的中药提取物或中药复方药物方面具有更大可行性(图3)。
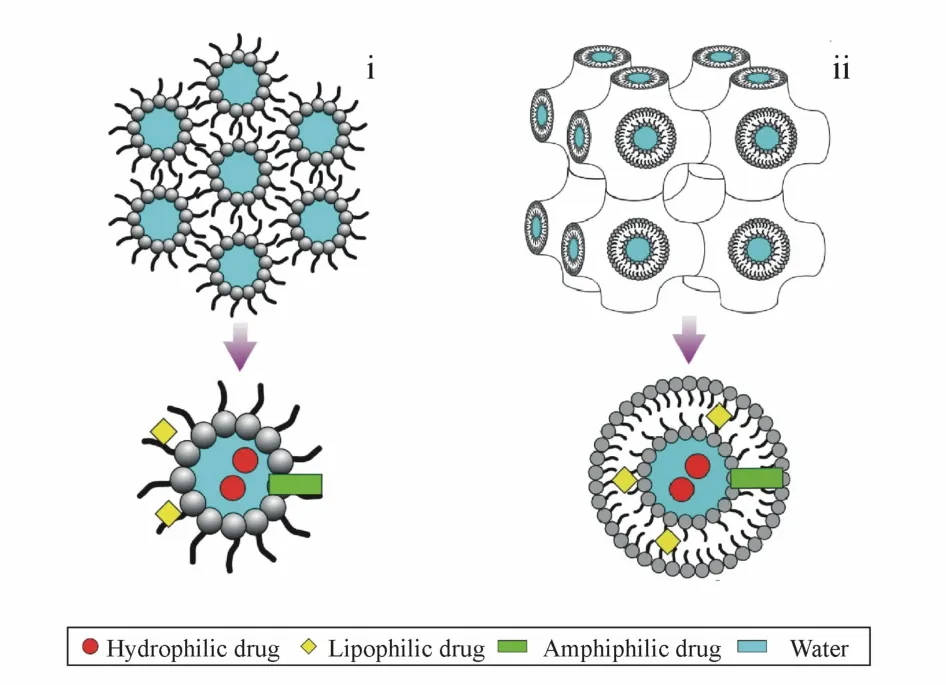
Figure 3 Possible localization of drugs in the following:i,reverse hexagonal phase;ii,reverse bicontinuous cubic phase(primitive)
Ramos等[52]将含有多种成分的仙人掌提取物包裹于由油酸、聚氧丙烯-5-聚氧乙烯-20鲸蜡醇及卡波姆947P形成的各向同性前体制剂,该前体制剂与等量人造阴道黏液混合后会转变为具有各向异性的六角相液晶,黏膜黏附性参数也显著提高(提高至少2倍)。借助于六角相液晶内部的特殊结构,单次阴道用药后,该前体制剂可控制由念珠菌引起的阴道感染长达10 d,具有良好的抗菌效果。此外,与仙人掌提取液相比,该前体制剂具有更强的抑菌能力(最小抑菌浓度范围:125~62.5 μg/mLvs62.5~31.2μg/mL)。因此,在中药和中药复方提取物的制剂开发中,溶致液晶在载药和促吸收方面具有广泛的研究和应用前景。
5 结 语
溶致液晶独特的内部结构特征和物理化学特性使其作为药物载体具有较大的优势(如高生物黏附性、高促渗透性、良好的载药特性等),尤其是应用于经皮及黏膜给药系统。本文主要从经皮及黏膜给药途径出发,结合近几年文献报道和本课题组对溶致液晶和鼻腔给药的研究,为溶致液晶在经皮和黏膜给药途径的研究策略进行深入探讨,尤其着重突出其在鼻腔给药系统的研究。
作为非常有潜力的新型载药系统之一,溶致液晶的发展越来越受到药学界的关注。然而,溶致液晶在经皮及黏膜给药系统中的研究和应用还不够完善,对于如何建立材料的质量标准及产业化还有待深入研究。此外,溶致液晶作为新兴载体还存在一些问题亟待解决,如实现溶致液晶纳米粒、凝胶等制剂制备的产业化等问题
[1] Figueiredo KA,Medeiros SC,Neves JK,etal.In vivoevaluation of anticonvulsant and antioxidant effects of phenobarbital microemulsion for transdermal administration in pilocarpine seizure rat model[J].Pharmacol Biochem Behav,2015,131:6-12.
[2] Tran N,Mulet X,Hawley AM,et al.Nanostructure and cytotoxicity of self-assembled monoolein-capric acid lyotropic liquid crystalline nanoparticles[J].RSC Adv,2015,5(34):26785-26795.
[3] Song A,Zhang X,Li Y,et al.Effect of liquid to solid lipid ratio on characterizations of flurbiprofen-loaded solid lipid nanoparticles(SLN)and nanostructured lipid carriers(NLC)for transdermal administration[J].Drug Dev Ind Pharm,2016,42(8):1308-1314.
[4] Malviya N,Somisetty K,Vemula K.Design and development of a novel transmucosal patch embedded with diclofenac diethylamine loaded solid lipid nanoparticles[J].J Young Pharmacists,2014,7(1):45-55.
[5] Sosnik A,Menaker Raskin M.Polymericmicelles inmucosal drug delivery:challenges towards clinical translation[J].Biotechnol Adv,2015,33(3):1380-1392.
[6] Dou JF,Zhang HQ,Liu XJ,et al.Preparation and evaluationin vitroandin vivoof docetaxel loaded mixed micelles for oral administration[J].Colloid Surface B,2014,114(2):20-27.
[7] Martirosyan A,Olesen MJ,Howard KA.Chitosan-based nanoparticles formucosal delivery of RNAi therapeutics[J].Adv Genet,2014,88:325-352.
[8] Kim DH,Jahn A,Cho SJ,etal.Lyotropic liquid crystal systems in drug delivery:a review[J].Int JPharm Investig,2015,45(1):1-11.
[9] Li J,Wu L,Wu WJ,et al.A potential carrier based on liquid crystal nanoparticles for ophthalmic delivery of pilocarpine nitrate[J].Int JPharm Investig,2013,455(1/2):75-84.
[10]Marin L,Popescu MC,Zabulica A,et al.Chitosan asmatrix for bio-polymer dispersed liquid crystal systems[J].Carbohydr Polymers,2013,95(1):16-24.
[11]Kadhum WR,Sekiguchi S,Hijikuro I,et al.A novel chemical enhancer approach for transdermal drug delivery with C17-monoglycerol ester liquid crystal-forming lipid[J].J Oleo Sci,2017,66(5):443-454.
[12]Martiel I,Baumann N,Vallooran JJ,et al.Oil and drug control the release rate from lyotropic liquid crystals[J].J Control Release,2015,204:78-84.
[13]Park K.Lyotropic liquid crystal for long-term delivery of peptide drugs[J].JControl Release,2014,185(1):139-139.
[14]Clogston J,Caffrey M.Controlling release from the lipidic cubic phase.Amino acids,peptides,proteins and nucleic acids[J].J Control Release,2005,107(1):97-111.
[15]Rajabalaya R,Musa MN,KifliN,etal.Oral and transdermal drug delivery systems:role of lipid-based lyotropic liquid crystals[J].Drug Des Dev Ther,2017,11:393-406.
[16]Calixto GMF,Duque C,Aida KL,et al.Development and characterization of p1025-loaded bioadhesive liquid-crystalline system for the prevention ofStreptococcus mutansbiofilms[J].Int J Nanomed,2018,13:31-41.
[17]Reinitzer F.Beiträge zur Kenntniss des cholesterins[J].Chem,1888,9(1):421-441.
[18]Lehmann O.Ueber fliessende Krystalle[J].Z Phys Chem,1889,4:462-472.
[19]Darla MR,Varghese S.Synthesis and characterisation of azomethine class thermotropic liquid crystals and their application in nonlinear optics[J].Liq Cryst,2012,39(1):63-70.
[20]Guo CY,Wang J,Cao FL,et al.Lyotropic liquid crystal systems in drug delivery[J].Drug Discov Today,2010,15(23/24):1032-1040.
[21]Nguyen TH,Hanley T,Porter CJ,et al.Phytantriol and glyceryl monooleate cubic liquid crystalline phases as sustained-release oral drug delivery systems for poorly water soluble drugs I.Phase behaviour in physiologically-relevantmedia[J].J Pharm Pharmacol,2010,62(7):844-855.
[22]Boselli E,Pacetti D,Lucci P,et al.Characterization of phospholipid molecular species in the edible parts of bony fish and shellfish[J].JAgric Food Chem,2012,60(12):3234-3245.
[23]Tian XH,Jiang Q,Xie MG.Research advancement of structures and apllication of lyotropic liquid crystals[J].Chem Res Appl(化学研究与应用),2002,14(2):119-122.
[24]Zhaoa J,Wanga ZN,Weib XL,et al.Phase behaviour and rheo-logical properties of the lamellar liquid crystals formed in dodecyl polyoxyethylene polyoxypropylene ether/water system[J].Indian JChem,2011,50(5):641-649.
[25]Spicer PT.Progress in liquid crystalline dispersions:cubosomes[J].Curr Opin Colloid In,2005,10(5):274-279.
[26]Cervin C,Vandoolaeghe P,Nistor C,et al.A combinedin vitroandin vivostudy on the interactions between somatostatin and lipid-based liquid crystalline drug carriersand bilayers[J].Eur J Pharm Sci,2009,36(4/5):377-385.
[27]Ma K,Wu LH,Zhang MY,et al.Advances in research on cubic and hexagonal liquid crystals as drug delivery system[J].Prog Chem(药学进展),2012,36(1):14-21.
[28]Li,Gao Y,Zhang JJ,et al.Effect of poloxamer F127 and paeonol on GMO-based liquid crystal transformation[J].Acta Chim Sin,2011,69(13):1503-1508.
[29]Boyd BJ,Whittaker DV,Khoo SM,et al.Lyotropic liquid crystalline phases formed from glycerate surfactants as sustained release drug delivery systems[J].Int JNanomedicine,2006,309(1/2):218-226.
[30]Zhang XY,Ma D,Zheng YZ,etal.Effectof oleic acid and isosorbide mononitrate loading on the phase diagrams andin vitrorelease profiles of glyceryl monooleate liquid crystalline system[J].JChina Pharm Univ(中国药科大学学报),2016,47(5):581-586.
[31]Garti N,Libster D,Aserin A.Nano Science and Technology[M].Switzerland:Springer International Publishing,2014:355-414.
[32]Bode JC,Kuntsche J,Funari SS,et al.Interaction of dispersed cubic phaseswith blood components[J].Int JPharm,2013,448(1):87-95.
[33] Hinton TM,Grusche F,Acharya D,et al.Bicontinuous cubic phase nanoparticle lipid chemistry affects toxicity in cultured cells[J].Toxicol Res,2013,3(1):11-22.
[34]Ganem-Quintanar A,Quintanar-Guerrero D,Buri P.Monoolein:a review of the pharmaceutical applications[J].Drug Dev Ind Pharm,2000,26(8):809-820.
[35]Zhang JJ,Fu M,Zhang MY,et al.Synthesis of oxidized glycerol monooleate-chitosan polymer and its hydrogel formation for sustained release of trimetazidine hydrochloride[J].Int J Pharm,2014,465(1/2):32-41.
[36]Gao Y,Zheng YZ,Fu M,etal.Preparation of liquid crystal nanoparticlemicrosphere encapsulated by chitosan(壳聚糖包封液晶纳米粒所得微球及其制备方法):CN,105030732A[P].2015-11-11.
[37]Chong JY,Mulet X,Waddington LJ,et al.High-throughput discovery of novel steric stabilizers for cubic lyotropic liquid crystal nanoparticle dispersions[J].Langmuir,2012,28(25):9223-9232.
[38]Nemanic MK,Elias PM.In situprecipitation:a novel cytochemical technique for visualization of permeability pathways in mammalian stratum corneum[J].J Histochem Cytochem,1980,28(6):573-578.
[39]Zhang Y,Zhang K,Guo T,et al.Transdermal baicalin delivery using diethylene glycolmonoethyl ether-mediated cubic phase gel[J].Int JNanomedicine,2015,479(1):219-226.
[40]Li JC,Zhu N,Zhu JX,et al.Self-assembled cubic liquid crystalline nanoparticles for transdermal delivery of paeonol[J].Med SciMonit,2015,21:3298-3310.
[41]Kang MK,Kim Y,Gil S,et al.Effects of liquid crystal-based formulation on transdermal delivery of retinyl palmitate and proliferation of epidermal cells[J].Macromol Res,2016,24(1):44-50.
[42]Bal SM,Ding Z,Van RE,et al.Advances in transcutaneous vaccine delivery:do all ways lead to Rome[J]?JControl Release,2010,148(3):266-282.
[43]Ono A,Ito S,Sakagami S,et al.Development of novel faster-dissolvingmicroneedle patches for transcutaneous vaccine delivery[J].Pharmaceutics,2017,9(3):1-13.
[44]Rattanapak T,Young K,Rades T,et al.Comparative study of liposomes,transfersomes,ethosomes and cubosomes for transcutaneous immunisation:characterisation andin vitroskin penetration[J].JPharm Pharmacol,2012,64(11):1560-1569.
[45]Rattanapak T,Birchall J,Young K,etal.Transcutaneous immunization usingmicroneedles and cubosomes:mechanistic investigations using optical coherence tomography and two-photonmicroscopy[J].JControl Release,2013,172(3):894-903.
[46]Carvalho FC,Campos ML,Peccinini RG,et al.Nasal administration of liquid crystal precursormucoadhesive vehicle as an alternative antiretroviral therapy[J].Eur J Pharm Biopharm,2013,84(1):219-227.
[47]Liu QF,Shen YH,Chen J,et al.Nose-to-brain transport pathways ofwheatgerm agglutinin conjugated PEG-PLA nanoparticles[J].Pharm Res,2012,29(2):546-558.
[48]Abdel-Bar HM,Abdel-Reheem AY,Awad GA,et al.Evaluation of brain targeting and mucosal integrity of nasally administrated nanostructured carriers of a CNS active drug,clonazepam[J].J Pharm Pharm Sci,2013,16(3):456-469.
[49] Qian S,Wong CY,Zuo Z.Development,characterization and application ofin situgel systems for intranasal delivery of tacrine[J].Int JNanomedicine,2014,468(1/2):272-282.
[50]Souza C,Watanabe E,Borgheticardoso LN,et al.Mucoadhesive system formed by liquid crystals for buccal administration of poly(hexamethylene biguanide)hydrochloride[J].J Pharm Sci,2014,103(12):3914-3423.
[51]Salmazi R,Calixto G,Bernegossi J,et al.A curcumin-loaded liquid crystal precursor mucoadhesive system for the treatment of vaginal candidiasis[J].Int J Nanomedicine,2015,10:4815-4824.
[52]dos Santos Ramos MA,Calixto G,de Toledo LG,et al.Liquid crystal precursor mucoadhesive system as a strategy to improve the prophylactic action ofSyngonanthusnitens(Bong.)Ruhland against infection byCandida krusei[J].Int J Nanomedicine,2015,10:7455-7466.

