富勒烯及其衍生物在医药领域的应用研究进展
刘泽员,郭亮亮,张 静
(郑州大学化工与能源学院,郑州450001)
富勒烯结构完美、性能稳定,在能源、环境、高效催化、生物医药、量子计算以及日常生活中都有广泛应用,由Kroto等[1]于1985年在激光蒸发石墨的过程中首先发现。富勒烯在医药领域具有很大应用潜力,是因为富勒烯具有很强的光动力活性、清除自由基活性,并可以作为基因载体及药物载体,这使得它能在治疗肿瘤及由氧化应激导致的疾病等方面发挥重要作用。但其自身存在以下缺点:①在水和极性溶剂中的溶解性极差;②对细胞产生毒性;③肿瘤靶向能力差。这些缺点成为限制富勒烯在医药领域应用的瓶颈,因此克服这些缺点能使富勒烯在医药领域得到更广泛的应用。
目前改善富勒烯水溶性较为常用的方法有以下3种:(1)超声制备富勒烯水溶胶;(2)制备富勒烯的水溶性包结物;(3)引入功能基团进行球外修饰,即在富勒烯碳笼表面结合水溶性基团,如添加羟基、羧基、氨基等合成富勒烯衍生物。而其中富勒烯衍生物不仅具有富勒烯的良好特性,并且还具有较好水溶性、低毒性及对肿瘤的良好靶向性等优点,这使其在包括抗肿瘤、药物载体、抗菌、抗氧化应激等方面具有很大应用前景。本文从富勒烯及其衍生物在调控肿瘤微环境上发挥的重要作用出发,分别介绍了它们在药物载体、光动力疗法及抗氧化应激方面的应用研究进展。
1 抗肿瘤——调控肿瘤微环境
肿瘤微环境是由肿瘤细胞、基质细胞和细胞外基质等构成的局部稳态环境,为肿瘤的发生、发展、侵袭、转移等提供物质基础。当微环境中的基质细胞被肿瘤细胞转化时会在周围产生细胞因子及基质降解酶,通过诱生新生血管、抑制免疫反应促进肿瘤发展[2]。C60(OH)22(富勒醇)、Gd@C82(内包钆金属富勒烯)与Gd@C82(OH)22(内包钆金属富勒醇)具有调控肿瘤微环境而不直接“杀死”肿瘤细胞的能力。近几年,对这3种富勒烯衍生物纳米颗粒作为药物在靶向调控肿瘤微环境上的最新研究主要集中在:①抑制肿瘤细胞转化间质细胞;②监禁肿瘤细胞并抑制其侵袭转移;③抑制肿瘤新生血管形成并破坏其已有血管;④克服免疫耐受、激活免疫反应。
骨髓间充质干细胞(BDMSCs)可被招募到肿瘤中构成肿瘤微环境并转化为恶性细胞,反过来BDMSCs可通过细胞因子激发细胞信号通路来促进肿瘤细胞的增殖和转移。Nie等[3]发现BDMSCs和4T1乳腺癌细胞之间的这种相互作用能被C60(OH)22纳米颗粒减弱或阻断,C60(OH)22通过调节肿瘤微环境中的ERK、p38-MAPK及其下游的NF-κB信号通路抑制恶性分化的BDMSCs(ERK:细胞外调节蛋白激酶,p38-MAPK:p38蛋白激酶,NF-κB:一个转录因子蛋白家族),最终达到抑制4T1肿瘤细胞生长和转移的目的。
肿瘤细胞在侵袭和转移过程中须穿透基底膜和细胞外基质,合成并分泌基质降解酶以降解细胞外基质。这是肿瘤细胞实现侵袭和转移的重要步骤。基质金属蛋白酶(MMP)属于基质降解酶的一种,Meng等[4]发现 Gd@C82(OH)22通过构成物理屏障能将癌变组织严格限制在原发部位内加以“监禁”,同时切断其与肿瘤微环境的通信,使MMP的产生受阻,从而降低侵入性肿瘤细胞的转移力。
血管生成是肿瘤转移的前提和基础,血管还可作为肿瘤转移的通道,并为肿瘤生长增殖提供营养物质,故通过阻止肿瘤血管新生、破坏肿瘤已有血管能够切断肿瘤营养供应并最终杀灭之。Sun等[5]发现 C60(OH)22能通过抑制 MMP2、MMP9、HDAC1和HDAC2酶的活性以及缺氧诱导因子(HIF-1α)和血管内皮生长因子(VEGF)的表达,进一步抑制人脐静脉内皮细胞异种移植的小鼠体内的血管生成。研究人员利用肿瘤血管的异常泄漏性,在Gd@C82或Gd@C82与丙氨酸的纳米复合物渗出肿瘤血管的时候通过射频照射诱导它们发生相转移,使其尺寸扩张进而破坏肿瘤血管,最终导致肿瘤缺血性坏死和萎缩[6-7]。
研究发现,处于肿瘤微环境中与肿瘤有关的免疫细胞(如吞噬细胞、T细胞亚群等)不仅不发挥免疫作用,反而会通过微环境中的各种免疫抑制因子、细胞因子产生免疫耐受并促进肿瘤细胞的发展,因此须调节并激活免疫反应使免疫系统对肿瘤细胞产生免疫作用。Chen等[8]发现 Gd@C82(OH)22可以通 过 TLRs/MyD88/NF-κB(TLRs:Toll样 受 体,MyD88:髓样分化因子)途径和NLRP3炎性小体的激活,来刺激巨噬细胞分泌IL-1β免疫因子。Tang等[9]研究了 C60(OH)22和 Gd@C82(OH)22对巨噬细胞的调控能力,发现两者能活化体内巨噬细胞,增强其线粒体代谢和吞噬作用,并促进其释放由NF-κB介导的多种细胞因子,从而克服免疫耐受,成功抑制肺肿瘤细胞的生长和转移,且Gd@C82(OH)22对肿瘤细胞的抑制作用要优于C60(OH)22。
2 应用于药物载体
C60作为药物载体的优点:①有30个双键,可根据需要接上多种基团进行功能化修饰;②其独特的碳笼结构使得其能够轻易被制成微球、微囊、纳米粒、脂质体(即囊泡)等;③其具有光敏活性,在体内给药的同时还可以进行光动力治疗。这些优点使其能成为优良药物载体实现对药物在体内的靶向定位及缓控释释放。通常来说,C60及其衍生物负载药物的方法按照与药物的结合方式主要分为物理结合法和化学结合法,并且其负载药物后不仅可以通过纳米化实现被动分布发挥靶向作用,更可以通过物理化学靶向或主动靶向方式等实现药物对体内病变部位的靶向治疗。
2.1 被动靶向
被动靶向是利用纳米药物的高通透性和滞留效应(EPR效应)实现在实体瘤中的靶向分布从而达到治疗肿瘤的目的。Lin等[10]用中空纳米囊与双亲官能化富勒烯衍生物(C60R5Cl,R=4-氨基丁酸/谷氨酸或苯丙氨酸的甲酯)进行双层壳合成及自组装,制备成尺寸为80~135 nm的囊泡,然后将氟尿嘧啶、环磷酰胺和顺铂等抗肿瘤药物通过透析法负载于该延迟释放载体(结构如图1所示),并揭示了R对囊泡载药量和释放药物速率/量的影响。Li等[11]开发了 C60-phe-PLA给药系统(phe:L-苯丙氨酸、PLA:聚乳酸),然后利用分散-溶剂扩散法将甲氨蝶呤(MTX)吸附其上并通过自组装形成微球,这种基于富勒烯的多功能药物微球具有缓释、持续释放药物的特点,实验表明该微球对于局部肿瘤治疗具有巨大潜力。Jovic'等[12]将富勒醇与阿霉素(DOX)以非共价键结合得到一种新型纳米药物递送系统(图2),在之后的实验中发现其可以增加肿瘤细胞对DOX的摄取,并以损伤DNA的方式抑制乳腺癌细胞增殖,最后又通过斑马鱼胚胎毒性试验证实了其自身的毒性得到降低。研究人员分别将C60以直接羧化、连接甘氨酸的方式得到含有游离羧基的中间体,然后酰化并通过酯键与多西他赛(DTX)缀合[13-14],而 Thotakura等[15]将天冬氨酸连接在富勒醇上,并由酯化反应连接DTX,最后均得到负载DTX的C60衍生物纳米给药系统(3种物质结构式如图3所示),实验发现它们均具有优异的药物释放效果及治疗效果。

Figure 1 Vesicle structure of C60 R5 Cl[10]

Figure 2 Polar interaction between fullerol and doxorubicin(DOX)

Figure 3 Chemical structure of three kinds of C60-DTX(docetaxel)
2.2 物理化学靶向
物理化学靶向是应用某些物理化学方法使靶向制剂在特定部位靶向分布的方法,这类靶向制剂如磁性靶向制剂、热敏靶向制剂及pH敏感型靶向制剂等。
磁性靶向制剂是一种以体外磁场为导向实现自身在体内靶向分布的制剂。Wang等[16]制备出了 C60@CTAF/DNA/HA-SS-COOH双响应磁性靶向给药系统(如图4所示,CTAF:一种磁性表面活性剂,HA-SS-COOH结构如图5所示),并通过静电作用将DOX负载于DNA上。

Figure 4 Schematic illustration of C60@CTAF/DNA/HA-SS-COOH and its dosing[16]

Figure 5 Chemical structure of HA-SS-COOH
该系统能够在外界磁场作用下“走动”并到达肿瘤部位,而肿瘤中的谷胱甘肽(GSH)能切断HASS-COOH上的二硫键,最终导致负载的DOX快速释放。Shi等[17]首先合成出C60-IONP-PEG复合物(IONP:氧化铁纳米颗粒,PEG:聚乙二醇),又通过吸附法将血卟啉单甲醚(HMME)负载其上,得到了C60-IONP-PEG/HMME药物递送系统(图6),其在肿瘤治疗中具有良好的磁靶向性。
热敏靶向制剂与pH敏感型靶向制剂分别是依靠体内某些部位或病变区的特殊温度、pH实现靶向定位的一类制剂。Shi等[18]将DOX通过对pH敏感的腙键与富勒烯聚乙烯亚胺衍生物(C60-PEI)相连接形成C60-PEI-DOX给药系统,该系统中与DOX连接的腙键能发挥靶向作用,腙键对酸性条件比较敏感,能于肿瘤的酸性环境下发生断裂并释放所负载的DOX,进而达到靶向治疗肿瘤的目的。由于肿瘤细胞对高热敏感且散热性差的原因使高温对肿瘤具有靶向功效,射频热疗能促进富勒烯衍生物载药体系更多地渗透进入肿瘤细胞[19]。Shi等[20]之后又研发了一种C60@Au-PEG/DOX热敏靶向药物输送系统(图7),运用射频消融技术能使其发挥靶向作用并很好地释放包埋其上的DOX。Du等[21]开发了一种以射频消融技术触发药物释放的C60-Fe3O4-PEG2000/DTX纳米脂质体给药系统,该多功能脂质体具有温度敏感性,对磁场响应性强,能通过热、磁的双重响应靶向作用于肿瘤细胞。

Figure6 Schematic illustration of C60-IONP-PEG/HMME[17]
2.3 主动靶向
主动靶向是一种依靠肿瘤细胞表面特异表达、过量表达的受体或转导过程中关键的酶实现体内药物靶向分布的方法。由于叶酸受体在许多恶性肿瘤细胞中显著高表达,具有组织特异性,故叶酸(FA)能与肿瘤细胞上的叶酸受体特异性结合进而发挥靶向作用。Shi等[22-23]首先合成出 C60-PEIFA复合物,然后通过物理方法负载DTX,得到了C60-PEI-FA/DTX给药系统(如图8所示),实验发现该系统对肿瘤具有良好的治疗效果。之后又开发了一种具有精确控制释放能力的“随动”型C60-DOX-NGR纳米药物输送系统(图9),其中的DOX与富勒烯衍生物通过酰胺键连接,靶向分子NGR肽是一种能与肿瘤新生血管中αv整联蛋白特异性结合的模体,有较强肿瘤靶向能力,能引导整个给药系统到达肿瘤部位。通过532 nm激光“打开”该系统会使C60产生大量活性氧(ROS)分子从而导致ROS敏感型连接体(硫代缩酮)断裂,所负载的DOX则被突然释放作用于肿瘤细胞。青蒿琥酯(AS)是一种抗疟疾药物,对肿瘤细胞也具有铁依赖性细胞毒作用,Zhang等[24]将透明质酸(HA)与靶向分子转铁蛋白(Tf)接枝到富勒烯上,然后将AS吸附其上,得到具有肿瘤靶向功效的HA-C60-Tf/AS多功能药物传递系统。由于大多数肿瘤细胞会在细胞表面高度表达转铁蛋白受体(TfR)从而摄取大量Fe3+完成增殖,而TfR具有靶向结合Fe3+的特异性,故该给药系统可利用这种靶向关系作用于高吸铁量的肿瘤细胞。

Figure 7 Schematic illustration of C60@Au-PEG/DOX[20]

Figure 8 Schematic illustration of C60-PEI-FA/DTX[22]
3 应用于光动力疗法
光动力疗法(PDT)是一种光敏剂(PS)在光照下产生ROS如单线态氧、羟基自由基、超氧阴离子或者其他因子从而杀死细胞和微生物进行疾病治疗的新疗法,该疗法可以用来治疗肿瘤和包括牛皮癣、特应性皮炎、脂溢性皮炎等在内的皮肤性疾病。通常,光动力疗法机制包括:①Ⅰ型反应,光敏剂分子吸光后由基态跃迁至短寿命的单重激发态,而后窜到长寿命的三重激发态并与底物发生抽氢反应或电子转移反应,生成氧自由基或自由基离子;②Ⅱ型反应,处于三重激发态的光敏剂分子与氧气发生作用,生成单线态氧。

Figure9 Schematic illustration of C60-DOX-NGR[23]
富勒烯及其衍生物作为PS能显示出较独特的生物学活性,是因为:①光稳定性强,光漂白少;②其可以在可见光、紫外光甚至近红外光的激发下,通过Ⅰ型反应或Ⅱ型反应机制转换为三线态(量子产率很高,可达100%),产生ROS分子且单线态氧的产率可达100%,高于目前被用于临床的光敏剂血卟啉;③其通过多种方式的化学修饰之后可具备靶向体内病变部位的能力,从而避免对体内正常组织的破坏,最大限度减少避光时对身体正常部位的损害。富勒烯及其衍生物产生的ROS分子不仅能攻击肿瘤细胞的蛋白质、类脂和核酸等生物大分子,对肿瘤细胞产生较强直接杀伤作用,还能对细菌产生较强灭活作用,因此具有较高的研究价值。
3.1 光动力抗肿瘤
新近研究中,Herreros-López等[25]将两种氨基富勒烯衍生物(C60-LC-NH2和C60-SC-NH2)共价接枝到氧化纳米晶纤维素(NCC-COOH)上形成NCCLC-C60和NCC-SC-C60的胶体悬浮液,又将异硫氰酸荧光素(FITC)和 C60-LC-NH2共价连接在 NCCCOOH表面上形成NCC-LC-C60-FITC,得到这3种新的NCC-C60杂合体(如图10)。进行体外实验发现这些NCC-C60杂合体均具有光敏特性,在光照作用下可产生ROS分子,对人乳腺癌细胞具有良好的抑制作用。
白血病是一类造血干细胞恶性克隆性疾病,运用化疗药物治疗过程中会使白血病细胞产生多药耐药性,因此逆转白血病细胞的多药耐药性并提高其敏感性是提高化疗疗效的重要手段。Franskevych等[26]制得了 C60-RITC(RITC:罗丹明 B异硫氰酸酯)共价缀合物,研究发现这种物质在光动力下产生的ROS分子不仅会对白血病细胞发挥光毒性作用,还会通过诱导线粒体凋亡的途径逆转白血病细胞对顺铂的耐药性。Shi等[27]研究出了一种C60-IONP-PEG-FA复合物,其能够在磁-叶酸受体双重靶向作用下到达肿瘤部位,从而可以用于光动力治疗肿瘤及肿瘤成像等,实验表明其对肿瘤细胞具有较强的杀伤作用。

Figure 10 Synthesis of NCC-C60[25]
由于富勒烯作为PS对近红外区域的光谱吸收差,因而受到很大限制。随着研究不断深入,富勒烯与传统PS形成的复合物不断涌现,这类富勒烯衍生物对近红外区域(NIR)的光谱吸收能力较强。Li等[28]合成了新型 GO-C60杂化物(结构如图 11,GO:石墨烯氧化物),GO具有光热活性,在近红外区域表现出强烈的吸收,能对肿瘤进行光热治疗。GO能将C60的吸收区域扩展到近红外区域,使C60实现了近红外光照射的光动力治疗。在光照后,细胞活力在GO-C60中降低最快,7 min照射下细胞活力仅为58.5%。这可归因于GO-C60可以同时产生ROS分子和热量,提供双重效果杀死肿瘤细胞。Guan等[29-30]报道了一种 UCNP-PEG-FA/PC70纳米复合物(UCNP:上转换纳米粒子,PC70:三甲基吡啶基卟啉-富勒烯C70),它能克服PDT中光照穿透深度不足和微环境缺氧的情况,且能在FA主动靶向作用下积累在肿瘤部位。之后又报道了一种能用于肿瘤成像和PDT的TFC70-OEG2-Ce6纳米囊泡(TFC70:三丙二酸富勒烯 C70,OEG2:1,10-二氨基-4,7-二氧杂癸烷,Ce6:二氢卟吩 e6),其具有以下优势:①Ce6的高负载率(质量分数高达57%);②在NIR内能有效吸收;③提高体外及体内的细胞摄取率;④增强肿瘤成像和PDT效率;⑤良好的生物相容性和全身清除率。

Figure 11 Chemical structure of GO-C60
3.2 光动力抗微生物
在传统的基于革兰阴性菌的靶向方法中:由于细菌外层膜上的脂多糖带有的高密度负电荷会产生阴离子屏蔽现象,导致光动力灭菌效率降低,使革兰阴性菌对光动力灭活产生抗性;在没有给电子基的条件下,普通的富勒烯衍生物类光敏剂(FPS)仅能于Ⅱ型反应中得到单线态氧作为主要ROS分子,因而其杀伤能力有限。Yin等[31]开发了3种新型C60衍生物和(分别简写为LC14、LC15和LC16,结构如图12所示)。这3种C60衍生物可以实现:①因具有大量季铵阳离子,会靶向定位于革兰阴性菌,并在光诱导下产生ROS杀伤革兰阴性菌,使光动力灭活革兰阴性菌变得更有效;②在紫外线(UVA,波长320~420 nm)或白光波长照射下,既能产生Ⅱ型单线态氧,也能产生Ⅰ型羟基自由基,作用于多种耐药细菌如耐药革兰阳性菌,增强杀伤能力与范围。Yin等[32]还研究了以上3种FPS在通过UVA或白光激发后产生活性氧的相对能力,并使用耐甲氧西林金黄色葡萄球菌,大肠埃希菌和白色念珠菌进行抑菌作用测试,发现含有近红外“光吸收天线”的LC15是最强大的广谱抗菌FPS,其次是LC16,LC14最弱,并发现该过程中,Ⅰ型电子转移机制得到强化,提高了光动力下上述FPS杀死微生物的能力;于无氧条件下添加叠氮阴离子会大大增强抑菌效果。
Grinholc等[33]发现单-N-甲基吡咯烷鎓富勒烯碘化物(如图13所示)在光照射下对大肠埃希菌、绿脓杆菌、金黄色葡萄球菌和白色念珠菌具有杀伤作用。体外研究发现,该C60衍生物于黑暗条件下不会对大肠埃希菌和白色念珠菌产生毒性抑制作用,在光照下会产生活性氧破坏细菌细胞膜,抑制所有细菌且对葡萄球菌产生高度抑制性。Ballatore等[34]通过在氧化铟电极上电解得到咔唑基取代的TCP-C60复合膜(TCP:卟啉,结构如图 14),实验发现这种复合膜能在光动力下对金黄色葡萄球菌和大肠埃希菌产生较强灭杀作用,而且它不仅能对水介质消毒,还适用于在医疗条件下控制微生物繁殖,进行无菌操作。
4 抗氧化应激
氧化应激是指体内氧化与抗氧化作用失衡,从而产生大量氧化产物如ROS和活性氮(RNS)。化疗药物、外界辐射及机体内部生理代谢均会导致氧化应激,促使这些氧化产物在体内生成并对人体细胞造成损伤,这被认为是导致疾病和衰老的一个重要因素。富勒烯不但具有在光动力下产生ROS分子使细胞损伤或凋亡的能力,还拥有猝灭ROS分子、清除自由基、抗氧化应激从而发挥细胞保护作用的能力,这是因为富勒烯拥有大量碳碳双键和LUMO轨道,可以很好地吸收电子并与自由基反应,然后除去它们。科学研究表明,富勒烯具有非常强的抗氧化能力,是维生素C的125倍,被称为“自由基海绵”。基于此,不但可以将富勒烯制备成具有光动力抗肿瘤作用和抗菌作用的富勒烯衍生物,也可以开发成具有细胞保护作用的富勒烯衍生物。根据其抗氧化应激应用富勒烯衍生物的作用如下:①对化疗、外源性辐射的防护作用;②对内源性生理代谢的保护作用。

Figure 12 Chemical structures of LC14,LC15 and LC16
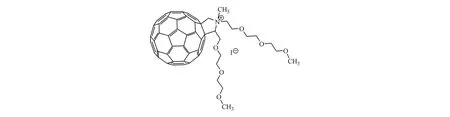
Figure 13 Chemical structure of N-methylpyrrolidinium fullerene iodide salts
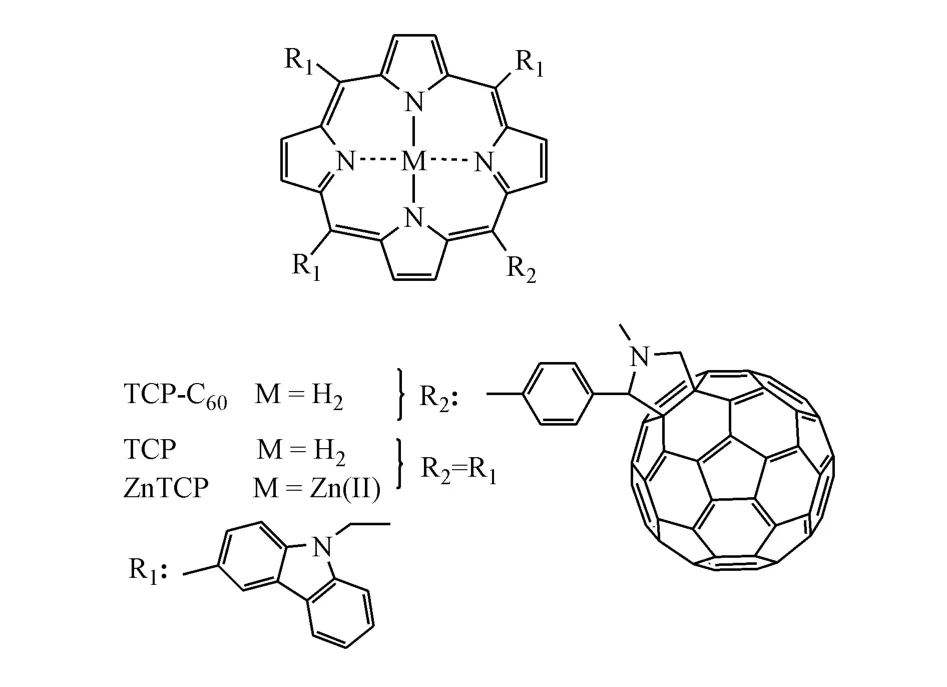
Figure 14 Chemical structure of TCP-C60
4.1 对化疗、外源性辐射的防护作用
在化疗过程中,由于药物的毒性机体会产生有害的ROS,因此,需要进行化疗防护。Zhou等[35]通过固液法制备了两种新型的C60-OH与C70-OH,并对其抗氧化活性进行了研究,发现体外或体内状态下C70-OH在抗DOX诱导的肝脏毒性中均表现出优于C60-OH的清除ROS活性,故C70-OH在化疗防护中的自由基清除能力要优于C60-OH。
电离辐射的种类很多,如α、β、γ射线和各类X射线,机体受到电离辐射后会产生自由基对机体造成伤害。Krokosz等[36]研究了在氧气和 C60(OH)~30纳米颗粒的存在下,X射线辐射对醇脱氢酶(ADH)活性的影响,发现与不含富勒醇的ADH相比,含有75 mg/mL富勒醇的ADH在辐射下灭活产率降低20%。在辐射条件下,50%的羟基自由基与富勒醇反应,另外50%与ADH反应,由此可认为富勒醇对ADH的辐射保护作用主要是由富勒醇的清除作用产生。
非电离辐射包括紫外线、光线、红内线等辐射,如紫外辐射会对人体皮肤造成伤害,可发生皮肤老化、光照性皮炎甚至皮肤癌。Awan等[37]首次将C60(OH)30共轭到纤维素纳米晶体(CNC)表面,并利用2,2-二苯基-1-苦肼基(DPPH,一种评价物质抗氧化能力的试剂)检验了该纳米杂合物的抗氧化性能,发现其具有良好的抗氧化性能,可以很好地清除自由基,在抵御紫外线、保护人体皮肤方面作用良好。
4.2 对内源性生理代谢的保护作用
富勒烯及其衍生物能够在诸如神经变性疾病(如帕金森病,阿尔茨海默病和肌营养不良性侧索硬化症)、过敏性脑脊髓炎、动脉粥样硬化、关节炎和骨质疏松等许多由氧化应激而导致的疾病方面起重要作用[38-39]。新近研究中,Huang等[40]合成了一种新的水溶性还原型谷胱甘肽富勒烯衍生物(C60-GSH,结构如图15),并研究了其对H2O2诱导HEK 293T细胞产生氧化应激及凋亡的保护作用。C60-GSH会通过HEK 293T细胞中由H2O2激活的Bcl-2/Bax-caspase-3信号通路抑制细胞内钙调动和细胞凋亡,最终达到清除H2O2,提高细胞活力,保持细胞内钙稳态从而保护细胞的目的。由于肌肉疲劳期间内源性抗氧化系统会被激活,使还原型谷胱甘肽和过氧化氢酶的活性增加而导致TBARS指标(一种用来评估脂质氧化程度的指标)和H2O2含量下降。Prylutskyy等[41]发现 C60胶体水溶液(C60FAS)能通过清除自由基作用同样使这两者降低,并缩短肌肉收缩恢复时间,增加肌肉耐力,最终减弱由活性氧造成的骨骼肌肉疲劳。

Figure 15 Chemical structure of C60-GSH
衰老在很大程度上与体内多余的自由基有关联,而富勒烯及其衍生物不仅能对紫外线下的皮肤起到抗衰老作用,也能够对生物体内部生理性衰老现象起到抑制作用。研究表明,ROS分子生成和对氧化应激的应答(包括应激反应基因的表达)都是确定生物体寿命的关键因素。Baati等[42]对经四氯化碳中毒的实验小鼠连续7个月喂食溶解有富勒烯的橄榄油,结果发现,小鼠不仅没有出现明显的中毒等不良反应,而且其平均寿命从2年延长到了5年。DAF-16基因是调节长寿的主要转录因子,Cong等[43]发现在氧化胁迫条件下富勒醇通过抗氧化应激作用,不仅可以清除体内活性氧,还能以调控DAF-16的方式增加胁迫相关基因mRNA的表达、上调胞外过氧化物歧化酶编码基因(SOD-3)和热休克蛋白基因(HSP-16.2)的表达,从而延长秀丽隐杆线虫的寿命。
5 展 望
富勒烯及其衍生物的发展已经日趋成熟,但尚有一些问题亟待解决,如毒性问题,虽然通过化学修饰之后能减弱部分毒性,但却不能得到令人满意的结果,所以其用于体内给药还存在一定的风险及隐患。目前学术界对富勒烯及其衍生物的毒性来源、毒性强弱的看法存在很大争议,相信随着技术的发展与改进终会解决这个问题。本文详述了富勒烯及其衍生物在抗肿瘤方面的应用,实际上,富勒烯及其衍生物还可以用于提高微波热疗对肿瘤的靶向性并减少其对周围组织细胞的损伤[44]。由此可见,随着人类的不断研究与发现,富勒烯及其衍生物将会在更多的抗肿瘤方法中扮演重要的角色。除此之外,富勒烯及其衍生物在细胞保护、抗衰老、抗微生物、DNA切割、酶抑制、基因载体、核医学成像、皮肤保健及头发滋生等方面也得到更广泛而重要的应用,相信不久将来富勒烯及其衍生物在人类的重大及顽固性疾病的诊断、治疗、预防等方面发挥更大重要作用。
[1] Kroto HW,Weath JR,Curl RF,et al.C60:Buckminster fullerene[J].Nature,1985,318(6042):162-163.
[2] Du GJ,Shi XY.New approaches to cancer treatment:targeting the tumormicroenvironment[J].J Int Pharm Res(国际药学研究杂志),2011,38(5):336-340.
[3] Nie X,Tang JL,Liu Y,et al.Fullerenol inhibits the cross-talk between bonemarrow-derived mesenchymal stem cells and tumor cells by regulating MAPK signaling[J].Nanomedicine,2017,13(6):1879-1890.
[4] Meng H,Xing GM,Blanco E,et al.Gadolinium metallofullerenol nanoparticles inhibit cancermetastasis throughmatrixmetalloproteinase inhibition:imprisoning instead of poisoning cancer cells[J].Nanomedicine,2012,8(2):136-146.
[5] Sun CD,Wang LM,Gao D,et al.C60(OH)22:a potential histone deacetylase inhibitorwith anti-angiogenic activity[J].Nanoscale,2016,8(36):16332-16339.
[6] Zhen MM,Shu CY,Li J,et al.A highly efficient and tumor vascular-targeting therapeutic technique with size-expansible gadofullerene nanocrystals[J].Sci China Mater(中国科学:材料科学),2015,58(10):799-810.
[7] Zhou Y,Deng RJ,Zhen MM,et al.Amino acid functionalized gadofullerene nanoparticles with superior antitumor activity via destruction of tumor vasculature in vivo[J].Biomaterials,2017,133:107-118.
[8] Chen ZY,Liu Y,Sun BY,et al.Polyhydroxylated metallofullerenols stimulate IL-1β secretion of macrophage through TLRs/MyD88/NF-κB pathway and NLRP3inflammasome activation[J].Small,2014,10(12):2362-2372.
[9] Tang JL,Chen ZY,Sun BY,et al.Polyhydroxylated fullerenols regulate macrophage for cancer adoptive immunotherapy and greatly inhibit the tumor metastasis[J].Nanomedicine,2016,12(4):945-954.
[10]Lin MS,Chen RT,Yu NY,etal.Fullerene-based amino acid ester chlorides self-assembled as spherical nano-vesicles for drug delayed release[J].Colloids Surf B,2017,159:613-619.
[11]Li Z,Zhang FL,Pan LL,et al.Preparation and characterization of injectablemitoxantrone poly(lactic acid)/fullerene implants for in vivo chemo-photodynamic therapy[J].J Photochem Photobiol B,2015,149:51-57.
[12]Jovi'c DS,Seke MN,Djordjevic AN,et al.Fullerenol nanoparticles as a new delivery system for doxorubicin[J].RSC Advances,2016,6(45):38563-38578.
[13]Raza K,Thotakura N,Kumar P,et al.C60-fullerenes for delivery of docetaxel to breast cancer cells:a promising approach for enhanced efficacy and better pharmacokinetic profile[J].Int J Pharm,2015,495(1):551-559.
[14]Misra C,Thotakura N,Kumar R,et al.Improved cellular uptake,enhanced efficacy and promising pharmacokinetic profile of docetaxel employing glycine-tethered C60-fullerenes[J].Mater Sci Eng C,2017,76:501-508.
[15]Thotakura N,Sharma G,Singh B,et al.Aspartic acid derivatized hydroxylated fullerenes as drug delivery vehicles for docetaxel:an explorative study[J].Artif Cells Nanomed Biotechnol,2017:1-10.doi:10.1080/21691401.2017.1392314.
[16]Wang L,Wang YT,Hao JC,et al.Magnetic fullerene-DNA/hyaluronic acid nanovehicles with magnetism/reduction dual-responsive triggered release[J].Biomacromolecules,2017,18(3):1029-1038.
[17]Shi JJ,Yu XY,Wang L,et al.PEGylated fullerene/iron oxide nanocomposites for photodynamic therapy,targeted drug delivery and MR imaging[J].Biomaterials,2013,34(37):9666-9677.
[18]Shi JJ,Liu Y,Wang L,etal.A tumoralacidic pH-responsive drug delivery system based on a novel photosensitizer(fullerene)for in vitro and in vivo chemo-photodynamic therapy[J].Acta Biomaterialia,2014,10(3):1280-1291.
[19]Lapin NA,Krzykawska-Serda M,Dilliard S,et al.The effects of non-invasive radiofrequency electric field hyperthermia on biotransport and biodistribution of fluorescent[60]fullerene derivative in amurine orthotopicmodel of breastadenocarcinoma[J].JControlled Release,2017,260:92-99.
[20]Shi JJ,Chen ZY,Wang L,et al.A tumor-specific cleavable nanosystem of PEG-modified C60@Au hybrid aggregates for radio frequency-controlled release,hyperthermia,photodynamic therapy and X-ray imaging[J].Acta Biomaterialia,2015,29:282-297.
[21]Du B,Han SP,Li HY,et al.Multi-functional liposomes showing radiofrequency-triggered release and magnetic resonance imaging for tumor multi-mechanism therapy[J].Nanoscale,2015,7(12):5411-5426.
[22]Shi JJ,Zhang HL,Wang L,et al.PEI-derivatized fullerene drug delivery using folate as a homing device targeting to tumor[J].Biomaterials,2013,34(1):251-261.
[23]Shi JJ,Wang BH,Wang L,et al.Fullerene(C60)-based tumortargeting nanoparticles with“off-on”state for enhanced treatment of cancer[J].JControlled Release,2016,235:245-258.
[24]Zhang HJ,Hou L,Jiao XJ,et al.Transferrin-mediated fullerenes nanoparticles as Fe2+-dependent drug vehicles for synergistic anti-tumor efficacy[J].Biomaterials,2015,37:353-366.
[25]Herreros-López A,CariniM,Ros TD,et al.Nanocrystalline cellulose-fullerene:novel conjugates[J].Carbohydr Polym,2017,164:92-101.
[26] Franskevych D,Palyvoda K,Petukhov D,et al.Fullerene C60penetration into leukemic cells and its photoinduced cytotoxic effects[J].Nanoscale Res Lett,2017,12(1):40.
[27]Shi JJ,Wang L,Gao J,et al.A fullerene-based multi-functional nanoplatform for cancer theranostic applications[J].Biomaterials,2014,35(22):5771-5784.
[28]Li Q,Hong L,Li HG,et al.Graphene oxide-fullerene C60(GOC60)hybrid for photodynamic and photothermal therapy triggered by near-infrared light[J].Biosens Bioelectron,2017,89(Pt 1):477-482.
[29]Guan MR,Ge JC,Li SM,etal.Multifunctional upconversion-nanoparticles-trismethylpyridylporphyrin-fullerene nanocomposite:a near-infrared light-triggered theranostic platform for imagingguided photodynamic therapy[J].NPG Asia Mater,2015,7(7):e205.
[30] Guan MR,Ge JC,Wu JY,et al.Fullerene/photosensitizer nanovesicles as highly efficient and clearable phototheranostics with enhanced tumor accumulation for cancer therapy[J].Biomaterials,2016,103:75-85.
[31]Yin R,Wang M,Huang YY,et al.Antimicrobial photodynamic inactivation with decacationic functionalized fullerenes:oxygenindependent photokilling in presence of azide and new mechanistic insights[J].Free Radical Biol Med,2015,79:14-27.
[32]Zhang YS,Dai TH,Wang M,et al.Potentiation of antimicrobial photodynamic inactivation mediated by a cationic fullerene by added iodide:in vitro and in vivo studies[J].Nanomedicine(Lond),2015,10(4):603-614.
[33]Grinholc M,Nakonieczna J,Fila G,et al.Antimicrobial photodynamic therapy with fulleropyrrolidine:photoinactivation mechanism of staphylococcus aureus,in vitro and in vivo studies[J].Appl Microbiol Biotechnol,2015,99(9):4031-4043.
[34]Ballatore MB,Durantini J,Gsponer NS,et al.Photodynamic inactivation of bacteria using novel electrogenerated porphyrinfullerene C60polymeric films[J].Environ Sci Technol,2015,49(12):7456-7463.
[35]Zhou Y,Li J,Ma HJ,et al.Biocompatible[60]/[70]fullerenols:potent defense against oxidative injury induced by reduplicative chemotherapy[J].ACS Appl Mater Interfaces,2017,9(41):35539-35547.
[36]Krokosz A,Grebowski J,Rodacka A,etal.The effectof fullerenol C60(OH) ~30on the alcohol dehydrogenase activity irradiated with X-rays[J].Radiat Phys Chem,2014,97:102-106.
[37]Awan F,Bulger E,Berry RM,et al.Enhanced radical scavenging activity of polyhydroxylated C60functionalized cellulose nanocrystals[J].Cellulose,2016,23(6):3589-3599.
[38]Goodarzi S,Ros TD,Conde J,et al.Fullerene:biomedical engineers get to revisitan old friend[J].Mater Today,2017,20(8):460-480.
[39]Dellinger A,Zhou ZG,Connor J,etal.Application of fullerenes in nanomedicine:an update[J].Nanomedicine,2013,8(7):1191-1208.
[40]Huang J,Zhou C,He J,et al.Protective effect of reduced glutathione C60derivative againsthydrogen peroxide-induced apoptosis in HEK 293T cells[J].JHuazhong Univ Sci Technol(华中科技大学学报),2016,36(3):356-363.
[41] Prylutskyy YI,Vereshchaka IV,Maznychenko AV,et al.C60fullerene as promising therapeutic agent for correcting and preventing skeletalmuscle fatigue[J].J Nanobiotechnol,2017,15(1):8.
[42]Baati T,Bourasset F,Gharbi N,et al.The prolongation of the lifespan of rats by repeated oral administration of[60]fullerene[J].Biomaterials,2012,33(19):4936-4946.
[43]Cong WS,Wang P,Qu Y,et al.Evaluation of the influence of fullerenol on aging and stress resistance using caenorhabditis elegans[J].Biomaterials,2015,42:78-86.
[44]Sun MR,Kiourti A,Wang H,et al.Enhanced microwave hyperthermia of cancer cells with fullerene[J].Mol Pharmaceutics,2016,13(7):2184-2192.

