小分子激酶抑制剂在肝纤维化治疗中的应用
赵莉梦,王淑珍
(中国药科大学生命科学与技术学院,南京210009)
肝纤维化是一种由多种病因引起的慢性肝损伤,病因包括病毒感染、药物、胆汁郁积、代谢紊乱或自身免疫等[1]。在慢性肝损伤过程中,细胞外基质(extracellularmatrix,ECM)成分的合成和降解之间的动态平衡遭到破坏,胶原等物质在肝脏内过度沉积,造成正常的肝脏结构被纤维组织、疤痕和再生结节所替代,导致肝功能丧失[1]。如果不予以及时治疗,肝纤维化可能会进一步发展成为肝硬化甚至肝癌。虽然肝纤维化是一个可逆的病理过程,但当其发展为肝硬化后,目前除了肝移植尚无其他根本治疗方法,因此肝纤维化的防治显得尤为重要[2]。然而,现有肝纤维化治疗药物多存在不良反应以及缺少肝脏特异性等特点导致疗效不尽人意,因此,迫切需要能够有效逆转或抑制肝纤维化进程的药物。
激酶能够通过催化底物发生磷酸化,改变其活性或与其他物质的相互作用,从而广泛参与信号传导并调节多种生理过程[3]。激酶活性异常或过度表达与各种疾病相关,如肿瘤、心血管疾病和代谢性疾病等。研究表明,激酶也可参与调控多个肝纤维化关键进程,比如肝星状细胞(hepatic stellate cell,HSC)的增殖、活化、转化为肌纤维母细胞等[4]。肝星状细胞活化后,细胞表面的激酶与相应配体结合后会发生磷酸化,激活下游信号通路,进而调节肝星状细胞的生物学功能,包括细胞增殖、凋亡和胶原代谢等。此外,激酶还可通过调控血管生成改变肝脏的血管结构造成肝脏微血管异常,从而促进门静脉高压的发生,并最终导致肝功能衰竭甚至死亡[5]。因此,抑制激酶活性可能是治疗肝纤维化的一种新型有效策略。
目前,美国FDA已批准了35种小分子激酶抑制剂(small-molecule kinase inhibitors,SMKIs),大多用于肿瘤的治疗[6]。近年来,研究人员发现SMKIs能够通过靶向激酶抑制细胞增殖以及血管生成从而发挥抗肝纤维化作用,并已在肝纤维化临床前动物模型和肝纤维化患者中都观察到了显著的积极治疗效果,证明SMKIs具有治疗肝纤维化的巨大应用潜力[2]。本文主要对参与肝纤维化的酪氨酸激酶、丝/苏氨酸激酶和磷脂酰肌醇-3激酶(phosphatidylinositide 3-kinase,PI3K)以及靶向这些激酶的SMKIs在肝纤维化治疗中的最新研究进展进行综述,以期为后续肝纤维化的干预及防治提供帮助。
1 激酶在肝纤维化发生发展中的作用
按照作用底物不同,可将激酶分为蛋白激酶、脂类激酶和碳水化合物激酶等。蛋白激酶中,可催化底物蛋白的酪氨酸残基发生磷酸化的激酶称为酪氨酸激酶,而催化丝/苏氨酸残基发生磷酸化的则称为丝/苏氨酸激酶。已有大量研究报道蛋白激酶参与了肝纤维化过程[7]。另外,脂类激酶中的PI3K激酶介导的PI3K/Akt信号通路也与肝纤维化的发生发展密切相关[7]。本文涉及的相关激酶及其参与调节肝纤维化发生发展的细胞信号通路总结如图1所示。
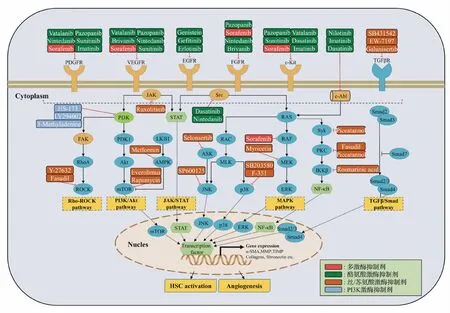
图1 参与肝纤维化的激酶及小分子激酶抑制剂
1.1 酪氨酸激酶与肝纤维化
1.1.1 受体酪氨酸激酶与肝纤维化 酪氨酸激酶按照其结构可分为受体酪氨酸激酶和非受体酪氨酸激酶两类。受体酪氨酸激酶是单次跨膜的膜受体蛋白,通常由胞外结构域、跨膜区以及胞内激酶结构域组成,其配体可通过与激酶的胞外结构域结合激活胞内信号通路。与肝纤维化相关的受体酪氨酸激酶主要包括促红细胞生成素产生肝细胞受体 (erythropoietin producing hepatocyte receptor,Eph)、血小板来源生长因子受体(platelet-derived growth factor receptor,PDGFR)和血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)等[8]。
Eph受体是受体酪氨酸激酶家族中的最大成员,可分为EphA和EphB两个亚群,功能复杂多样。最近,Mimche等[9]在疟原虫诱导的肝纤维化动物模型中发现,肝脏激活的Kupffer细胞和巨噬细胞(Mφ)表面EphB2表达上调,从而促进单核细胞浸润,释放细胞因子和趋化因子刺激肝星状细胞增殖、迁移和活化。EphB2敲除小鼠与对照组相比,四氯化碳(carbon tetrachloride,CCl4)诱导的肝纤维化明显减弱,首次证明Eph受体酪氨酸激酶与肝纤维化相关[9]。PDGFR主要表达于血管内皮细胞、成纤维细胞和Kupffer细胞表面,是最能有效促进肝星状细胞分裂和增殖的受体酪氨酸激酶。PDGFR分为α和β两个亚型,与配体血小板来源生长因子(platelet-derived growth factor,PDGF)结合后,两个受体分子会形成同源或异源二聚体,发生自身磷酸化后将信号传入细胞内,促进肝星状细胞增殖、Ⅰ型胶原形成以及上调基质金属蛋白酶抑制剂-1(metallopeptidase inhibitor-1,TIMP-1),导致不同组织发生纤维化[7]。VEGFR及其配体血管内皮生长因子(vascular endothelial growth factor,VEGF)表达增加会促进肝脏内皮细胞的生长和增殖、局部毛细血管的生成,这些额外生成的血管和窦周的毛细血管化会阻碍肝细胞间正常的血液运输,使得肝小叶结构发生改变,进而诱发肝纤维化[10]。此外,表皮生长因子受体 (endothelial growth factor receptor,EGFR)和成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)等其他受体酪氨酸激酶也可通过调节肝星状细胞的活性及肝内血管生成等直接或间接机制参与肝纤维化的发生和发展[11]。
1.1.2 非受体酪氨酸激酶与肝纤维化 与受体酪氨酸激酶不同,非受体酪氨酸激酶缺乏胞外结构域和跨膜结构域,仅含有催化结构域和调控结构域,与配体结合后,在细胞质中被激活,进而调节下游信号转导通路[8]。非受体酪氨酸激酶主要包括c-Abl、Src和JAK等。c-Abl激酶活性的异常持续激活是造成慢性粒细胞白血病的直接元凶,已成为治疗该病的公认靶标。近期研究表明c-Abl也可以作为转化生长因子 β(TGF-beta receptor,TGF-β)促纤维化信号的下游靶点之一,参与形成肝纤维化[10]。Src激酶可被促纤维化相关疾病中存在的活性氧或促纤维化细胞因子(如TGF-β和PDGF)激活,通过磷酸化激活TGF-βⅡ型受体及下游的Abl激酶调节TGF-β信号活性,从而在促纤维化信号传导通路中发挥重要作用[10]。
1.2 丝/苏氨酸激酶与肝纤维化
丝/苏氨酸激酶可以作为受体或者胞内信号传导蛋白发挥作用,由多个家族组成。与肝纤维化相关的丝/苏氨酸激酶主要包括TGF-β受体(TGF-beta receptor,TGFβR)、丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)、蛋白激酶 C(protein kinase C,PKC)、Rho相关蛋白激酶(rhoassociated protein kinase,ROCK)和雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)等。
TGF-β1是促纤维化的最重要的细胞因子。在各种损伤因素作用下,肝脏内的TGF-β1表达量大大增加,与细胞膜表面的受体TGFβR结合后激活下游Smads蛋白,后者入核后与各种转录因子结合,调控相关基因(如胶原和 CTGF/CCN2)的表达,促进肝星状细胞激活和ECM合成[12]。TGF-β1也可以不依赖Smads蛋白,通过RhoA/cdc42直接激活下游MAPK蛋白,发挥促纤维化作用。MAPK是一类可以被多种物理化学信号(如细胞因子、生长因子、ECM、DNA损伤和药物等)激活的丝/苏氨酸激酶,在肝损伤和疾病中发挥重要作用[13]。哺乳动物中MAPK家族主要分为3大类,即细胞外信号调节激酶(extracellular signal-regulated kinases,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK)和 p38 MAPK。它们都可以作为 TGFβR的下游靶点发生活化,通过调节TGF-β/Smad信号通路发挥促纤维化作用。JNK还可以通过诱导ROS的产生诱导细胞凋亡来促进肝损伤[13]。
1.3 PI3K激酶与肝纤维化
PI3K既有丝/苏氨酸激酶的活性,又有磷脂酰肌醇激酶的活性。在肝纤维化过程中,PI3K及其下游靶标蛋白激酶B(也称 Akt)所介导的 PI3K/Akt通路受到PDGFR、ERK等多种其他激酶的调节。PDGFR激活PI3K/Akt信号通路后可促进肌动蛋白重组、增加肝星状细胞细胞迁移能力,参与代谢调节,刺激细胞生长,抑制细胞凋亡;ERK信号则与PI3K/Akt介导的肝星状细胞趋化和增殖相关[7]。使用PI3K特异性抑制剂能够阻断PDGF诱导的肝星状细胞有丝分裂和趋化性。
2 SMKIs的抗肝纤维化研究
美国FDA已批准的多个SMKIs(如Imatinib、Sorafenib和Erlotinib)在体内和体外模型中均表现出了良好的抗纤维化活性,在一些肝硬化和肝癌患者中也获得了较好的治疗效果。越来越多的证据表明,SMKIs是一类新的肝纤维化潜在治疗药物。目前已上市和未上市SMKIs在肝纤维化临床前动物模型和临床试验中的最新研究进展见表1、2,代表性化合物结构如图2~4所示。
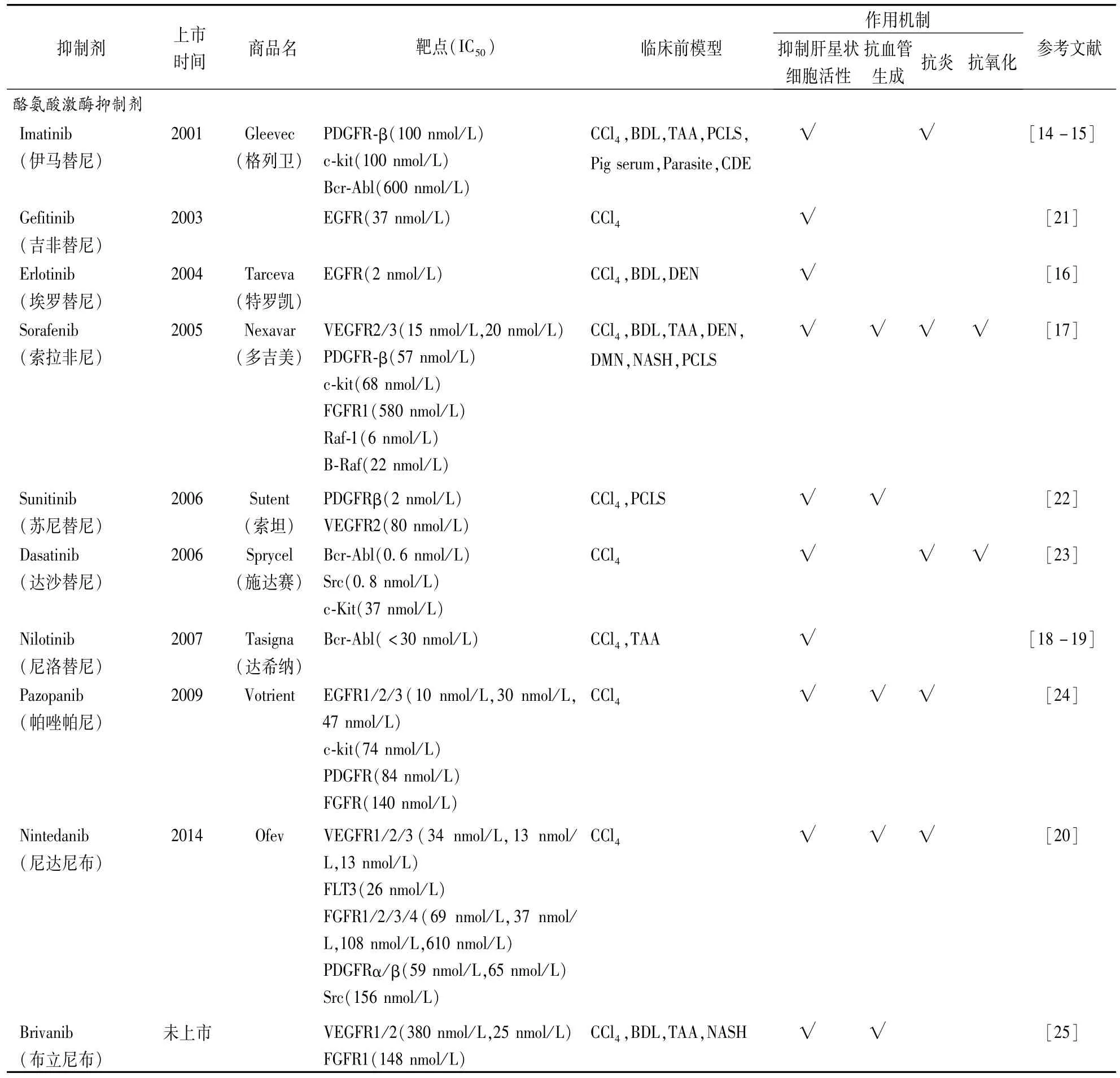
表1 小分子激酶抑制剂在临床前肝纤维化动物模型中的研究
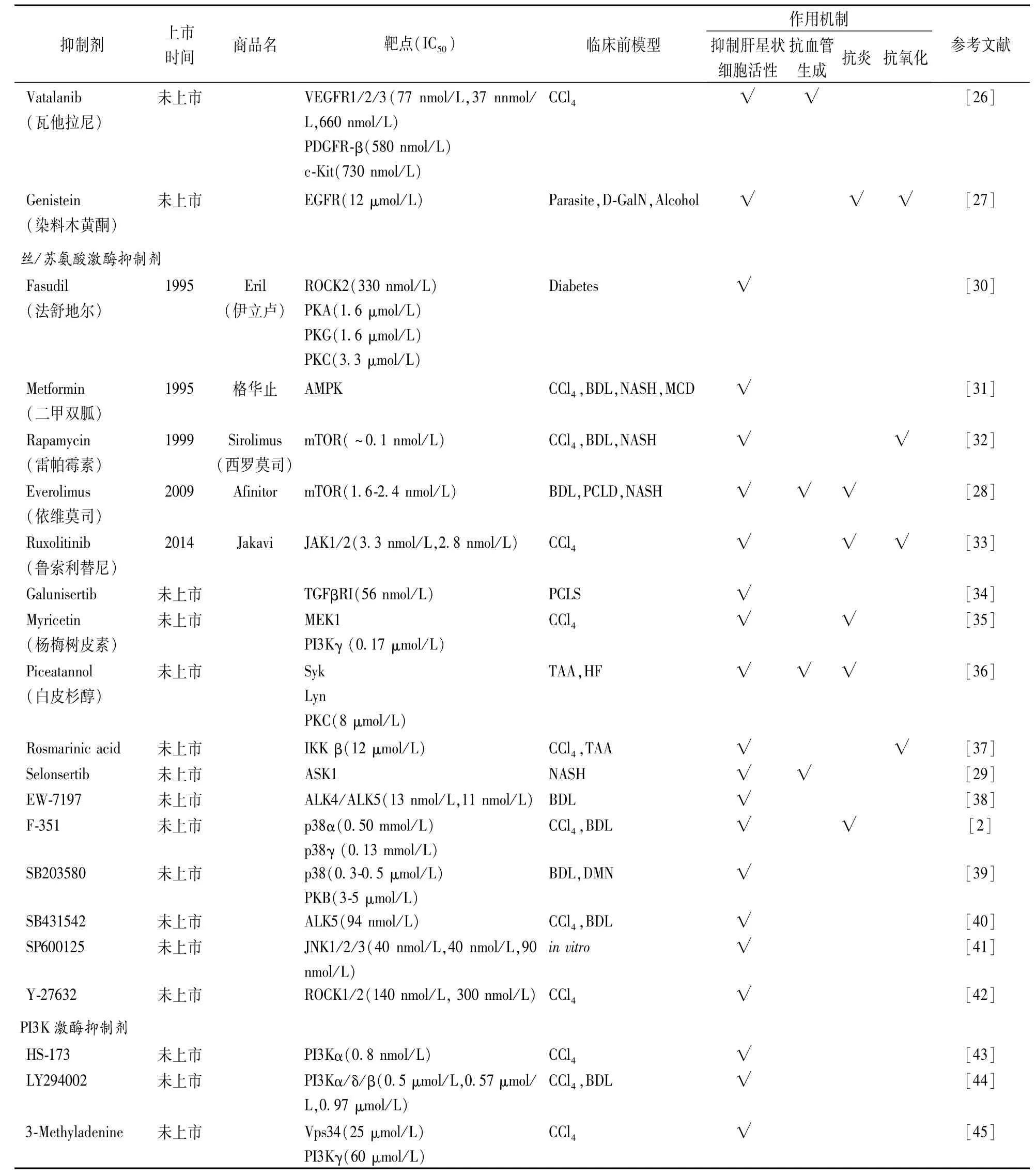
(续表)

表2 小分子激酶抑制剂治疗肝纤维化相关疾病的临床试验
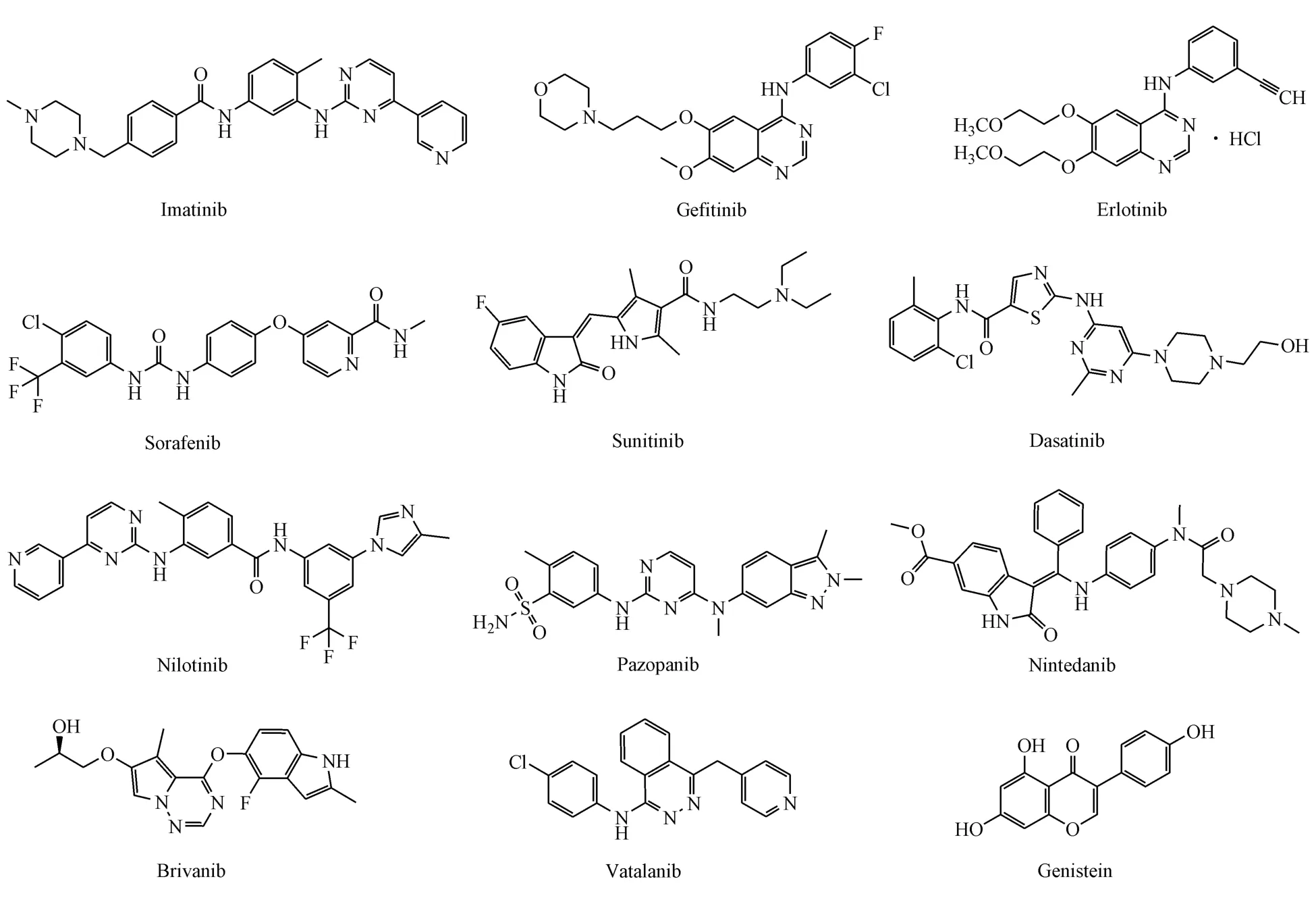
图2 酪氨酸激酶抑制剂的化学结构
2.1 酪氨酸激酶抑制剂
2.1.1 Imatinib(伊马替尼) Imatinib是一种2-苯氨基嘧啶类化合物,能够抑制PDGFR、Bcr-Abl和c-Kit等多种酪氨酸激酶活性,于2001年上市,主要用于治疗慢性粒细胞白血病和胃肠道间质瘤。Westra等[14]利用人精准肝组织切片作为体外抗肝纤维化药物筛选模型发现,Imatinib可以显著降低α-SMA、Ⅰ型胶原和HSP47等纤维化标志物的表达。在 CCl4、胆管结扎(bile duct ligation,BDL)和硫代乙酰胺(thioacetamide,TAA)等诱导的多种组织的纤维化动物模型中,imatinib也都显示了良好的抗肝纤维化作用[8]。针对系统性硬化症患者开展的一项Ⅱ期临床试验(NCT00573326)研究表明,imatinib能通过抑制免疫细胞的发育、激活、增殖和功能终止免疫反应,进而发挥抗纤维化作用[15]。
2.1.2 Erlotinib(埃罗替尼) Erlotinib是美国FDA批准的第2个EGFR抑制剂,2004年上市,主要用于非小细胞肺癌的治疗。Fuchs等[16]研究发现,等量或低于人体用量的erlotinib能够显著降低CCl4、BDL和二乙基亚硝胺(diethylnitrosamine,DEN)诱导的3种动物模型肝纤维化的发生。他们还发现,erlotinib能通过抑制EGFR磷酸化降低激活的肝星状细胞的细胞数目[16]。目前正在进行一项临床试验评估Erlotinib在抑制肝纤维化和预防肝癌中的作用(NCT02273362)。
2.1.3 Sorafenib(索拉菲尼) Sorafenib是研究最为深入的一种SMKI,2005年上市,主要用于晚期肝癌和肾癌的治疗。Sorafenib不仅可以抑制VEGFR、PDGFR和c-Kit等多种酪氨酸激酶,还可抑制Raf等丝/苏氨酸激酶,是一种多激酶抑制剂。Sorafenib的抗纤维化作用在几乎所有的临床前肝纤维化动物模型中都获得了验证[17],其抗肝纤维化作用存在多种机制,包括抑制肝星状细胞的增殖和促进肝星状细胞凋亡、调节胶原的形成和降解、调节血管重塑和血管成熟、调节炎性因子和改善线粒体功能等[8]。临床上,sorafenib能有效降低肝癌患者的门静脉压力,使门静脉血流量至少减少36%[5]。最近开展的一项安慰剂对照随机临床试验正在评估sorafenib对肝硬化患者门静脉压力的影响(NCT01714609)[4]。
2.1.4 Nilotinib(尼洛替尼) Nilotinib是一种选择性Bcr-Abl抑制剂,2007年上市,主要用于白血病的治疗。Nilotinib除具有抗肿瘤活性外,还具有神经保护、血管扩张和抗纤维化作用等多种作用。Shaker等[18]研究表明,nilotinib能够抑制肝星状细胞激活和CCl4诱导的动物模型肝组织中α-SMA、Ⅰ型前胶原和TIMP-1的表达,减少胶原沉积,从而抑制肝纤维化形成。另外,nilotinib还能通过降低RAGE/HMGB1的基因表达与氧化应激缓解肝纤维化[19]。
2.1.5 Nintedanib(尼达尼布) Nintedanib又称为BIBF1120,是FDA于2014年批准用于特发性肺纤维化及某些非小细胞肺癌的药物,能够抑制FGFR、PDGFR和VEGFR等多种酪氨酸激酶活性。在人永生化肝星状细胞系LX-2、人原代肝星状细胞以及CCl4诱导的小鼠肝纤维化动物模型中,nintedanib均能有效抑制肝星状分化和胶原沉积。此外,nintedanib还能拮抗成纤维细胞对巨噬细胞和内皮细胞的旁分泌作用,抑制肝内炎症发生和血管生成[20]。
2.1.6 其 他 研究发现,其他已上市的酪氨酸激酶抑制剂如gefitinib、sunitinib、dasatinib和pazopanib等也具有抗肝纤维化作用[21-24]。Dasatinib可以通过抗炎和抗氧化机制缓解CCl4诱导的肝纤维化进程,Pazopanib可以通过调节炎性细胞因子以及调节血管生成来阻止肝纤维化的进展。此外,还有很多未上市的酪氨酸激酶抑制剂如brivanib、vatalanib和genistein等也表现出一定的抗纤维化活性[25-27](图 2和表 1)。
2.2 丝/苏氨酸激酶抑制剂
2.2.1 Everolimus(依维莫司) Everolimus是一种口服mTOR选择性抑制剂,2009年上市,目前常用作免疫抑制剂来预防器官移植排斥反应。文献报道,Everolimus能通过抑制多个不同病理过程抑制肝纤维化进程,它不仅能在不影响细胞活力和迁移的情况下抑制肝星状细胞的功能和ECM合成,还能抑制肝窦内皮细胞的新生血管生成和转移[28]。诺华公司已开展两项临床试验(NCT00582738和NCT01888432)考察everolimus在肝移植术后丙型肝炎复发患者中的抗肝纤维化效果[4]。
2.2.2 Selonsertib Selonsertib也称 GS-4997,是MAPK家族成员凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1)的选择性抑制剂。在动物模型中,selonsertib处理能减轻纤维化和肝脂肪变性,从而延缓和阻止肝脏疾病进展。一项Ⅰ期临床试验对selonsertib在正常和肝功能受损的志愿者中进行了评估(NCT02509624),随后的Ⅱ期临床试验数据显示,selonsertib能有效缓解非酒精性脂肪性肝炎和轻、中度肝纤维化(S2~S3期)患者的肝纤维化进程(NCT02466516)[29]。
2.2.3 F-351 F-351是一种用于肾纤维化和肝纤维化的非甾类抗纤维化小分子药物,对p38α激酶有抑制作用[2]。在超过7个动物模型研究中,F-351显著降低了肝纤维化和肾纤维化的发生,有效改善了疾病相关的主要生化和病理性紊乱。F-351能够抑制肝星状细胞增殖以及TGF-β信号通路。已完成的Ⅰ期临床试验数据显示,F-351具有良好的耐受性和药代动力学特性,在剂量高达600 mg/tid时也没有观察到严重的不良反应[2]。2015年6月在中国已启动F-351治疗HBV感染肝纤维化患者的Ⅱ期临床试验。
2.2.4 其 他 除了上述抑制剂外,已上市的fasudil、rapamycin、ruxolitinib[30-33]和 未 上 市 的galunisertib、myricetin、Y-27632等其他丝/苏氨酸激酶抑制剂也在体外及动物实验模型中表现出一定的抗肝纤维化作用(图 3和表 1)[34-42]。Ruxolitinib和myricetin在发挥抑制肝星状细胞活性的同时还具有抗炎作用,而rapamycin则可通过抗氧化作用缓解肝纤维化[32-33,35]。
2.3 PI3K激酶抑制剂
有多种未上市PI3K激酶抑制剂,如HS-173、LY294002和3-Methyladenine等,在体内外肝纤维化模型中均显示了良好的抗肝纤维化效果(图4和表 1)[43-45]。HS-173是一种新型咪唑并吡啶类似物,可通过阻断PI3K/Akt信号通路抑制肝星状细胞的生长和增殖,诱导肝星状细胞发生G2/M期阻滞和凋亡,减少Ⅰ型胶原的表达[43]。在TGF-β1激活的LX-2中,LY294002在抑制PI3K活性的同时,还能下调 TGF-β1/2的表达,抑制 Smad2和Smad3的磷酸化,通过同时抑制PI3K/Akt通路和TGF-β/Smad通路发挥抗肝纤维化作用[44]。3-Methyladenine不仅是一种选择性PI3K抑制剂,还能抑制自噬小体的形成。近期研究表明,3-Methyladenine在CCl4诱导的肝纤维化动物模型中,能够通过抑制NF-κB信号通路调节的肝星状细胞自噬来改善肝纤维化[45]。
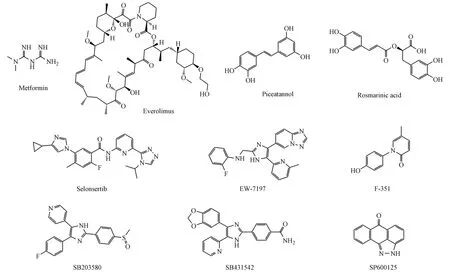
图3 丝/苏氨酸激酶抑制剂的化学结构
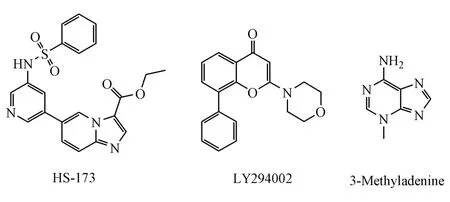
图4 PI3K激酶抑制剂的化学结构
3 SMKIs的肝毒性及对策
SMKIs在发挥抗肝纤维化作用的同时,也有不少肝脏不良反应的报道。大多数SMKIs是被肝脏内的细胞色素P450酶系统代谢,因此,SMKIs治疗很可能会引起肝功能异常患者的肝脏毒性,造成血清转氨酶等多种代谢酶水平升高、肝功能衰竭甚至引发死亡。最近一项针对3691名SMKIs治疗患者的Meta分析表明,有23%~40%的患者出现了不同程度的肝损伤[8]。美国 FDA对 pazopanib和sunitinib等多种SMKIs的药物说明书中均加入了“黑框警告”,警示该类药物存在潜在肝毒性[46]。
SMKIs造成肝毒性的原因主要包括两方面。有的SMKIs会产生对肝脏有直接毒性的活性代谢产物、与细胞大分子间的不稳定共价结合物、活性氧自由基和其他自由基等,从而直接损伤肝细胞[47]。例如,erlotinib代谢过程中形成的环氧化物和醌亚胺等,被认为与其肝、肠和肺毒性机制直接有关[5]。而有的SMKIs则可通过免疫反应,使肝脏成为细胞免疫反应或体液抗体作用的器官及抗体原复合物沉积的部位,从而间接损伤肝脏[48]。Takeda等[49]基于淋巴细胞刺激试验和服用gefitinib后血清丙氨酸氨基转移酶(ALT)水平显著升高认为,gefitinib诱导的肝损伤与免疫学机制相关。
由于激酶几乎涉及所有器官组织的正常生理过程,所以SMKIs可能会因为没有组织选择性而产生严重的不良反应,影响它们的临床应用。鉴于肝星状细胞在肝纤维化的形成、发展和恢复中的关键作用,选择性靶向肝星状细胞递送SMKIs不仅可以提高药物的抗肝纤维化作用,还能减少不良作用。选择性蛋白质载体是目前研究较为广泛的一种药物载体。利用甘露糖-6-磷酸修饰的人血清白蛋白纳米粒包载PDGFR-β抑制剂PAP-19,实现了药物的肝星状细胞选择性释放,有效降低了肝星状细胞和肝纤维化大鼠模型中纤维化相关标志物的表达[8]。另外,脂质体给药系统也是选择性递送抗纤维化药物研究的热点。El-Mezayen等[50]使用脂质体作为载体,将维生素A偶联的imatinib特异性靶向大鼠肝星状细胞,与常规腹腔给药组相比Imatinib的肝脏累积高13.5倍,有效抑制了PDGFR-β的磷酸化,从而改善了肝功能并且缓解了纤维化。
4 展 望
肝纤维化的有效防治是阻止其进一步发展为肝硬化和肝癌的关键,不少学者也在治疗肝纤维化新药的研究方面进行了有益探索[51-52],肝脏内激酶活性异常或过度表达与肝纤维化进程密切相关。多种临床前肝纤维化动物模型和一些临床试验结果证明了SMKIs靶向激酶治疗肝纤维化的有效性,将SMKIs从实验室研究转化到临床应用可能是未来肝纤维化治疗研究的新方向。但是,由于激酶的多器官分布和SMKIs的代谢特性,SMKIs引发的肝毒性不容忽视,将SMKIs选择性递送至肝星状细胞可能是降低其不良反应的有效方法。综上所述,SMKIs作为有潜力的肝纤维化治疗药物虽取得了一定进展,但真正用于肝纤维化的治疗仍有待进一步的研究和论证。
[1] Higashi T,Friedman SL,Hoshida Y.Hepatic stellate cells as key target in liver fibrosis[J].Adv Drug Deliv Rev,2017,121:27-42.
[2] Nanthakumar CB,Hatley RJD,Lemma S,et al.Dissecting fibrosis:Therapeutic insights from the small-molecule toolbox[J].Nat Rev Drug Discov,2015,14(10):693-720.
[3] Wu P,Nielsen TE,Clausen MH.FDA-approved small-molecule kinase inhibitors[J].Trends Pharmacol Sci,2015,36(7):422-439.
[4] Bansal R,Nagórniewicz B,Prakash J.Clinical advancements in the targeted therapies against liver fibrosis[J].Mediators Inflamm,2016,doi:10.1155/2016/7629724.
[5] Qu K,Liu T,Lin T,et al.Tyrosine kinase inhibitors:friends or foe in treatmentof hepatic fibrosis[J].Oncotarget,2016,7(41):67650-67660.
[6] Berndt N,Karim RM,Schönbrunn E.Advances of smallmolecule targeting of kinases[J].Curr Opin Chem Biol,2017,39:126-132.
[7] Ying HZ,Chen Q,Zhang WY,et al.PDGF signaling pathway in hepatic fibrosis pathogenesis and therapeutics[J].Mol Med Rep,2017,16(6):7879-7889.
[8] Qu K,Huang Z,Lin T,et al.New insight into the anti-liver fibrosis effect ofmultitargeted tyrosine kinase inhibitors:from molecular target to clinical trials[J].Front Pharmacol,2016,6:1-8.
[9] Mimche PN,Brady LM,Bray CF,et al.The receptor tyrosine kinase EphB2 promotes hepatic fibrosis in mice[J].Hepatology,2015,62(3):900-914.
[10]Beyer C,Distler JHW.Tyrosine kinase signaling in fibrotic disorders.Translation of basic research to human disease.[J].Biochim Biophys Acta-Mol Basis Dis,2013,1832(7):897-904.
[11]Cannito S,Novo E,Parola M.Therapeutic pro-fibrogenic signaling pathways in fibroblasts[J].Adv Drug Deliv Rev,2017,121:57-84.
[12]Meng X,Nikolic-Paterson DJ,Lan HY.TGF-β:themaster regulator of fibrosis[J].Nat Rev Nephrol,2016,12(6):325-338.
[13]Win S,Than TA,Zhang J,et al.New insights into the role and mechanism of c-Jun-N-terminal kinase signaling in the pathobiology of liver diseases[J].Hepatology,2017,doi:10.1002/hep.29689.
[14]Westra IM,Oosterhuis D,Groothuis GMM,etal.Precision-cut liver slices as amodel for the early onset of liver fibrosis to test antifibrotic drugs[J].Toxicol Appl Pharmacol,2014,274(2):328-338.
[15]Fraticelli P,Gabrielli B,Pomponio G,et al.Low-dose oral imatinib in the treatmentof systemic sclerosis interstitial lung disease unresponsive to cyclophosphamide:a phase II pilot study[J].Arthritis Res Ther,2014,16(4):R144.
[16]Fuchs BC,Hoshida Y,Fujii T,et al.Epidermal growth factor receptor inhibition attenuates liver fibrosis and development of hepatocellular carcinoma[J].Hepatology,2014,59(4):1577-1590.
[17]Ma R,Chen J,Liang Y,et al.Sorafenib:a potential therapeutic drug for hepatic fibrosis and its outcomes[J].Biomed Pharmacother,2017,88:459-468.
[18]Shaker ME,Ghani A,Shiha GE,etal.Nilotinib induces apoptosis and autophagic cell death of activated hepatic stellate cells via inhibition of histone deacetylases[J].Biochim Biophys Acta-Mol Cell Res,2013,1833(8):1992-2003.
[19]Khanjarsim V,Karimi J,Khodadadi I,et al.Ameliorative effects of nilotinib on CCl4induced liver fibrosis via attenuation of RAGE/HMGB1 gene expression and oxidative stress in rat[J].Chonnam Med J,2017,53(2):118.
[20] Öztürk Akcora B,Storm G,Prakash J,et al.Tyrosine kinase inhibitor BIBF1120 ameliorates inflammation,angiogenesis and fibrosis in CCl4-induced liver fibrogenesismousemodel[J].Sci Rep,2017,7:1-15.
[21] Wang L,Dong J,Xiong L,et al.Gefitinib,an EGFR inhibitor,prevents liver fibrosis development of mice[J].Int J Clin Exp Med,2017,10(2):2890-2896.
[22]Majumder S,Piguet AC,Dufour JF,et al.Study of the cellular mechanism of Sunitinibmediated inactivation of activated hepatic stellate cells and its implications in angiogenesis[J].Eur JPharmacol,2013,705(1/2/3):86-95.
[23]Mohammadalipour A,Karimi J,Khodadadi I,et al.Dasatinib prevent hepatic fibrosis induced by carbon tetrachloride via antiinflammatory and antioxidant mechanism[J].Immunopharm Immunot,2017,39(1):19-27.
[24]Elshal M,Abu-Elsaad N,El-Karef A,et al.The multi-kinase inhibitor pazopanib targets hepatic stellate cell activation and apoptosis alleviating progression of liver fibrosis[J].Naunyn Schmiedebergs Arch Pharmacol,2015,388(12):1293-1304.
[25] Nakamura I,Zakharia K,Banini BA,et al.Brivanib attenuates hepatic fibrosis in vivo and stellate cell activationin vitroby inhibition of FGF,VEGF and PDGF signaling[J].PLoSOne,2014,9(4):e92273.
[26]Kong LJ,Li H,Du YJ,et al.Vatalanib,a tyrosine kinase inhibitor,decreases hepatic fibrosis and sinusoidal capillarization in CCl4-induced fibrotic mice[J].Mol Med Rep,2017,15(5):2604-2610.
[27]Ganai AA,Husain M.Genistein attenuates D-GalN induced liver fibrosis/chronic liver damage in rats by blocking the TGF-β/Smad signaling pathways[J].Chem Biol Interact,2017,261:80-85.
[28]Piguet AC,Majumder S,Maheshwari U,et al.Everolimus is a potent inhibitor of activated hepatic stellate cell functionsin vitroandin vivo,while demonstrating anti-angiogenic activities[J].Clin Sci,2014,126(11):775-791.
[29]Loomba R,Lawitz E,Mantry PS,et al.The ASK1 inhibitor selonsertib in patientswith nonalcoholic steatohepatitis:A randomized,phase 2 trial[J].Hepatology,2017,67(2):549-559.
[30] Zhou H,Fang CX,Zhang LH,et al.Fasudil hydrochloride hydrate,a Rho-kinase inhibitor,ameliorates hepatic fibrosis in rats with type 2 diabetes[J].Chin Med J(Engl),2014,127(2):225-231.
[31]Nguyen G,Park SY,Le CT,et al.Metformin ameliorates activation of hepatic stellate cells and hepatic fibrosis by succinate and GPR91 inhibition[J].Biochem Biophys Res Commun,2018,495(4):2649-2656.
[32]Kim YJ,Lee ES,Kim SH,etal.Inhibitory effects of rapamycin on the different stages of hepatic fibrosis[J].World JGastroenterol,2014,20(23):7452-7460.
[33]Hazem SH,Shaker ME,Ashamallah SA,et al.The novel Janus kinase inhibitor ruxolitinib confers protection against carbon tetrachloride-induced hepatotoxicity via multiple mechanisms[J].Chem Biol Interact,2014,220:116-127.
[34]Luangmonkong T,Suriguga S,Bigaeva E,et al.Evaluating the antifibrotic potency of galunisertib in a humanex vivomodel of liver fibrosis[J].Br JPharmacol,2017,174(18):3107-3117.
[35]Geng Y,Sun Q,LiW,et al.The common dietary flavonoid myricetin attenuates liver fibrosis in carbon tetrachloride treatedmice[J].Mol Nutr Food Res,2017,61(4):1-9.
[36]Abd-elgawad H,Abu-elsaad N,El-karef A,et al.Piceatannol increases the expression of hepatocyte growth factor and IL-10 thereby protecting hepatocytes in thioacetamide-induced liver fibrosis[J].Can JPhysiol Pharmacol,2016,94(7):779-787.
[37]Lu C,Zou Y,Liu Y,et al.Rosmarinic acid counteracts activation of hepatic stellate cells via inhibiting the ROS-dependent MMP-2 activity:involvement of Nrf2 antioxidant system[J].Toxicol Appl Pharmacol,2017,318:69-78.
[38]Kim MJ,Park SA,Kim CH,et al.TGF-βtype I receptor kinase inhibitor EW-7197 suppresses cholestatic liver fibrosis by inhibiting HIF1α-induced epithelial mesenchymal transition[J].Cell Physiol Biochem,2016,38(2):571-588.
[39]Kagan P,Sultan M,Tachlytski I,et al.Both MAPK and STAT3 signal transduction pathways are necessary for IL-6-dependent hepatic stellate cells activation[J].PLoS One,2017,12(5):1-11.
[40]Davies MR,Liu X,Lee L,et al.TGF-βsmallmolecule inhibitor sb431542 reduces rotator cuffmuscle fibrosis and fatty infiltration by promoting fibro/adipogenic progenitor apoptosis[J].PLoS One,2016,11(5):e0155486.
[41]Kao YH,Chen PH,Wu TY,et al.Lipopolysaccharides induce Smad2 phosphorylation through PI3K/Akt and MAPK cascades in HSC-T6 hepatic stellate cells[J].Life Sci,2017,184:37-46.
[42]Zhang C-G,Zhang B,Deng W-S,et al.Role of estrogen receptor βselective agonist in ameliorating portal hypertension in ratswith CCl4-induced liver cirrhosis[J].World JGastroenterol,2016,22(18):4484.
[43]Son MK,Ryu YL,Jung KH,et al.HS-173,a novel PI3K inhibitor,attenuates the activation of hepatic stellate cells in liver fibrosis[J].Sci Rep,2013,3(1):3470.
[44]Yu D,Zhang C,Zhao S,etal.The anti-fibrotic effects of epigallocatechin-3-gallate in bile duct-ligated cholestatic rats and human hepatic stellate LX-2 cells aremediated by the PI3K/Akt/Smad pathway[J].ACTA Pharmacol Sin,2015,36(4):473-482.
[45]Wang B,Yang H,Fan Y,et al.3-Methyladenine ameliorates liver fibrosis through autophagy regulated by the NF-κB signaling pathways on hepatic stellate cell[J].2017,8(64):107603-107611.
[46]Karczmarek-Borowska B,Sałek-ZańA.Hepatotoxicity ofmolecular targeted therapy[J].Contemp Oncol(Poznań,Poland),2015,19(2):87-92.
[47]Teo YL,Ho HK,Chan A.Formation of reactive metabolites and management of tyrosine kinase inhibitor-induced hepatotoxicity:a literature review[J].Expert Opin Drug Metab Toxicol,2015,11(2):231-242.
[48] Shah RR,Morganroth J,Shah DR.Hepatotoxicity of tyrosine kinase inhibitors:clinical and regulatory perspectives[J].Drug Saf,2013,36(7):491-503.
[49]Takeda M,Okamoto I,Fukuoka M,et al.Successful treatment with erlotinib after gefitinib-related severe hepatotoxicity[J].J Clin Oncol,2010,28(17):e273-e274.
[50] El-Mezayen NS,El-Hadidy WF,El-Refaie WM,et al.Hepatic stellate cell-targeted imatinib nanomedicine versus conventional imatinib:a novel strategy with potent efficacy in experimental liver fibrosis[J].JControl Release,2017,266:226-237.
[51]Dai L,Zhang L,Ji H,et al.Therapeutic effects of ZK14,a novel nitric oxide donating biphenyldicarboxylate derivative,on hepatic fibrosis in rats[J].JChina Pharm Univ(中国药科大学学报),2009,40(3):254-257.
[52]Wan AN,Xu DS,CaiYF,etal.Anti-liver fibrosis activities of human insulin-like growth factor-1in vitro[J].JChina Pharm Univ(中国药科大学学报),2017,48(4):476-482.

