心房颤动与自身抗体的研究新进展*
邵梦娇 张玲 汤宝鹏 周贤惠
现阶段研究表明许多疾病是由自身免疫功能紊乱引起,称为自身免疫性疾病,如系统性红斑狼疮、类风湿性关节炎和器官特异性疾病(如Graves病)等。经过多年研究发现自身免疫也是心律失常的主要机制之一,一些临床及实验研究均证实心房颤动(AF)和自身免疫性疾病相关。
新近的研究提示自身抗体在AF的发生中发挥了重要作用[1],如抗β肾上腺素能受体自身抗体(抗β-R),抗M2-毒蕈碱受体自身抗体(抗M2-R),抗钠/钾 ATP酶自身抗体,抗肌球蛋白重链自身抗体,和抗热休克蛋白自身抗体等,对AF的发生、发展可能有重要的作用[2-3]。笔者就AF与自身抗体之间的相关研究及进展作一综述。
1 M2受体自身抗体
M2受体自身抗体是心脏G蛋白耦联受体的成员, 作用于M2受体第二细胞外环,与Gk和Gi两种G蛋白耦联。Gk激活心房钾通道;Gi抑制受体-腺苷酸环化酶(AC)的活性,减少环磷酸腺苷(cAMP)生成,降低蛋白激酶A (PKA)活性,关闭L型Ca2+通道,开放电压依赖性钾通道(KDR)。两种钾通道激活均产生复极化电流,增加舒张电位而导致负性频率作用。其自身抗体在扩张型心肌病、高血压性心脏病、Chagas心肌病等心肌疾病的发生、发展中起重要作用,而此类疾病患者均是AF的高发病人群。其心肌组织内主要为毒蕈碱乙酰胆碱受体,抗M2自身抗体在许多以心律失常为主要表现的疾病中都可以检测到。同时已在几种心律失常(如窦房结功能障碍,特发性 AF和特发性室性心动过速等)的病人中能够检测到抗M2R自身抗体阳性,证明免疫系统可能在心律失常的病理生理过程中发挥着一定的作用。还有临床研究显示,抗M2R自身抗体阳性的扩张型心肌病患者AF发病率明显增高,而且在部分孤立性AF的患者中也可以为阳性,说明抗M2R自身抗体通过改变心房肌的电生理特性促进AF的发生。据相关文献报道发现23%的AF患者抗M2R自身抗体阳性。因此,抗M2R自身抗体阳性也被认为是扩张型心肌病和Graves氏病患者AF发生和发展的独立预测因子[4-5]。
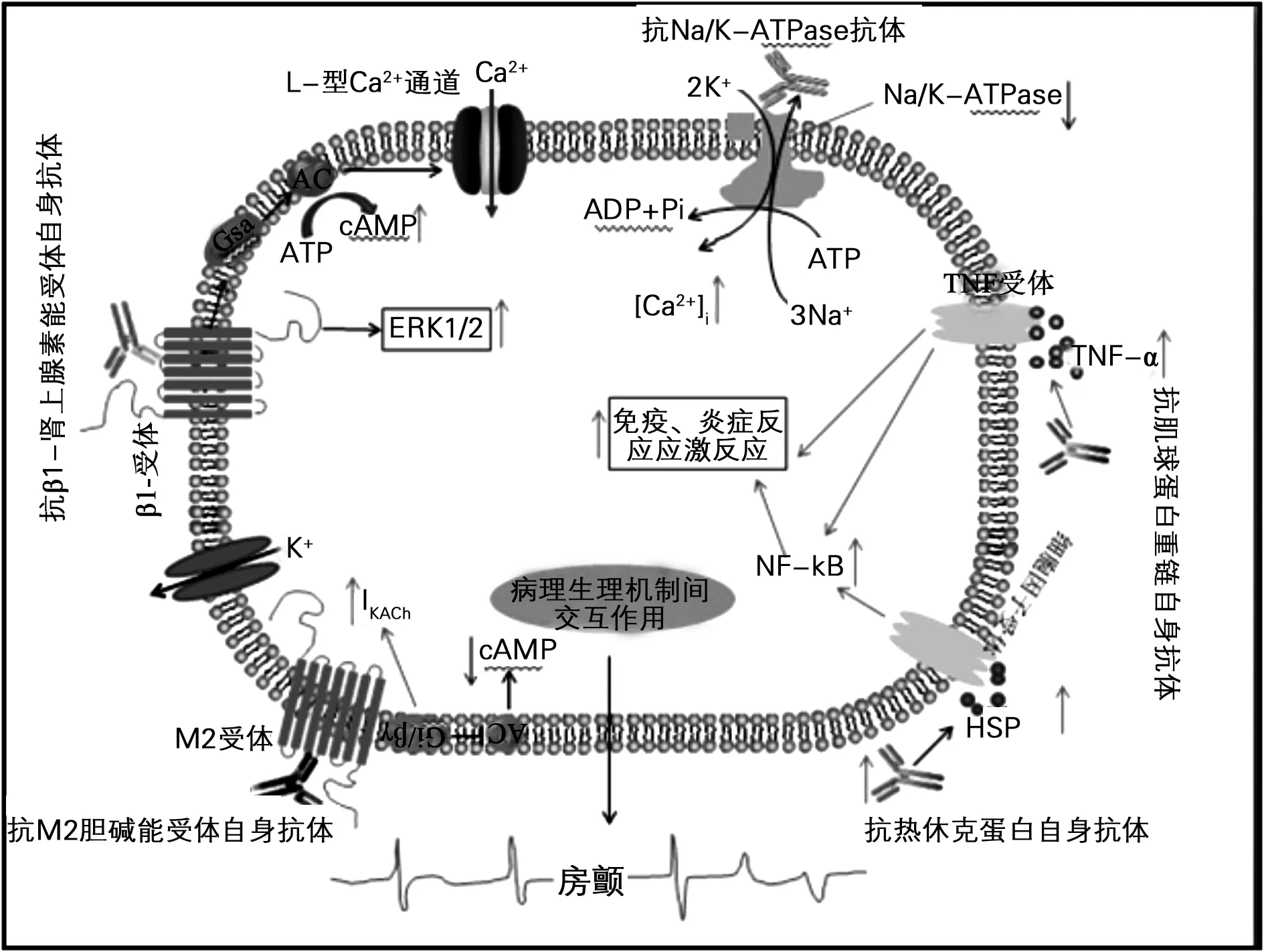
图1 心房颤动与自身抗体的离子通道发展机制作用图
洪昌明等[6]研究了抗M2R自身抗体与AF之间的病理生理以及机制的关系,将合成的 M2受体特征性多肽免疫新西兰大白兔,制作动物模型,通过Langendorff法灌注离体兔心脏,记录电生理效应以及心肌的形态学变化等。抗M2R自身抗体在心房肌分布散在不均匀,在阴性对照组和 M2 组均为左房高于右房。发现抗M2R自身抗体的不均衡分布使迷走兴奋后心房有效不应期离散度加大,导致心房内折返形成,并诱发AF。抗M2R自身抗体可使M2 受体信号转导通路激活,长时间M2 受体自身抗体刺激可使心房 M2 受体密度上调,cAMP 下降,胆碱酯酶活性降低,使突触间隙乙酰胆碱(Ach)积累,进一步刺激M2 受体的进一步激活。M2 受体通路激活可使下游Ach的钾通道上调,可能使复极化加速,减短动作电位时程(APD)及使L型钙通道下调,缩短APD,减慢传导速度。离子通道的重构是APD缩短、心房有效不应期缩短和心房有效不应期频率适应性下降等心电生理改变的分子基础。另一方面,抗M2R自身抗体过度表达能引起心房纤维化,长期M2 受体自身抗体刺激可造成心房电重构,改变心房电生理特性,损害窦房结功能,促进AF的发生和发展。其他研究显示抗M2R自身抗体与肺静脉电隔离后的AF复发有关。在此研究中,与年龄和性别匹配的健康者相比,首次证明AF患者的抗M2R水平明显高于其他心血管疾病的患者[7]。
Baba等[8]对抗M2R自身抗体的存在是否与扩张型心肌病患者AF高发病率做了相关研究。发现与对照组的健康受试者和不伴心室功能障碍的慢性AF患者相比,抗M2R自身抗体在扩张型心肌病患者中阳性率较高(40%),而健康受试者和慢性AF患者分别为 8%和 24%。在扩张型心肌病患者中,抗M2R自身抗体阳性者比阴性者AF多见(40% vs 18%)。除外年龄和心钠肽(ANP)外,抗M2R自身抗体阳性是AF发生和发展的又一独立预测因素。据此研究证实阳性患者中,抗M2R自身抗体可通过一系列方式改变心房肌的电生理特性,促进AF的发生。将抗M2R自身抗体阳性患者的血清注射到鸡胚中,可产生负性传导作用并可诱发室上性心律失常,说明抗M2R自身抗体可能促进了AF的发生和发展。
Stavrakis 等[9]研究甲状腺功能亢进(Graves氏病)患者中抗M2R自身抗体的功能及与AF的关系。研究选取了38名Graves氏病患者(17名AF心律+21名窦性心律)和10名健康受试者为对照组,发现抗M2R自身抗体在合并AF的Graves氏病患者中阳性率要远高于窦性心律的Graves氏病患者的抗M2R自身抗体(88% vs 1%)。通过电生理相关指标检测发现两种抗体具有相应受体激动剂样效应,抗M2R自身抗体可以结合并激活 M2 受体,引起细胞膜的超极化、复极过程的加剧以及APD的缩短,已有研究表明心房 M2 受体的激活可促进AF的发生和发展。另外同时刺激心房心外膜的交感和副交感神经节、对交感和副交感神经末梢进行局部刺激并同时给予乙酰胆碱和去甲肾上腺素或异丙肾上腺素均可诱发犬肺静脉肌袖的快速触发放电。自身抗体可能就是通过上述机制促进AF的发生和发展。通过多变量分析证明抗M2R自身抗体是AF的强预测因子,风险系数OR值为 33.61。
在人体心脏中,M2受体在心房的密度是心室的2倍。所以,抗M2R抗体对心房的影响作用比心室更大,同时对心房肌细胞起激动样作用,可能表明抗M2R抗体参与了AF的发生和发展[10]。此外,对抗M2R抗体的研究发现:抗M2R抗体可在多种心脏疾病患者中检出,表明该抗体可能与AF有密切的关系[11]。
综上所述,首先,抗M2R自身抗体通过G蛋白耦联激活后,使cAMP活性降低,激活KDR从而触发AF。其次,抗M2R自身抗体通过引起细胞膜的超极化、复极过程的加剧以及APD的缩短的方式改变心房肌电生理特性,可以促进AF的发生和发展。
2 抗β肾上腺素能受体抗体
β1-肾上腺素能受体是心脏G蛋白耦联受体成员,构成心脏β-AR补体的70%~80%,其被激活时介导的心脏交感神经也被激活。已知具有激动剂性质的β1-肾上腺素能受体自身抗体具有正性肌力和变时效应[12]。故抗β肾上腺素能受体自身抗体与心肌病和心律失常的发生密切相关。实验研究发现抗β1-R自身抗体通过增加产生cAMP和蛋白激酶PKA促进L型钙通道的开放,从而使细胞内钙释放增加,致心肌细胞破坏、纤维化变性和电生理不稳定,促进AF的发生和发展及炎症反应的发生。
Brisinda等[13]研究发现在AF患者和健康受试者中抗β1-R自身抗体的阳性检出率分别为41.6%和10%。研究证明在阵发性AF患者中抗β1-R自身抗体水平明显高于不伴心血管疾病的人群。
Hu等[7]研究证明:在兔模型中表达拟交感β-AR激活抗体导致心房有效不应期显著降低,而与AF组相比,非瓣膜性AF患者水平明显高于对照组抗β1-R自身抗体水平。此研究表明持续性AF中抗β1-R自身抗体水平显著升高,引起心房炎症和纤维化。Stavrakis等[9]研究发现Graves氏病患者AF和窦性心律的患者抗β1-R自身抗体的血清阳性差异显著(94% vs 38%,P<0.001)。在一项小型研究中AF患者和健康对照组较抗β1-R自身抗体阳性检出率有显著差异(41.6% vs 10%,P<0.001)。
此外,抗β1-R自身抗体也有促进AF的发展和维持的作用。郭宏伟等[14]研究发现,缺血性心肌病合并 AF 患者心肌中β1、M2 受体自身抗体阳性率升高,随着左房内径(LAD)逐渐扩大,其心脏 β1、M2 受体自身抗体阳性率相应升高,LAD与AF互为因果,与AF的发展、预后和血栓的形成息息相关,同时也是AF的独立预测因子。但 LAD > 50 mm 时,其心肌中β1、M2 受体自身抗体阳性率逐渐降低。说明心脏 β1、M2 受体自身抗体为代表的自身免疫机制参与早中期左房重构。
与Graves氏病患者相比,有AF患者较无AF者更有可能具有抗β1-R自身抗体[15]。AF患者的抗β1-R自身抗体的活性也明显高于窦性心律者[16]。在单发阵发性AF患者中,血清抗β1-R自身抗体水平明显高于健康对照组,抗β1-R自身抗体水平是预测孤立阵发性AF的独立预测因子[17]。正如血清抗M2-R自身抗体水平在导管消融后AF的复发中起预测作用,术前血清抗β1-R自身抗体水平也是阵发性AF患者冷冻消融术后AF复发的独立预测因子[18]。在孤立的犬肺静脉中,表明来自抗β1-R自身抗体阳性患者的IgG可以诱导超极化,降低动作电位持续时间,诱导早后除极。另外,在Li等[19]研究中发现抗β2-R自身抗体可促进心房心律失常的易感性。在抗β2-R自身抗体免疫前、后的5只兔中,在浓度递增的乙酰胆碱输入之前后有爆发性的心房刺激以至于诱发房性心律失常。结果表明与免疫前相比,免疫后兔房性心律失常(包括AF)发生率明显增高。免疫后的兔心房中IgG沉积,并且它们的血清,在免疫后细胞中抗β1-R自身抗体水平升高。
综上所述,抗β1-R自身抗体通过增加产生cAMP和蛋白激酶PKA促进L型钙通道的开放,从而使细胞内钙释放增加,致心肌细胞破坏、纤维化变性和电生理不稳定,促进AF的发生和发展。同时,抗β1-R自身抗体水平的增高可以引起心房炎症及纤维化,从而进一步的加重AF的发生和发展。
3 抗热休克蛋白自身抗体
热休克蛋白(HSP)是分子伴侣的一种,在保护细胞和器官免受压力和损伤方面具有重要作用。根据编码蛋白质分子量分为HSP90,HSP70,HSP60和小HSP家族[20]。在介导细胞保护作用和限制氧化应激平滑肌细胞的坏死中发挥主导作用[21]。热休克蛋白在充血性心力衰竭,血管疾病或急性心肌梗死的患者中水平升高[22]。
Mandal 等[23]对 329 名接受冠状动脉搭桥手术的患者调查发现,62 名患者术后出现了AF(19%),并且通过多变量分析得出抗 HSP65 自身抗体升高与术后AF发生密切相关,且随着抗体的水平降低,术后AF的发生率也降低,表明抗体介导的自身免疫反应参与AF的发生。HSP参与AF的发病机制,特别是心肌中的抗HSP27自身抗体可增加由阵发性AF向持续性AF转化的几率[24]。此外,抗HSP自身抗体具有不同的功能,其中包括作为细胞因子介导信号传递的作用[25]。
Kornej等[26]研究了HSP70和抗HSP70自身抗体增高对AF发生的作用及其对AF导管消融后的影响,发现:①HSP70和抗HSP70自身抗体的水平在对照组和AF患者组之间无统计学差异,但抗HSP70自身抗体水平与AF类型相关:持续性AF患者的抗HSP70自身抗体水平高于阵发性AF患者;②HSP70和抗HSP70自身抗体增加与导管消融后的总消融时间和能量相关,即抗HSP70自身抗体水平增加越多的患者,其导管消融时间越长、消融能量越高;③HSP70和抗HSP70自身抗体的增加与导管消融术后6个月后的AF复发相关,但在多变量分析中,总消融时间并不是引起AF术后复发的唯一预后因素。
由于抗HSP自身抗体增高可以诱导激活通过toll样受体(TLR),再通过髓样细胞分化因子受体激酶介导NF-κB信号转导后促进免疫炎症应激反应,致使AF的发生和发展。
4 抗肌球蛋白重链抗体
心肌肌球蛋白是一种主要的收缩蛋白,属于细胞内抗原物质,目前,人类心肌肌球蛋白重链(MHC)主要有两种亚型,分别为 α(快成分)和 β(慢成分),其中 α 亚型主要分布于心房肌,β 主要分布于心室肌。肌球蛋白是细胞内的蛋白物质,在正常情况下它能被免疫系统识别,由于免疫耐受不易产生抗体发挥病理作用。在特定情况下,如病毒感染、炎症反应,或具有遗传易感性,这种免疫耐受就可能被打破,这些细胞内自身抗原就会被免疫系统识别并提呈,通过自身免疫过程,产生具有病理作用的自身抗体[27]。据相关文献研究表明,在AF患者中发现的首个自身抗体就是抗心肌肌球蛋白重链抗体(AAMHC)[28]。1998年,Maixent等[29]通过单中心小样本的临床研究发现在特发阵发性AF的患者血清抗心肌肌球蛋白重链抗体阳性率较正常对照组较高,10 名特发阵发性AF患者中有 6 名抗体阳性,而年龄相匹配的健康对照组只有 1 名抗体阳性。由此提出:自身免疫是否参与了阵发性AF的发病机制?换句话说,阵发性AF是否由自身免疫所介导?另有研究进一步证实AF的发病机制中可能有自身免疫的参与,抗M2R自身抗体和AAMHC是AF发生、发展的独立危险因素。同时证实AF患者体内的自身抗体 AAMHC可以和人心房肌肌球蛋白重链特异性结合,与心房肌 β1 受体具有交叉反应,人肌球蛋白重链和 β1 受体的氨基酸序列具有相似性片段,具备发生交叉反应的基础。近年来多项研究证实,高血压合并AF的患者中自身抗体 AAMHC 的检出率(27.6%)要显著高于高血压非AF患者(14.7%),而且抗体阳性患者发生AF的比例(64.5%)也要高于抗体阴性患者(45.1%)。多变量分析显示自身抗体 AAMHC 也是高血压患者发生AF的重要危险因素和预测因素(OR=2.696)。这些结果充分显示自身抗体AAMHC 与AF的发生密切相关[27]。
Caforio等[30]在特发性AF患者心肌细胞中检测到AAMHC自身抗体,且阳性率比正常对照组高。研究发现AAMHC可轻度增加L型钙通道电流密度,但差异无统计学意义,也发现自身抗体 AAMHC 对心房肌细胞其它复极化电流如瞬间外向钾通道(Ito1)、超快速延迟整流钾通道(Ikur)均无明显影响。自身抗体 AAMHC对动作电位 APD20、APD50和 APD90均无显著影响。研究结果推测自身抗体 AAMHC对心房肌细胞离子通道无重构作用,可能通过其他机制来影响AF的发生和发展。另有研究报道 Chagas疾病中自身抗体AAMHC 参与了心肌的炎症反应[31]。用猪心肌肌球蛋白免疫小鼠后,炎症因子 VCAM-1、ICAM-1 和 肿瘤坏死因子(TNF-α)水平升高,导致心肌的炎症反应[32]。在自身免疫性心肌炎或扩张型心肌病患者中存在自身抗体AAMHC,抗体所致的炎症反应导致了心肌损害。汪朝晖等[33]用猪心肌肌球蛋白免疫小鼠后,在小鼠体内检测到自身抗体AAMHC,并且引发了小鼠心肌损害如心肌坏死、炎症浸润及纤维化等。因此,自身抗体 AAMHC对心房肌的炎症反应或对心房肌的收缩重构等机制参与了AF的发生与发展。
5 抗钠/钾 AT P酶自身抗体
钠-钾ATP酶存在于细胞膜中,是对钠和钾两种离子能进行交换的主动运输的酶,调节细胞内钠离子的浓度和间接调节细胞内钙离子的浓度,影响细胞静息膜电位和变力性,具有致心律失常的作用。在95例充血性心力衰竭患者的队列研究中,约有16%的患者发现存在抗 Na/K-ATPase催化亚基的自身抗体,而在年龄相匹配的健康对照组中没有发现这种抗体[34-35]。进一步研究表示[36],抗 Na/K-ATPase 自身抗体在扩张型心肌病患者中的检出率高于缺血性心肌病患者,而扩张型心肌病由于机械重构导致的电重构更易引起AF的发生,所以抗 Na/K-ATPase 自身抗体与阵发性AF的发病率有关。
Tran等[37]对67例心脏手术患者进行心房心肌活检,他们使用钒酸盐促进3H-哇巴因结合来定量Na/K-ATP酶。用离子选择性电极测量血浆钾浓度。发现术前窦性心律患者3H-哇巴因结合位点浓度比术后发生AF的患者高16%。通过多变量分析发现3H -哇巴因结合位点浓度与AF的发生有显著相关性。围手术期和手术期间血浆钾浓度升高与术后AF有关。Na/K-ATP酶上调可能是心房重塑的又一关键点,其上调可降低AF的风险。而抗钠/钾 ATP酶自身抗体升高同时伴随着Na/K-ATP酶的降低,同时由于去极化增加Na流入量也增加。增加的Na/K-ATP酶浓度将增强Na/Ca交换,降低钙负荷。而已知钙超载是心房肌电重塑的重要促进原因。因此,增加的Na/K-ATP酶可以降低AF变成永久性或持续性的风险。此外,抗Na/K-ATP酶自身抗体活性通过交感神经系统活性增强[38]。
综上所述,越来越多的证据表明AF由自身免疫介导。新近的研究提示自身抗体在AF的发生、发展中发挥了重要作用,以上结论可指导如何降低患者自身抗体的水平,可指导AF的进一步治疗,成为AF治疗的关键点之一。为治疗AF提供了新视角,同时提出利用类固醇类药物、免疫抑制剂和/或通过免疫吸附技术将自身抗体去除来治疗和缓解AF。
1 Chen PS, Chen LS, Fishbein MC, et al. Role of the autonomic nervous system in atrial fibrillation: Pathophysiology and therapy[J]. Circ Res,2014,114:1 500
2 Aso S, Yazaki Y, Kasai H, et al.Anti-beta 1-adrenoreceptor autoantibodies and myocardial sympathetic nerve activity in chronic heart failure[J]. Int J Cardiol,2009, 131:240
3 Gollob MH. Atrial fibrillation as an autoimmune disease[J]? Heart Rhythm,2013, 10:442
4 Kurt M, Tanboga IH, Karakas,et al.The relationship between atrial electromechanical delay and P-wave dispersion with the presence and severity of metabolic syndrome[J]. Turk Kardiyoloji Dernegi Arsivi,2012,40:663
5 Fujita M, Cheng XW, Inden Y, et al. Mechanisms with clinical implications for atrial fibrillation-associated remodeling: hCathepsin K expression,regulation, and therapeutic target and bio-marker[J]. J Am Heart Assoc,2013,2:e 000 503
6 洪昌明,郑强荪,刘雄涛,等. 抗M2受体自身抗体对家兔心房电生理特性的影响[J]. 山东医药,2015,(33):32
7 Hu B, Sun Y, Li S, et al. Association of β1-adrenergic, M2-muscarinic receptor autoantibody with occurrence and development of nonvalvular atrial fibrillation[J]. Pacing and Clinical Electrophysiology, 2016,39: 1 379
8 Baba A, Yoshikawa T, Fukuda Y, et al. Autoantibodies against M2-muscarinic acetylcholine receptors: new upstream targets in atrial fibrillation in patients with dilated cardiomyopathy[J]. Eur Heart J,2004,25:1 108
9 Stavrakis S, Yu X, Patterson E, et al. Activating autoantibodies to the beta-1 adrenergic and M2 muscarinic receptors facilitate atrial fibrillation in patients with Graves′ hyperthyroidism[J]. J Am Coll Cardiol,2009,54: 1 309
10 Pan Q, He YS, Zhang ZM, et al. Spatial heterogeneity of muscarinic type 2 receptors in the atrium[J]. International Journal of Cardiology, 2008,127(3) :427
11 Pei J, Li N, Chen J, et al. The predictive values of beta1-adrenergic and M2 muscarinic receptor autoantibodies for sudden cardiac death in patients with chronic heart failure[J]. Eur J Heart Fail,2012,14(8):887
12 Chiale PA, Garro HA, Schmidberg J, et al. Inappropriate sinus tachycardia may be related to an immunologic disorder involving cardiac beta andrenergic receptors[J]. Heart Rhythm,2006,3(10):1 182
13 Brisinda D, Sorbo AR, Venuti A, et al. Anti-beta-adrenoceptors autoimmunity causing 'idi-opathic' arrhythmias and cardiomyopathy[J]. Circ J,2012,76(6):1 345
14 郭宏伟,张爱军,饶玲璋,等.缺血性心肌病并房颤患者心脏β-1、M-2受体自身抗体与左房内径的关系[J]. 山东医药,2011,45:68
15 Karnabi E, Boutjdir M. Role of calcium channels in congenital heart block[J]. Scand J Immunol,2010,72:226
16 Hernandez CC, Nascimento JH, Chaves EA, et al. Autoantibodies enhance agonist action and binding to cardiac muscarinic receptors in chronic Chagas′disease[J]. J Recept Signal Transduct Res,2008,28:375
17 Lazzerini PE, Capecchi PL, Guideri F, et al. Autoantibody-mediated cardiac arrhythmias: mechanisms and clinical implications[J]. Basic Res Cardiol,2008,103:1
18 Eisen A, Arnson Y, Dovrish Z, et al. Arrhythmias and conduction defects in rheumatological diseases——A comprehensive review[J]. Semin Arthritis Rheum,2008,39:145
19 Li HL, Scherlag BJ, Kem DC, et al. Atrial tachycardia provoked in the presence of activating autoantibodies to β2-adrenergic receptor in the rabbit[J]. Heart Rhythm, 2013,10(3): 436
20 Latchman DS. Heat shock proteins and cardiac protection[J]. Cardiovasc Res,2001,51: 637
21 Dybdahl B, Slordahl SA, Waage A, et al. Myocardial ischaemia and the inflammatory response: release of heat shock protein 70 after myocardial infarction[J]. Heart,2005,91: 299
22 Baba A, Fu M. Autoantibodies in atrial fibrillation: actor, biomaker or by taner[J]. Autoimmunity,2008,41:470
23 Mandal K, Jahangiri M, Mukhin M, et al. Association of anti-heat shock protein 65 antibodies with development of postoperative atrial fibrillation[J]. Circulation,2004, 110: 2 588
24 Brundel BJ, Henning RH, Ke L, et al. Heat shock protein upregulation protects against pacing-induced myolysis in HL-1 atrial myocytes and in human atrial fibrillation[J]. J Mol Cell Cardiol, 2006, 41: 555
25 张宇祯,曹克将.热休克蛋白与心房颤动[J].中国心脏起搏与心电生理杂志,2009,23(3):258
26 Kornej, Reinhardt C, Kosiuk J,et al.Response of circulating heat shock protein 70 and anti-heat shock protein 70 antibodies to catheter ablation of atrial fibrillation[J]. Journal of Translational Medicine,2013,11:49
27 连亦田.高血压合并房颤患者抗M2胆碱能受体抗体和抗肌球蛋白重链抗体的检测及其对人心房肌细胞电生理特性影响的研究[D].华中科技大学,2012
28 Caforio AL, Goldman JH, Haven AJ,et al. Evidence forautoimmunity to myosin and other heart-specific autoantigens in patients with dilated cardiomyopathy and their relatives[J]. Int J Cardiol,1996,54(2):157
29 Maixent JM, Paganelli F, Scaglione J, et al.Antibodies against myosin in sera of patients with idiopathic paroxysmal atrial fibrillation[J]. J Cardiovasc Electrophysiol,1998,9:612
30 Caforio AL, Goldman JH, Haven AJ, et al. Evidence for autoimmunity to myosin and other heart-specific autoantigens in patients with dilated cardiomyopathy and their relatives[J]. Int J Cadiol,1996,54(2):157
31 Tibbetts RS,McCormick TS,Rowland EC,et al. Cardiac antigen-specific autoantibody production is associated with cardiomyopathy in Trypanosoma cruzi-infected mice[J]. J Immu-nol,1994,152(3):1 493
32 Wang Y, Afanasyeve M,Susan L,et al.Characterization of murine autoimmune myocarditis induced by self and foreign cardiac myosin[J]. Autoimmunity,1999,31:151
33 汪朝晖,廖玉华,董继华,等. 肌球蛋白致自身免疫性心肌疾病的实验研究[J]. 中华心血管病杂志,2003,60 (12):499
34 Yoshikawa T, Baba A, Nagatomo Y. Autoimmune mechanisms underlying dilated cardiomyo-pathy[J]. Circ J,2009,73:602
35 Baba A, Yoshikawa T, Chino M, et al. Autoantibodies: new upstream targets of paroxysmal atrial fibrillation in patients with congestive heart failure[J]. J Cardiol,2002,40:217
36 Bers DM, Despa S. Na/K-ATPase an integral player in the adrenergic fight-or-flight re-sponse[J]. Trends Cardiovasc Med,2009,19:111
37 Tran C, T Schmidt T, A Christensen J, et al. K-ATPase increase and potassium dysregulation accentuate the risk of postoperative atrial fibrillation[J]. Cardiology,2009,114:1
38 Bakhtiary F, Therapidis P, Dzemali O, et al. Impact of high thoracic epidural anesthesia on incidence of perioperative atrial fibrillation in off-pump coronary bypass grafting: a prospective randomized study[J]. J Thorac Cardiovasc Surg,2007,134:460

