法国药品临床疗效和临床疗效改善评级管理及其借鉴启示
卢碧香,关轶茹,张 方(沈阳药科大学工商管理学院,辽宁 沈阳 110016)
药品价格是药品疗效的体现,合理的药品价格既能激发企业创新药物积极性,又能促进公共健康福利事业发展,所以药品价格已成为世界各国政府与公众高度关注的公共政策。法国不仅是药物创新大国,而且拥有最好的卫生福利制度。法国属高收入、高税收、高福利制度国家,全民享受健康保险且健康水平较高[1]。在法国的卫生支出费用中,公共支出占60%以上,居民医保覆盖率达100%,而自付比例低于13%[2]。
法国第三方药品评级机构最高卫生委员会下设透明委员会(transparent committee,TC),根据药品有效性、安全性、质量可控性、依从性、创新性、社会属性等指标对药品进行临床疗效(Service Médical Rendu,SMR)和临床疗效改善状况(Amélioration du Service Médical Rendu,ASMR)评级[3],评级结果为药品价格委员会定价和医保支付部门制定医保偿付比率提供参考依据。SMR、ASMR评级突出了药品临床疗效的重要性,药品临床疗效是药品的核心价值,药品价值决定价格,建立以价值为依据的药品价格对我国不断完善医保支付制度,引导药品价格合理形成机制具有借鉴意义。
1 法国药品临床疗效评级相关机构及流程介绍
1.1 法国药品评级流程
法国药品价格谈判主要涉及三个机构,分别为法国国家卫生机构(HAS)、卫生产品经济委员会(CEPS)和国家疾病基金会(UNCAM)。国家疾病基金会由法国三大社会保险机构组成。HAS负责备选药的资格审查,该机构相当于我国医保评审过程中的咨询专家组。药品生产企业在拿到药监局审批后,将临床试验数据、生产许可证等申请资料递交至HAS,HAS下设TC对药品进行临床疗效(SMR)和临床疗效改善(ASMR)评估,评估结果将递交给CEPS和UNCAM,最终卫生部做出是否纳入医保的决定,这一过程为期3 ~ 6个月(快速审批流程2个月)。随后,由CEPS与企业进行价格谈判,确定药品价格,为期6 ~ 9个月(快速审批流程3个月);在此过程中,CEPS发挥着类似于我国社保中心和发改委的作用。CEPS中具有投票权的成员由来自社会事务部、卫生部、产业部和财政部的代表组成。谈判的主要参考依据包括ASMR分级、竞品价格、欧洲市场价格、未来三年销量预测等。企业与CEPS签订报销合同后,再由UNCAM确定报销比例,为期1个月,之后药品正式上市。其中药品具体的上市评级流程如图1所示。
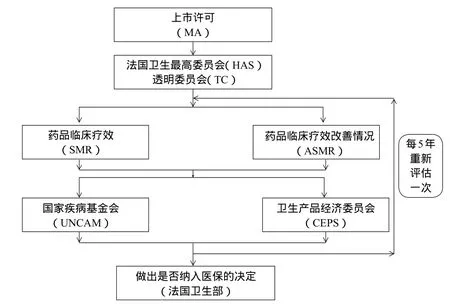
图1 法国药品评级流程图Fig 1 Flow chart of French medicine assessment system
1.2 透明委员会
法国药品疗效评级由TC进行,TC是法国最高卫生委员会设立的第三方评级机构,TC分别对药品进行SMR和ASMR评级,其中SMR评级结果为UNCAM或医院使用的药品提供报销建议,ASMR评级结果为CEPS提供定价依据。TC的主要作用包括以下三点:①药品申请纳入医保报销目录(包括初次申请,再次申请,发现新的临床适应证重新纳入医保申请)前,或卫生部要求重新评价该药品时,TC对该药品进行SMR和ASMR评级。②评级某一类药品与现有治疗方案相比的SMR和ASMR,为相关机构提供决策建议。③发布药品在某类疾病中的临床疗效信息,促进医患合理用药。
2 法国药品评级特点
2.1 SMR评级
SMR是药品纳入医保报销目录的关键因素,评价药品的疗效需考虑药品是否需纳入医保,是否在临床上引起关注[4-5]。具体评级指标主要有以下5点:①疾病的严重程度及对发病率和死亡率的影响;②有效性和安全性等临床疗效结局指标;③药品作用类别(预防、诊断、治疗);④替代治疗方案;⑤对公共卫生的影响(疾病负担,对社区卫生保健的影响)。其中药品的临床疗效、疾病的严重程度、药品的风险/收益比率及治疗替代品特性为最重要的评级指标[2]。
其中临床疗效不足,为SMR最低级别,此级别药品将不被纳入到医保目录中。以下7种情况视为临床疗效不足:①临床效果很小、无临床意义或产生严重不良反应事件;②药品的临床疗效较小、弱或非常小;③在治疗过程中发现疗效与申请上市时的临床试验的疗效存在差异;④无治疗诊断或预防等临床作用;⑤药品临床适应证症状为不太严重的病症或所治疗疾病可自然治愈,如流行性感冒等;⑥临床上存在相似疗效的替代治疗方式,且这种治疗方案疗效更好、不良反应更少;⑦固定剂量组合的药品无临床意义。
2.2 ASMR评级
2.2.1 ASMR评级流程 TC进行ASMR评级,主要评级新药在有效性、安全性、药物警戒等方面是否较现有药品或治疗方案有优势。评级需先确定在治疗某一类疾病时,该药品的参比制剂,而后与参比制剂进行直接比较,比较的内容包括该药品在治疗某一疾病的主要结局指标中的疗效及临床意义。若在方法学允许的条件下,也可对药品或治疗方案之间进行间接比较。该评级过程将疾病状况和药品性质联系起来,因此一种药品在不同疾病症状中的评级建议是不同的[5]。
评价药品的ASMR,TC需与现有治疗方式做比较,评价该药品是否对患者的疾病状况有改善作用。ASMR具体定级状况如表1所示,其中Ⅰ到Ⅲ级为创新药品价格,Ⅳ到Ⅴ级为常规药品价格。创新药品(ASMRⅠ至ASMRⅢ级)和常规药品(ASMRⅣ至ASMRⅤ)分别采用外部参考定价程序和内部参考定价程序定价。其中Ⅰ级指较现有治疗方式具有疗效优势,是目标适应证的原研药,或该病症此前无药可用,Ⅱ级指较现有药品具有重大疗效改进,Ⅲ级指较现有药品具有一般改进,Ⅳ级指比现有药品具有少量改进,Ⅴ级指没有临床疗效提高。
2.2.2 ASMR评级 当该药品与现有参比制剂相比,临床上未发现较参比制剂具有更好的疗效,则该药被评为最低级ASMR V。若与参比制剂相比,具有优势,则根据优势的重要程度来确定ASMR级别。其中主要的临床疗效改善,被评为ASMRⅠ级,是指对严重疾病的死亡率有显著降低的药品。重要的、中度的、微小的临床疗效改善分别为ASMRⅡ、Ⅲ、Ⅳ级别的药品,指临床疗效更佳或安全性更高,不良反应更少,此外新的给药方式等其他临床优势也可被评为临床疗效改善。

表1 ASMR等级Tab 1 Assessment of ASMR
2.3 SMR和ASMR评级证据概述
2.3.1 SMR SMR的评估结果包括以下几项内容:①疗效证据评估:疾病严重程度是评估疗效的前提,疾病的严重程度包括是否为慢性病、罕见病、严重性疾病等,然后根据企业提供的临床疗效、安全性、疗效/安全性比率数据评估该药品的临床作用,最后综合分析该药品的处方状况、治疗用途、覆盖人群以及该药品的替代治疗方式等证据,评估该药品是否为临床上不可或缺的药品。②公共卫生效益:首先根据流行病学数据,判断该疾病的治疗现状及后期发展状况,其次考虑将该药品纳入医保目录后是否对患者的死亡率产生影响,即是否极大的降低该类疾病的死亡率,若该类药品是疫苗等防疫型药品,需考虑纳入医保目录后是否影响该类疾病的发病率。最后在评估企业提供数据的可靠性的基础上,TC做出该类药品纳入医保后是否对公共卫生产生重大影响。③其他评估内容:根据该药品的包装、规格、治疗持续时间等评估该药品是否具有使用方便等特征。
2.3.2 ASMR ASMR评级的核心点是该药品较其他药品具有更高的临床疗效,若该类药品在临床随机对照试验结局指标中较同类药品具有显著性差异,则该药品的临床疗效改善评级为Ⅳ级以上,若该药品与同类药品在同一结局指标中没有显著性差异,则ASMR评级为Ⅳ。在临床疗效相当时,若该药品能极大的改善治疗该药品的严重不良反应,该药品的ASMR评级仍为Ⅳ级别以上,同时将针对不良反应对该药品的相应治疗人群做出推荐。如2014年由于不良反应事件再次评估甘精胰岛素(来得时®)时,TC委员做出的结论为持续关注该药后期的不良反应研究,同时为了防止低血糖的风险,不再推荐该类药品作为DT2的强化治疗[6]。
进行药品临床疗效评估,最关键的证据为临床疗效安全性和有效性数据,其中临床研究证据来源于临床原始研究、综述研究文献等临床研究,不良反应证据除了来自临床研究外,更多的来自自发不良反应报告。除了以上两方面证据外,在TC给出建议之前还需要考虑该药品的临床适应证、适用人群、原有的处方状况等数据,这些数据分别来自企业、流行病学研究、循证医学等研究。最后根据以上的循证医学、药物经济学、流行病学等研究,TC委员会作出疾病报销建议,而ASMR将作为法国药品定价委员会定价依据。
3 SMR、ASMR评级作用
3.1 依据SMR确定药品报销比例
法国疾病基金委员会根据SMR级别及疾病严重程度,做出药品费用偿付比例,不同SMR评级级别及报销比例如表2所示。但一些特殊状况下,法国国家疾病基金会仍会负担全部的药品费用。如用于癌症,艾滋病,列入30种严重疾病目录之一的疾病、严重长期慢性疾病、及患某种严重疾病或并发症超过6个月以上的疾病[7]。
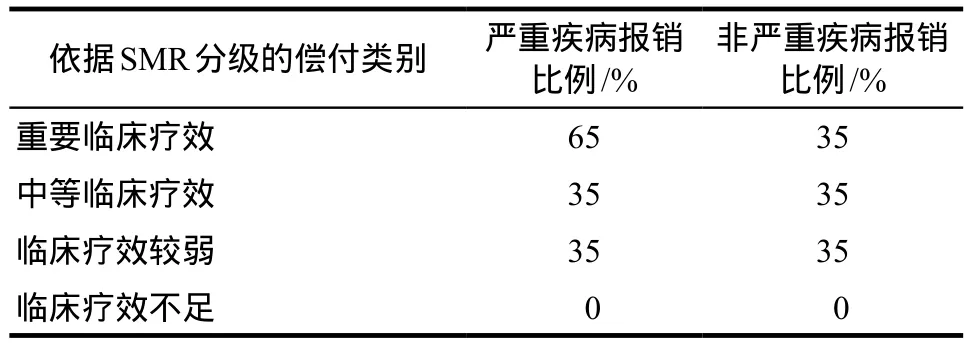
表2 依据SMR分级的报销比例Tab 2 Actual clinical bene fi t and reimbursement
3.2 依据ASMR评级制定价格和报销状况
法国药品定价部门参照ASMR评级进行定价。只有成本低于被比较药物的ASMRⅤ级别的药品才被列入药品正面报销目录,成本更低指价格更低或该药品带来治疗成本节约。因此在法国ASMRⅤ级的药品价格通常小于参比制剂,日均药品费用至少较参比制剂低5%左右。ASMRⅣ级的药品,若该药的仿制药即将上市,UNCAM会认为该药品纳入医保将不会增加国家疾病报销基金的负担,给予纳入。对于ASMRⅣ级别的其他药品,取决于该药品的患病人群,若与参比制剂的治疗人群相同,则该药品没有价格优势,但若该药品目标人群更广,则具有定价优势,反之适用人群有限,则没有定价优势。总之ASMRⅣ级的药品可较参比制剂制定更高的价格,但没有该级别药品具体的价格优势细则或依据,因此对于该级别的药品,通常法国医保部门会与制药企业持续进行很长时间的谈判,才能达成价格协议。
ASMRⅠ到ASMRⅢ级的药品纳入到医保正面目录的谈判时长较短。ASMRⅠ,Ⅱ,Ⅲ级别的药品,以及净成本节约的ASMR Ⅳ级别的药品,企业可在申请纳入医保目录时要求该药品价格与欧洲其他国家一致,但不能高于英国、德国、意大利和西班牙等国家。总之ASMRⅠ到ASMRⅢ级别的药品可以制定比参比制剂更高的价格,而ASMRⅣ,Ⅴ级的药品定价,医保部门要求企业签订量价协议,方能纳入医保目录,显然经过谈判最终降低了该部分药品的价格[5,7-8]。ASMR具体评级及定价状况如表3所示。
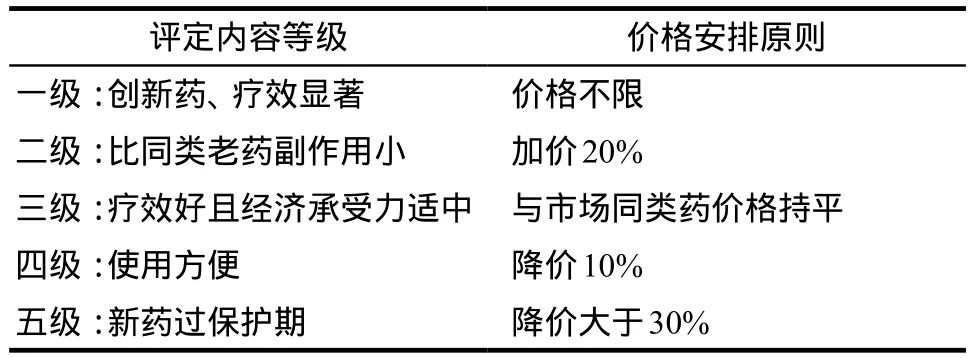
表3 ASMR评级与定价标准Tab 3 ASMR rating and pricing standard
4 讨论
4.1 法国药品评级优势分析
法国设定第三方药品临床疗效评级机构,形成以临床疗效为基础的药品谈判定价机制,使法国的药品价格低于欧盟的平均水平。且该评级定价机制将药价与医保支付紧密结合,既有效确保该国药价政策的落实,也促进了医保基金的有效偿付。法国严格的定价管理制度,使得定价过程分工明确,透明度高,政府与专家结合,具有较高的科学性与公平性[9]。但法国严格的药品价格管理制度,使该国药价低于邻国平均水平,也在一定程度上影响了本国制药企业从事新药研发的积极性。
4.2 法国药品临床疗效评级机制对我国的启示
我国自2009年“医改方案”提出医保谈判机制,实质性开展是在2012年,2012年我国建立了城乡居民大病保险制度,提出了由各省制定的“合规医疗费用”,由此开始了地方医保谈判。2015年,发改委取消药品定价,提出制定医保支付标准。2016年5月,由卫计委牵头举行的创新药价格谈判,通过了韦瑞德、易瑞沙、凯美纳三个产品。但谈判中并没有以医保准入为条件,而是以卫计委主管的“中标”为条件。由于创新药在地方中标的压力并不大,因此制药企业的参与并不积极。2017年初,新版医保目录公布的同时,医保主管部门列出了拟谈判的药品清单并牵头举行了谈判。此次谈判开创性引入了国际通行的卫生技术评估方法(health technology assessment),鼓励企业采用成本效用等药物经济学方法测算药品进入国家目录后的预期支付标准,并就销量增加情况作出定量预测[10]。但谈判准入评估机制在我国的研究起步较晚、规范性较弱,程序证据不明,急需制定更加完备的药品临床疗效评级机制,使得药品纳入医保目录更加科学、规范。
谈判评估机制在我国的研究起步较晚,实现药品谈判评估从“专家定性评价”向“以证据支持的定量评价”任重道远,需借鉴国际经验并结合我国国情不断完善药品谈判机制。法国设立第三方药品评估机构对药品进行临床疗效和药物经济学等相关证据进行评估,对今后科学设计医保目录动态调整机制,推动我国以临床疗效循证证据为依据的谈判机制,实现谈判成果效益最大化,对不断完善我国药品谈判机制具有借鉴意义。
我国可借鉴法国药品评估谈判机制,设立独立的第三方评估机构。首先遴选出药品临床疗效专家库[11],制定药品临床疗效评级方法,甄选药品安全性、有效性、经济性和创新性等方面的评价指标,推动客观、合理、高效、可操作的药品临床疗效综合评级指标体系建立[12]。并确定各指标的权重系数,形成药品临床疗效综合评价体系,对药品临床疗效进行量化评级,并根据评级结果、结合成本等因素对药品进行评级。最后,形成临床疗效评级机制,对即将上市药品、未上市药品、已上市药品进行临床疗效评级和临床疗效改善状况动态监管评级,使得药品价格处于动态临床疗效监测中,促进我国制定更加科学、合理、有效的医保支付标准,使我国医保基金得到更加合理有效的利用。
4.3 对我国建立临床疗效评级机制关键指标的建议
建立我国临床疗效评级指标是实行药品临床疗效评级机制的核心,一套合理、有效、可行的药品临床疗效综合评价指标体系需综合药品各属性[12-13]。本文根据法国临床疗效评级机制,建议在临床疗效评级中综合考虑以下指标:①药品的核心价值即药品在临床试验中对疾病的主要疗效指标的影响、药品不良反应状况;②药物使用目标人群特点,包括疾病的流行程度、疾病严重或危及生命的程度、疾病负担大小、疾病对患者工作生活的影响程度、疾病是否具有传染性及传染性的大小;③与现有治疗方式相比对疾病状况的影响,即针对缺乏治疗措施的疾病较现有治疗措施具有明显临床疗效优势;④药品的治疗目的,包括预防用药的隐形成本、药物在疾病治疗(预防、诊断、治疗)中的作用大小;影响药物临床疗效的其他因素(药物的安全性风险大小、药物临床使用的复杂性和依从性、药物的可及性因素)。
[参考文献]
[1] 张方,张大为,孟丽华,等.药品临床价值评估指标体系的构建研究[J].中国药学杂志,2017,52(8):706-710.
[2] 郑淇,张方.法国药品定价管理过程与方法介绍[J].中国药业,2014,23(4):3-6.
[3] Drummond M, De Pouvourville G, Jones E,et al. A comparative analysis of two contrasting European approaches for rewarding the value added by drugs for cancer: England versus France[J].2014, 32(5): 509-520.
[4] Pouvourville GD. HAS to be NICE?[J]. Eur J Health Economics,2013, 14(3): 363-366.
[5] HAS. Évaluation des médicaments: le service médical rendu et l' amélioration du service médical rendu[EB/OL]. (2016-07-11)[2017-12-28]. https://www.has-sante.fr/portail/jcms/c_2623726/fr/early-dialogue-for-a-medicinalproduct-in-clinicaldevelopment#toc_3_3.
[6] French National Authority for Health. Price & reimbursement of drug and HTA policies in France[EB/OL].(2015-10-29)[2017-11-27]. http://www.docplayer.net/37405933-Pricingreimbursement-of-drugs-and-hta-policies-in-france-nationalauthority-for-health-haute-autorite-de-sante-france-march-2014.html.
[7] Sermet C, Andrieu V, Godman B,et al. Ongoing pharmaceutical reforms in France: implications for key stakeholder groups[J].Appl Health Econ Health Policy, 2010, 8(1): 7-24.
[8] 张昊,董铎,程刚.法国与加拿大药品监管机构设置与启示[J].中国药物警戒,2013,10(9):536-539,542.
[9] 丁锦希,赵悦,顾海.法国创新药物定价政策评价及对我国的启示[J].价格理论与实践,2011,(6):77-78.
[10] 丁锦希.2017年国家医保药品准入谈判工作的若干思考[EB/OL]. (2017-07-19)[2018-4-10]. http://www.sohu.com/a/158295076_439958.
[11] 苏淑文,许军,向前,等.基于药品临床疗效的药价管理机制研究进展[J].卫生经济研究,2015,(6):38-41.
[12] 许军,夏聪,向前,等.基于药品价值的定价机制研究进展[J].中国卫生经济,2016,35(10):54-58.
[13] 张海涛.构建医保药品价格谈判机制的研究[J].价格理论与实践,2017,(10):52-55.

