外源糖处理对草莓果实品质和主要生物活性物质的影响
凌亚杰,莫 琴,莫 凡,葛 聪,罗 澍,罗 娅
(四川农业大学园艺学院,成都 611130)
草莓(Fragaria ananassa Duch.)是蔷薇科草莓属多年生草本植物,在世界小浆果生产中,草莓荣居首位[1]。此外,草莓果实营养丰富,味道鲜美,所含的鞣花单宁、花青素和原花青素等生物活性物质能预防心脑血管和癌症等慢性疾病的发生,因此倍受消费者青睐[2]。
随着生活水平的提高,消费者对果实品质,尤其是营养保健品质的追求越发明显。生物活性物质是具有生物活性的非营养元素的统称,具有抗氧化活性、抑菌、抗病毒、抗癌、降血脂、血糖以及预防心血管疾病等作用[3]。果实品质的形成以及生物活性物质的积累是一个非常复杂的生物学过程,品种、产地以及栽培技术均与之密切相关。糖是果实生长发育的物质基础,主要有蔗糖、果糖和葡萄糖3种形式,这3种糖的含量与比例直接决定了果实的品质[4]。在已有的研究中发现,外源蔗糖及三者(蔗糖、果糖和葡萄糖)的混合液处理均能促进萝卜幼苗花青素的积累和还原糖含量的增加[5]。此外,在红皮梨[6-7]和草莓[8-9]中也证实,外源蔗糖、果糖和葡萄糖处理能提高其果实糖和花青素的积累。草莓果实发育会经历小绿、大绿、白熟、1/4红,1/2红,3/4红和全红等7个时期,其中白熟期到全红期是草莓果实糖快速积累的时期。因此在草莓生产中,白熟期追肥可能是提高其果实品质的最佳时期[8,10]。目前在草莓上仅证实外源糖处理会促进草莓果实的成熟,提高花青素和糖含量,外源糖处理是否对草莓果实品质、总酚和抗氧化活性有积极作用还未见报道。鉴于此,本研究拟通过外源糖喷施白熟期草莓果实,探讨其对草莓果实品质和主要生物活性物质的影响,为发掘糖在生产中的潜在利用价值奠定基础。
1 材料和方法
1.1 材料
以“红颜”草莓(Fragaria ananassa Duch.cv.‘Bebihoppe’)为材料,取自四川省雅安市汉源县九襄镇罗博士生态草莓采摘园。
1.2 试验设计
选取植株健壮,大小及生长状态一致的白熟期(花后25 d)的草莓果实(大约200株,225个果),挂牌做好标记,分别用100 mmol/L蔗糖、100 mmol/L葡萄糖、100 mmol/L果糖、3种溶液等体积混合液(蔗糖∶果糖∶葡萄糖=1∶1∶1)和清水(对照)喷施草莓果实果面至滴水状,每个处理15个果,并于果实全红期采摘,立即运回实验室,然后进行果实品质、总酚与抗氧化活性的测定,实验重复3次。
1.3 测定的指标与方法
1.3.1 果实品质的测定
分别用电子天平、游标卡尺和Minolta色度计(美能达,大阪,日本)对草莓果实的单果重(g)、横纵径(cm)和色泽(L*、C*和 h0)进行测量,其中 L*表示果面颜色的亮度,值越小表示所测样品表面越暗,值越大则表示果实颜色越亮。C*值表示果面的色泽饱和度,h0则表示色调[7,11-12]。
1.3.2 果实可溶性固形物含量的测定
用手持测糖仪(Model No.PAL-1,日本爱拓有限公司)测定[11]。
1.3.3 果实抗坏血酸测定
采用钼蓝比色法测定[13]。称取约2.0 g的草莓样品,将其加入草酸-EDTA溶液中,研磨成匀浆后定容至100 mL,过滤。吸取20 mL溶液于50 mL容量瓶中,依次加入偏磷酸-醋酸、硫酸和钼酸铵,然后蒸馏水定容,15 min后测定其吸光度。
1.3.4 果实主要生物活性物质的测定
果实花青素含量测定采用pH示差法[14]。称取草莓粉末于离心管中,加入提取液,振荡后离心,取上清加入醋酸钠缓冲液或氯化钾缓冲液,摇匀,分别测定其在490 nm和655 nm下的吸光度,根据公式计算出花青素浓度。
总酚含量测定则参照福林-肖卡法[15]进行测定。称取0.2 g草莓粉末,加入3 mL丙酮溶液加入离心管内提取 1 h,离心,取上清12.5 μL,依次加入Na2CO3静置5 min,再加入体积比为50%的福林酚,使其充分反应,放入酶标仪中测定。
抗氧化性测定使用铁离子还原法(ferric reducing antioxidant potential assay,FRAP)进行测定[16-17]。取适量上清(必要时稀释),然后加入TPTZ工作液,混匀后37℃反应10 min。593 nm下测定吸光度,以1.0 mmol/L FeSO4为标准,样品抗氧化活性以达到同样吸光度所需的FeSO4的毫摩尔数表示。
1.4 统计分析方法
试验数据用Excel 2013整理,用SPSS 18.0软件进行LSD差异显著性分析。
2 结果与分析
2.1 外源糖处理对草莓单果重、横纵径及果形指数的影响
不同种类的糖处理对草莓果实单果重的影响差异较大。与对照相比,蔗糖能显著提高果实单果重约15.3%,而葡萄糖却显著降低了果实的单果重约7.6%,果糖和3种糖的等体积混合液处理与对照相比无显著差异(表1)。此外,与对照相比,除蔗糖处理显著提高了果实的纵径外,其他种类的糖处理对草莓果实的横纵径与果形指数均无显著性差异(表1)。由此说明,外源糖处理不会对草莓果实外观形态产生影响,且外源蔗糖处理还能显著提高果实的单果重。
2.2 外源糖处理对草莓色泽的影响
L*、C*、h0是反应果实表面色泽的几个关键指标。对照组果实的L*、C*、h0分别是35.32,53.12和28.18,而葡萄糖、果糖、蔗糖和3种糖的混合液处理后果实的 L*、C*、h0分别是 34.56、36.95、34.58 和35.36;51.10、52.64、50.44 和 49.93;28.29、29.46、27.12和29.30,与对照相比均无显著性差异(图1)。由此说明,外源糖处理并不会影响草莓果实的亮度、饱和度和色调。
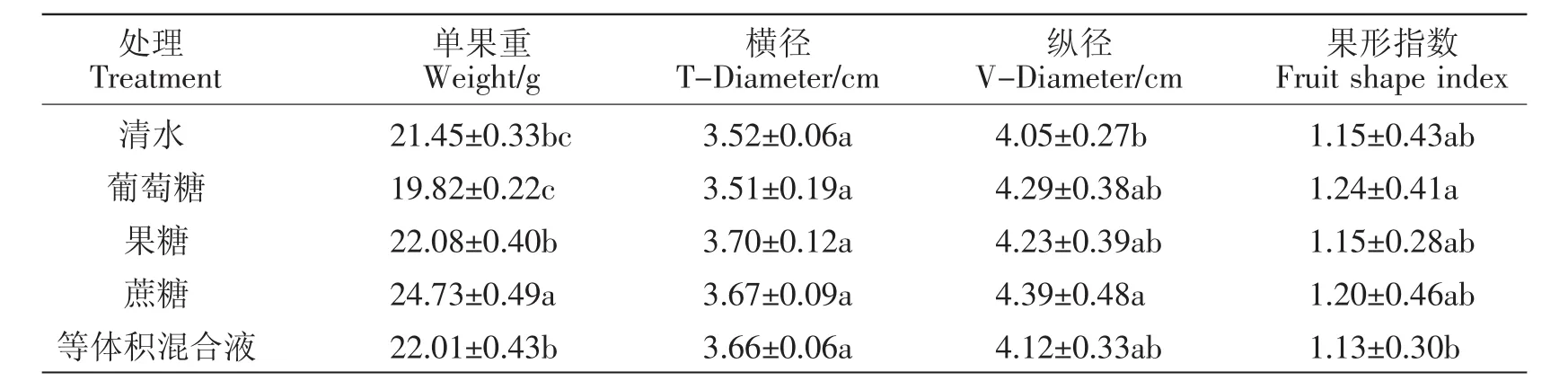
表1 外源糖处理对草莓果实单果重与果实形状的影响Table 1 Effects of exogenous sugar treatment on strawberry fruit weight and shape

图1 外源糖处理对草莓果实色泽的影响Figure 1 Effects of exogenous sugar treatment on strawberry fruit colour
2.3 外源糖处理对草莓可溶性固形物和抗坏血酸含量的影响
不同糖处理能显著影响草莓果实可溶性固形物和抗坏血酸含量。由图2(a)可知,与对照相比,果糖、蔗糖和等体积混合液处理后的草莓果实可溶性固形物含量分别是11.24%、11.4%和10.44%,分别显著高于对照组(9.25%)1.37%、1.77%和1.19%,而葡萄糖处理与对照相比则无显著性差异。由此说明蔗糖、果糖与等体积混合液处理能有效促进草莓果实可溶性固形物含量的增加。此外,等体积混合液、蔗糖和果糖处理后的草莓果实抗坏血酸含量分别为72.19、75.98和80.99 mg/100g,分别显著高于对照(67.89 mg/100 g)19.37%、11.98%和6.4%,而葡萄糖处理与对照相比则无显著性差异(图2(b))。
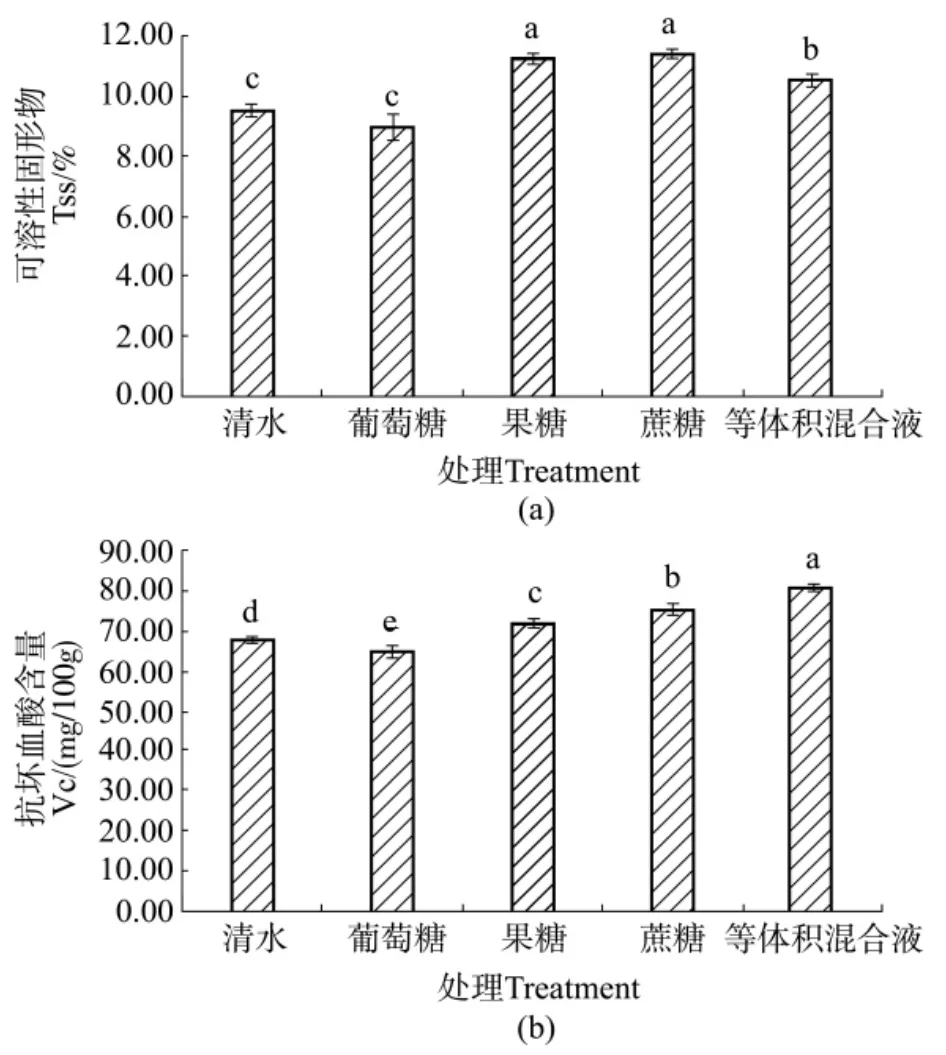
图2 外源糖处理对草莓果实可溶性固形物及抗坏血酸含量的影响Figure 2 Effects of exogenous sugar treatment on strawberry fruit?soluble solids and ascorbic acid content
2.4 外源糖处理对草莓果实中主要生物活性物质含量的影响
花青素是草莓果实中一种重要的生物活性物质,外源糖处理并不会影响草莓果实中的花青素含量(图3(a))。不同糖处理对草莓果实总酚含量影响较为显著,尤以葡萄糖处理对草莓果实总酚含量的增加效果最为明显,其总酚含量较对照提高了12.67%;其次是果糖、等体积混合液和蔗糖处理,草莓果实的总酚含量较对照分别提高了7.78%、3.98%和1.67%(图3(b))。除此之外,不同种类的糖处理也显著影响草莓果实的抗氧化能力。果糖、葡萄糖、等体积混合液和蔗糖处理后草莓果实的FRAP值分别是 1.9、1.83、1.76 和 1.62 mmol/L,比对照果实的FRAP 值(1.15 mmol/L)分别提高了 1.65、1.59、1.53和1.41倍,其中果糖效果最佳(图3(c))。

图3 外源糖处理对草莓果实中主要生物活性物质的影响Figure 3 Effects of exogenous sugar treatment on the main bioactive substances in strawberry fruit
3 讨论与小结
单果重、果形指数以及色泽均是反映果实外观品质的主要指标。单果重的增加意味着单位面积产量的增加,在一定程度上能提高生产者的经济效益。在本次实验中,外施蔗糖能显著增加草莓果实单果重。李月芳等[18-19]在青花菜和美国红枫上外施蔗糖也有类似的研究结果。果形指数是果实外观形状的直接反映,本研究发现外施糖处理并不会影响草莓果实的果形指数,原因可能是处理时期为白熟期,草莓果实大小与形状已基本形成,故喷施后不会改变其果形指数。色泽是草莓果实亮度、饱和度与色调的综合反映。在本次实验中,外源糖处理并不会影响草莓果实的色泽,这与张茜等[6]在红皮梨上外施蔗糖的研究结果并不一致,推测是基因型的差异所致。
可溶性固形物是草莓果实内在品质的一个重要指标,其含量会直接影响果实的甜度。外源糖处理通过影响糖合成和代谢相关的基因和酶活,进而影响果实中糖的积累[20]。在本次实验中,除葡萄糖外,蔗糖、果糖和等体混合液处理均能显著提高草莓果实的可溶性固形物含量,这与萝卜、红皮梨和“甜查理”草莓上的研究结果相一致[5-8]。抗坏血酸是一类重要的抗氧化物质,具有促进机体对铁的吸收,降低血液中的胆固醇,提高机体免疫力以及增加植物抗逆性等作用[21]。在本次实验中,等体积混合液、蔗糖和果糖处理均能显著提高草莓果实抗坏血酸含量。Li D.等[22]研究表明外施ABA会促进草莓果实中H2O2的积累,植物为了抵御H2O2产生的氧化胁迫从而积累更多的抗坏血酸。而Jia H.F.等[23]研究表明外施ABA会促进蔗糖、葡萄糖和果糖含量增加,间接表明糖含量的增加可能也会促进抗坏血酸含量的增加,这可能就是外源糖促进抗坏血酸含量增加的原因。
酚类物质是广泛存在于水果和蔬菜中的植物次生代谢产物,具有较好的抗氧化特性。A.Pirie等[24]研究表明外施蔗糖可以显著促进葡萄果实总酚含量的积累,这与本实验的研究结果相类似。随着草莓果实的成熟,其总酚含量逐渐降低[11,25],抗氧化能力也随之降低,且两者呈显著的正相关[26-27]。在本次实验中,外源糖处理在增加草莓果实总酚含量的同时也伴随着抗氧化能力的提高。此外,酚类物质中除了黄酮类的花色素为花青素类多酚,其他多酚都属于无色的非花青素酚类物质[28]。近年研究发现,花青素能够起到延缓衰老、护眼、软化血管和抗癌等积极的保健功能[29]。蔗糖是花青素的重要组成物质,外施蔗糖能通过增强花青素合成酶活性及花青素合成相关基因的表达从而提高植物花青素的含量,这在拟南芥与红皮梨上已得到证实[6-7,30-31]。有意思的是,贾海峰等[8-9]研究表明外源糖处理也能促进草莓果实花青素的积累,这与本次研究结果并不一致,推测原因主要是取材时间差异所致。外源蔗糖和葡萄糖处理能促进草莓果实成熟[9],若在糖处理后同一时间点取样进行草莓果实花青素含量的测定,势必会有处理后的果实花青素含量高于对照的研究结果,因为处理组草莓果实的成熟度更高。由于本次实验是分别将对照与处理后的材料在果实全红期采样并进行花青素含量的测定,因此并没有出现外源糖处理能增加草莓果实花青素含量的研究结果。根据上述结果作者认为,外施糖能加速草莓果实成熟和花青素的积累,但并不意味着会增加成熟草莓果实中的花青素终含量。
综上所述,外源糖处理并不会降低草莓果实的品质。综合考虑处理后果实品质的各项指标与主要的生物活性物质含量变化,认为100 mmol/L蔗糖溶液处理白熟期草莓对促进果实品质和增加其主要生物活性物质含量的效果最佳。
参考文献:
[1]郝保春.草莓生产技术大全[M].北京:中国农业出版社,2000:1-5.
[2]范雯谡,李影,韩立杰,等.干燥方法对山草莓生食的理化和感官特性的影响[J].食品科技,2012(11):62-66.
[3]刘小兵,朴建华.生物活性物质的抗氧化能力评价方法及其研究进展[J].中国食品卫生杂志,2008,20(5):440-444.
[4]柴叶茂,贾海锋,李春丽,等.草莓果实发育过程中糖代谢相关基因的表达分析[J].园艺学报,2011,38(4):637-643.
[5]贾晓琳.外源糖在心里美萝卜幼苗花青素代谢中作用初探[D].新乡:河南师范大学,2013.
[6]张茜,杨健,王龙,等.'红太阳'梨花青苷与可溶性糖的相关性分析及外源糖的增色作用研究[J].果树学报,2013,30(2):248-253.
[7]张茜.红皮梨果实着色与可溶性糖的关系和喷施外源糖的增色效果[D].南京:南京农业大学,2012.
[8]贾海峰.蔗糖及茉莉酸信号在草莓果实发育中的作用及其机理分析[D].北京:中国农业大学,2013.
[9]JIA H F,WANG Y H,Sun M Z,et al.Sucrose functions as a signal involved in the regulation of strawberry fruit development and ripening[J].New Phytologist,2013,198(2):453-465.
[10]韦海忠,戴晶晶,徐杏林,等.不同药剂和浓度对草莓糖度及硬度的影响[J].北方园艺,2009(11):16-20.
[11]Ornelas-Paz J D J,Yahia E M,Ramírez-Bustamante N,et al.Physical attributes and chemical composition of organic strawberry fruit(Fragaria x ananassa,Duch,Cv.Albion)at six stages of ripening[J].Food Chemistry,2013,138(1):372.
[12]MCGUIRE R G.Reporting of objective color measurements[J].Hort Science,1992,27(12):1254-1255.
[13]李军.钼蓝比色法测定还原型维生素C[J].食品科学,2000,21(8):42-45.
[14]刘仁道,张猛,李新贤.草莓和蓝莓果实花青素提取及定量方法的比较[J].园艺学报,2008,35(5):655-660.
[15]王华磊,冯建荣,樊新民,等.新疆17个杏品种的抗氧化指标与总酚含量的测定[J].果树学报,2008,25(6):828-831.
[16]张慧芸,孔保华.两种方法测定香辛料提取物抗氧化活性的比较[J].食品科学,2009,29(11):41-44.
[17]郭长江,杨继军,李云峰,等.FRAP法测定水果不同部分抗氧化活性[J].中国公共卫生,2003,19(7):841-843.
[18]李月芳,于锡宏.外源蔗糖对青花菜体内碳,氮代谢的影响[J].东北农业大学学报,2007,38(2):166-169.
[19]李玉娟,张健,李敏,等.蔗糖和不同外源激素处理对美国红枫色叶的影响[J].广西农学报,2009,24(6):27-28.
[20]李改玲.外源糖调控盐胁迫下小黑麦糖代谢及光合特性的研究[D].哈尔滨:东北农业大学,2016.
[21]邹礼平.番茄抗坏血酸生物合成与代谢途径中相关酶基因的克隆与调控[D].武汉:华中农业大学,2005.
[22]LI D,LI L,LUO Z,et al.Comparative Transcriptome Analysis Reveals the Influence of Abscisic Acid on the Metabolism of Pigments,Ascorbic Acid and Folic Acid during Strawberry Fruit Ripening[J].Plos One,2015,10(6):1-15.
[23]JIA H F,CHAI Y M,LI C L,et al.Abscisic Acid Plays an Important Role in the Regulation of Strawberry Fruit Ripening[J].Plant Physiology,2011,157(1):188.
[24]PIRIE A MULLINS M G.Changes in Anthocyanin and Phenolics Content of Grapevine Leaf and Fruit Tissues Treated with Sucrose,Nitrate,and Abscisic Acid [J].Plant Physiology,1976,58(4):468-472.
[25]Ferreyra R M,Vi?a S Z,Mugridge A,et al.Growth and ripening season effects on antioxidant capacity of strawberry cultivar Selva[J].Scientia Horticulturae,2007,112(1):27-32.
[26]张豫超,谢鸣,陈俊伟,等.不同采收期草莓果实抗氧化物质含量和抗氧化活性的变化[J].浙江农业学报,2009,21(3):250-254.
[27]罗娅.5个费约果品种果实多酚类物质含量及其抗氧化能力比较[J].食品科学,2014,35(23):88-91.
[28]李妍,刘吉平,肖更生,等.浆果非花青素酚类物质的研究进展[J].农产品加工·学刊,2008(2):4-8.
[29]孔祥强.谈蓝莓中花青素的保健功能[J].现代农业科技,2009,(15):130.
[30]ELENA L,GIOVANNI P,NOVI G,et al.Gibberellins,jasmonate and abscisic acid modulate the sucrose-induced expression of anthocyanin biosynthetic genes in Arabidopsis[J].New Phytologist,2008,179(4):1004-16.
[31]QIU Z B,WANG Y F,ZHU A J,et al.Exogenous sucrose can enhance tolerance of Arabidopsis thaliana,seedlings to salt stress[J].Biologia Plantarum,2014,58(4):611-617.

