Pb、Cd和酸胁迫对枫香种子萌发、幼苗生长及体内抗氧化酶活性的影响
陈顺钰 ,韩 航 ,薛凌云 ,张 韵 ,侯晓龙 ,2,3*,蔡丽平 ,2,周垂帆 ,2
(1.福建农林大学林学院,福州 350002;2.海峡两岸红壤区水土保持协同创新中心,福州 350002;3.福建农林大学资源与环境学院,福州 350002)
稀土矿的低水平开采和选别产生大面积废弃地,不但使土壤结构遭到破坏,引起植被破坏、水土流失,同时还造成土壤酸化、重金属污染[1]。目前,矿山废弃地生态修复成为国内外亟需解决的重大环境问题[2]。福建长汀属离子型稀土矿区,其重金属污染物主要为Pb、Cd,王友生等[3]研究表明,Pb在原地浸废弃地、周边未开采地达中度污染水平,在取土场达轻度污染水平,废弃堆浸池达重度污染水平;Cd在原地浸废弃地、取土场、废弃堆浸池的质量比分别为福建省土壤背景值的141、97、69倍,4个采样区土壤Cd均达重度污染水平,综合潜在生态风险指数达极重污染水平;此外,开采过程中使用大量的硫酸铵进行就地淋浸,导致土壤酸化,pH值相对背景值降低了0.23个单位。
近年来,植物修复技术备受关注,植物通过根部吸收或萃取污染土壤中重金属而使重金属原位固定化和隔离化,该技术具有安全经济、绿色环保等优点[4-5]。种子萌发是植物对环境胁迫较为敏感的时期之一,作为植物生命过程的开始阶段,种子萌发能力及幼苗发育过程直接影响植物修复的效果[6]。因此通过研究在胁迫条件下种子萌发及幼苗生长的特性,可以在一定程度上反映植物对胁迫的耐性。冯宏等[7]研究重金属和pH值对类芦种子萌发的影响,发现在强酸性到强碱性条件下类芦都能够保持较高的萌发能力,不同重金属对类芦种子产生明显抑制作用的浓度不同,且类芦幼苗生长比种子萌发对重金属离子更加敏感。不同类型矿山废弃地植被恢复限制因子不同,主要包括地表结构稳定性差、养分缺失、极端酸碱度、重金属含量过高及有机污染等方面[8]。例如,辽西金属矿山废弃地存在表土层破坏、营养元素缺乏、重金属污染等限制植被恢复的因素[9]。贵州山区煤矿废弃地限制植被生长的主要因子为土壤pH值普遍较低、有效态N、P、K含量普遍较低、土壤中重金属Cu、Zn、Pb、Cd为中度污染水平[10]。因此,不同污染区的植被治理模式也存在差异。
王友生等[11]研究发现有“荒山先锋”树种之称的枫香(Liquidambar formosana Hance)可在长汀稀土矿废弃地正常生长,其可能存在特殊的形态生理适应机制,并已成为长汀植被恢复的主要树种之一。该研究表明“宽叶雀稗+胡枝子+木荷+枫香+山杜英”模式的肥力指数达0.544,是长汀稀土矿取土场较好的植被恢复模式。当前已有少数学者就枫香种子形状特征、温度和时间对种子萌发的影响进行了研究[12-14],但重金属及酸胁迫对枫香种子的萌发和生理特性的影响尚不清楚。
鉴于此,以枫香为研究对象,设置不同梯度Pb、Cd浓度和pH值试验,测定种子萌发、幼苗生长的形态指标及抗氧化指标,探讨重金属Pb、Cd及酸胁迫条件下枫香种子萌发和幼苗生长过程的形态和生理响应机制,以期为酸性废弃矿地和重金属污染地土壤植被恢复提供科学依据。
1 材料与方法
1.1 试验材料
供试的枫香种子采购自江西省九江县林木种苗公司,存储于4℃冰箱。选用籽粒饱满、坚实、种壳乌亮的枫香种子,用0.3%高锰酸钾溶液消毒浸泡30 min后,超纯水冲洗6遍,然后用超纯水浸泡24 h,除去漂浮的劣质种子,余下的种子用滤纸吸干表面的水分,用于胁迫试验。
1.2 试验设计
根据稀土矿废弃地土壤酸化及重金属污染程度,设置 pH 值及 Pb、Cd 浓度[3,15-17],Cd 胁迫采用分析纯(CH3COO)2Cd·3H2O 配制,浓度分别为 0(以去离子水对照)、25、50、100 mg·L-1,记作 Cd-CK、Cd-25、Cd-50、Cd-100;Pb胁迫采用分析纯(CH3COO)2Pb配制,浓度为 0(去离子水对照)、250、500、1000 mg·L-1记作Pb-CK、Pb-250、Pb-500、Pb-1000;pH 调节采用CH3COOH,分别为 3.5,4.5,5.5,CK(去离子水对照),记作 pH-3.5、pH-4.5、pH-5.5、pH-CK。
1.3 试验条件及过程
种子萌发试验于福建农林大学林学院实验室内人工气候箱中进行。培养条件为温度25℃、空气相对湿度70%、光照14 h黑暗10 h、光强100%(RXZ-160A智能型人工气候箱,宁波江南仪器厂)。铺有两张滤纸的直径9 cm的玻璃培养皿,经过高温灭菌处理,分别加5 mL各设置浓度的Cd、Pb和酸溶液,每个培养皿50粒种子,每个胁迫浓度6个重复,其中3个重复用于测定形态学指标,另外3个重复用于测定生理指标。每日添加少量纯水,保持滤纸湿润。每日观察记录种子萌发情况。
1.4 测定指标与方法
1.4.1 发芽指标及形态学指标测定
从种子置床之日起每日对发芽情况进行统计记录,以种子胚根长度达到种子长度的一半作为发芽标准,每日12点对种子发芽数进行统计。连续3 d发芽种子数不足供试种子的1%则发芽结束。处理后第6 d统计发芽势,第10 d发芽结束并统计发芽率,从用于测形态学指标的各浓度培养皿中取出20株长势一致的幼苗,用游标卡尺测量幼苗地上部及根长;用电子天平分别称幼苗的地上部与根鲜重,再置于烘箱105℃杀青30 min,80℃烘干至恒重,称各部分干重。
(1)发芽率=萌发种子数/种子总数×100%
(2)发芽指数=ΣGt/Dt(Gt指在t时间内萌发数,Dt为相应的萌发天数)
(3)发芽势=发芽高峰期发芽的种子数/种子总数×100%
(4)活力指数=发芽指数×苗长度
(5)根伸长抑制率=(对照组根长-处理组根长)/对照组根长×100%
(6)地上部伸长抑制率=(对照组地上部长-处理组地上部长)/对照组地上部长×100%
1.4.2 生理指标测定
发芽第4、7、10 d,从用于测生理指标的各浓度培养皿中取出0.2 g发芽种子,于冰浴中的研钵内研磨成匀浆,加入4 mL pH 7.8的磷酸缓冲液于离心管中,于 4℃下 10 000 r·min-1冷冻离心 20 min,取上清液立即放入4℃冰箱储存待测。参考王学奎[18]的方法,采用硫代巴比妥酸法测定丙二醛(MDA)含量,紫外吸收法测种子过氧化氢酶(CAT)活性,愈创木酚法测定过氧化物酶(POD)活性,氮蓝四唑光化还原法测定超氧化物岐化酶(SOD)活性,用多功能酶标仪(IPBPinite M200 PRO,瑞士)测定各样品的吸光度值。
1.5 数据分析
试验数据收集整理后,用SPSS 19.0进行统计分析,用Origin 9.0作图,图表中数据用平均值±标准差(n=3)表示。采用单因子方差分析(One-way ANOVA)和多重比较法进行统计分析,用Tukey-HSD法对数据进行差异显著性分析。
2 结果与分析
2.1 Pb、Cd、酸胁迫对枫香种子萌发的影响
由表1可得,不同浓度Pb、Cd和酸胁迫处理下枫香种子发芽率均较高,在80%~93.3%之间,不同Pb、Cd处理下发芽率并无显著差异(P>0.05),pH-3.5胁迫下发芽率与发芽势相比对照组显著降低(P<0.05)。就发芽指数而言,Pb处理组差异不显著,随着Cd胁迫浓度的增加发芽指数呈递减趋势,而酸处理下随pH减小呈先增后减再增趋势,除Cd-100显著低于对照外,其他处理均无显著差异,说明枫香种子在3种胁迫条件下萌发速度相对一致。对照组的活力指数显著高于重金属Pb、Cd胁迫下的各浓度活力指数(P<0.05),pH-3.5条件下的活力指数显著低于对照及其他两组处理的活力指数。由此可见,在重金属Pb、Cd胁迫下,发芽率虽然差异不明显,活力指数却受到明显抑制,强酸条件(pH-3.5)对枫香种子萌发具有一定的抑制作用。
2.2 Pb、Cd和酸胁迫对枫香种子幼苗的影响
枫香幼苗对不同类型的胁迫处理响应不同。随重金属Pb、Cd的浓度增加,出现不同程度的毒害效应,如图1所示,在Pb、Cd胁迫下发芽第10 d的枫香幼苗芽苗幼小,主根变短甚至出现“无根苗”等发育不良现象。处理组的根长均显著低于对照组(P<0.05),且随重金属胁迫浓度的增加,根长呈下降趋势,各Pb、Cd胁迫组的地上部长均显著高于根长(图2)。采用多项式曲线拟合,伸长抑制率回归方程如表2所示,重金属浓度与抑制率呈正相关,胁迫浓度越大抑制率越高。根达到80%~95%的抑制率,地上部达到9%~43%的抑制率。Pb-1000处理,地上部鲜重、根鲜/干重都显著低于对照(P<0.05)(图 3)。Cd-100 处理,地上部鲜重、根鲜/干重显著低于对照(P<0.05)。由此可见,重金属胁迫对枫香幼苗的生长发育有抑制作用,甚至产生毒害。

表1 不同胁迫处理对枫香种子萌发的影响Table 1 Seed germination of Liquidambar formosana under different treatments

图1 发芽第10 d不同处理下的枫香幼苗Figure 1 Liquidambar formosana seedlings growth at tenth day with different treatments
弱酸环境(pH-5.5、pH-4.5)提高了发芽指数,对枫香种子萌发有促进作用,同样,pH-5.5处理促进了枫香幼苗根系的生长(图1、图2),根长高于对照,而该pH条件下,地上部受到抑制,抑制率为6.5%。随pH减小根及地上部的抑制率均呈先减后增趋势(表2),pH-3.5处理,根、地上部抑制率达 84.35%、25.76%,地上部长、根和地上部的鲜重以及根的干重均显著低于其他组(图2、图3)。由此可见,强酸会抑制枫香幼苗的生长。
2.3 种子萌发过程中抗氧化酶活性的变化
随Pb浓度的增加(表3),发芽第4 d时SOD活性Pb-250处理显著高于对照,SOD呈递减趋势,POD活性 Pb-1000处理显著高于对照(P<0.05);第 10 d的POD活性各组差异显著并呈递增趋势,SOD活性升高,但各组差异并不显著。第4、7 d CAT活性均随胁迫浓度的增加而呈先增后减再增趋势,均在Pb-1000达最大值且显著高于其余胁迫浓度(P<0.05),说明高浓度的Pb胁迫对枫香CAT活性有显著促进作用。

表2 根和地上部的伸长抑制率回归方程Table 2 The regression equation for inhibition rate of root and aboveground

图3 不同胁迫处理对枫香幼苗生物量的影响Figure 3 Effects of different treatments on biomass of Liquidambar formosana
随时间的变化,对照组及处理组中CAT活性均随萌发时间的增加呈先减后增趋势,对照第0 d种子CAT活性均显著高于萌发各时间段(P<0.05)。SOD活性均呈先降低后增加的趋势,但各组差异并不显著。除Pb-1000处理外,POD活性随种子萌发代谢的加强而下降。此外,发芽结束后各处理条件下未萌发种子之间的SOD、POD、CAT活性无显著差异,且3种抗氧化酶活性均显著低于对照种子。
随Cd浓度的增加(表4),发芽第4 d时胁迫组SOD、CAT活性显著高于对照(P<0.05),POD 活性呈下降趋势;发芽第7、10 d的POD活性增强,并在Cd-100时显著高于其余胁迫组,可见发芽后期高浓度的Cd胁迫可促进POD活性增强。第10 d时Cd-50的CAT活性显著高于对照组(P<0.05),其他时间段CAT随胁迫浓度的增加而增加,但差异不显著。
枫香种子在萌发过程中,CAT活性在Cd-50处理下各萌发阶段间差异显著(P<0.05),对照及处理组的CAT、SOD活力均呈现出随时间变化先降后升的趋势。其中Cd-100、Cd-50的SOD活性在第4 d时显著低于萌发过程其余各阶段,说明在高浓度Cd胁迫下种子萌发初期SOD活性受到抑制,但随时间的增加萌发代谢增强,SOD活性上升。对照及处理组的POD活性在第10 d显著降低并达最小值(P<0.05)。未萌发种子SOD、POD、CAT活性显著低于对照第0 d种子,分别降低了43.11%~48.21%、66.44%~68.72%、77.44%~79.09%。
由表5所示,pH值减小过程中,发芽第4 d时SOD活性呈现先增后减的趋势,pH-4.5处理组SOD活性显著高于对照;POD活性呈先降低后升高趋势,pH-5.5处理与对照相比显著降低。第10 d时pH-5.5处理的SOD活性显著低于对照,POD活性却显著增加(P<0.05)。第4 d的pH-4.5处理组和第10 d的pH-3.5处理组CAT活性均显著低于对照(P<0.05)。
随时间变化,pH-3.5处理POD活性呈先增后减趋势,第 7 d的 POD 活性显著高于第 0 d(P<0.05),表明在强酸条件下萌发初中期的枫香种子为了适应逆境胁迫,POD逐渐上升,提高了清除过氧化物的能力,至第7 d达最大值后快速下降了78.15%。CAT活性在pH-5.5及pH-4.5处理下发芽过程中各时段差异显著(P<0.05),且所有pH处理组在萌发过程中CAT活性均呈现先降低后升高的趋势,说明在萌发初中期CAT活性受到抑制,后期(10 d)CAT活性略有增加。2.4 Pb、Cd、酸胁迫对枫香种子萌发过程中MDA含量变化

表3 Pb胁迫下枫香种子萌发过程中抗氧化酶活性的变化Table 3 Changes of antioxidant enzyme activities during seed germination in different Pb treatments of Liquidambar formosana

表4 Cd胁迫下枫香种子萌发过程中抗氧化酶活性的变化Table 4 Changes of antioxidant enzyme activities during seed germination in different Cd treatments of Liquidambar formosana
由表6可以看出,在第4、10 d的Pb-1000处理组MDA含量显著高于同时间内不同Pb处理,表明在高浓度Pb胁迫下膜脂过氧化严重。随Cd浓度增加MDA含量整体增加,其中Cd-100处理组的MDA含量显著高于对照(P<0.05)。随pH值减小MDA含量均呈递增趋势,其中pH-3.5处理组MDA含量在第7、10 d显著增加,说明强酸条件一定程度上破坏了枫香种子的膜系统。
重金属Pb、Cd及酸的胁迫程度越大,枫香体内的MDA含量越多,随发芽时间的延长MDA含量逐渐增多,对照种子显著低于胁迫组,未萌发种子MDA含量均是所有组中最大的,可能是由于未发芽种子膜脂过氧化严重、膜系统遭到严重损坏,这可能也是导致种子不能萌发的原因之一。
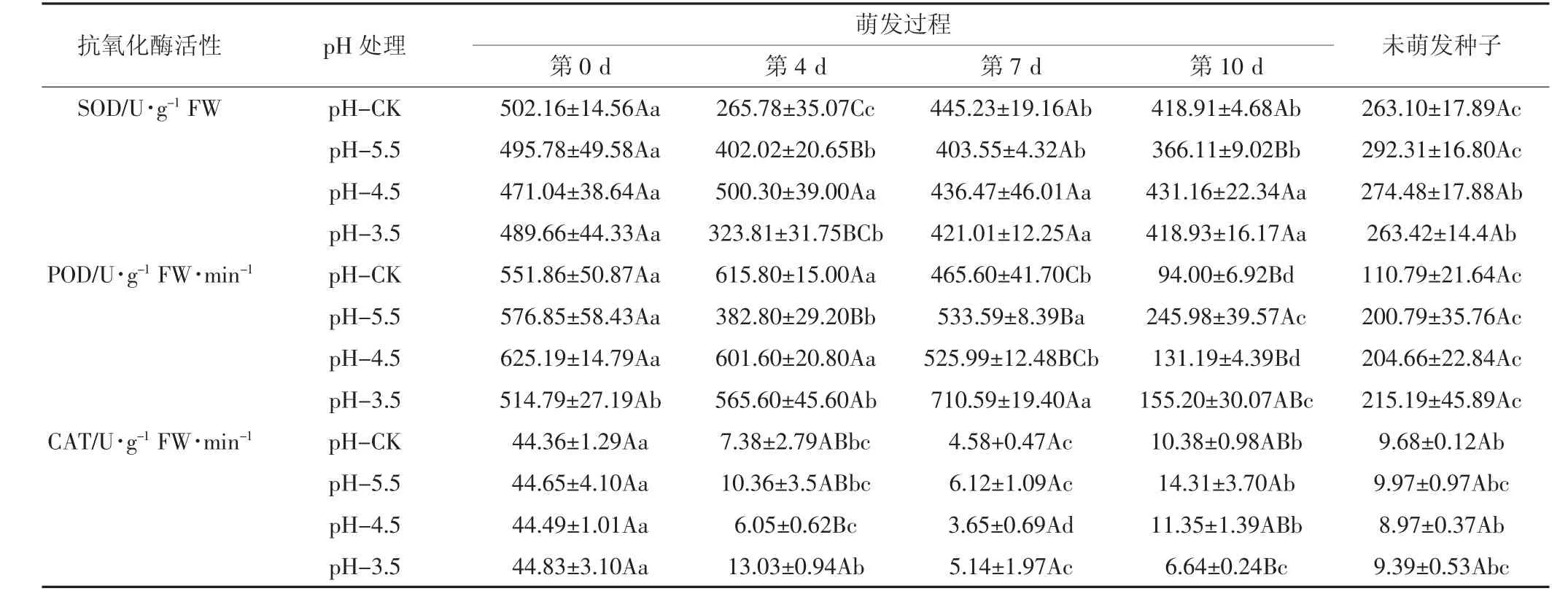
表5 pH胁迫下枫香种子萌发过程中抗氧化酶活性的变化Table 5 Changes of antioxidant enzyme activities during seed germination in different pH treatments of Liquidambar formosana

表6 不同处理下枫香种子萌发过程中MDA含量的变化(μmol·g-1)Table 6 Changes of MDA content during seed germination in different treatments of Liquidambar formosana(μmol·g-1)
3 讨论
土壤酸化及重金属污染是植物生长的限制因子,土壤环境过酸会影响植物正常的营养代谢、光合作用和呼吸作用,甚至导致植物萎黄枯死[19]。当植物受到重金属胁迫时,出现生长缓慢、生物量降低、植株矮小、根系生长受到抑制等现象,严重时导致死亡[20]。种子萌发及幼苗生长作为植物生命周期的开始阶段,在逆境胁迫下能够表现出一定程度的耐性。本试验中Pb、Cd处理对枫香种子发芽率无显著影响,发芽率达80%~88%。pH-3.5对枫香种子发芽率、发芽势具有显著的抑制作用。在Cd胁迫下发芽指数呈递减趋势,而酸处理下呈先增后减再增趋势,种子活力指数在两种重金属胁迫下受到显著的抑制作用,pH-4.5处理发芽指数和活力指数及pH-5.5处理的发芽指数略高于对照。
相对种子萌发,Pb和Cd均对枫香幼苗产生显著的毒害效应,幼苗出现发育不良,主根变短等现象。陈俊任等[21]对毛竹种子在重金属胁迫下的萌发研究中发现,重金属对幼苗根的毒害明显强于对芽的毒害。本研究中出现的“无根苗”现象及各组芽长显著高于根长都与前人研究[21]成果一致,主要原因可能在于枫香幼苗根系直接与重金属环境接触,最先受到重金属毒害,从而根的生长受到明显抑制(根伸长抑制率达80%~95%)。高浓度的Pb、Cd胁迫下芽根的鲜质量和干质量均显著低于对照,由此可见幼苗生长和种子萌发这两个阶段的生理代谢对Pb、Cd响应存在差异。pH-5.5对枫香幼苗根系的生长有刺激效应,根长高于对照,而对地上部生长有抑制作用,抑制率为6.5%。pH-3.5时芽长、根和芽的鲜质量以及根的干质量均显著低于对照,抑制了枫香幼苗的生长。
在逆境胁迫下的植物细胞存在着自由基的产生和消除这两个过程,只有抗氧化酶系统CAT、POD、SOD三者协调一致,才能使生物自由基维持在较低水平,从而防止被自由基毒害[22]。杨颖丽等[23]发现在小麦种子萌发过程中,Cd胁迫诱导CAT、POD和APX活性升高,小麦叶片在Cd胁迫下可通过提高抗氧化酶的活性来清除产生的H2O2、降低膜脂过氧化损害。本研究中在Pb胁迫下,各时间段CAT、POD、SOD活性呈现出不一致的变化趋势。随时间的延长,SOD、CAT活性先减后增,POD活性降低,在同时间段随Pb胁迫浓度的增加,SOD活性、第10 d POD活性、第4、7 d CAT活性均呈多项式变化,表现为“升高-降低-升高”的趋势,清除活性氧来保护植物细胞免受活性氧的损伤,这与前人研究[23]结果一致。陈伟[24]在研究重金属胁迫对草坪草生长发育及生理特性的影响中发现,重金属胁迫对草地早熟禾抗氧化酶活性影响较大,随Pb、Cd浓度增加,SOD、POD活性升高。枫香种子随Cd浓度增加显著提高SOD和CAT活性,发芽初期(4 d)POD 受到抑制,中后期(7、10 d)随胁迫加强显著升高。随时间的延长POD活性受到抑制、SOD和CAT活性先增后减,以此来达到酶之间的平衡比。例如,紫萼玉簪种子和幼苗对酸雨与Cd复合污染的生理生态响应过程[25]中,在单一酸雨胁迫下CAT、SOD、POD活性变化趋势相似,均增高,不同的是当pH-4.5时CAT活性显著增高,说明CAT与SOD、POD相比对酸的敏感性更高。从本试验结果可以看出,随pH减小,第7 d的POD活性及第10 d的POD、CAT活性显著增加,随时间增加,pH-3.5处理下POD活性最高峰值出现在第7 d,与对照第0 d种子相比具有显著差异(P<0.05),并呈先增后减趋势,表明在强酸条件下萌发初期的枫香种子为了适应逆境胁迫POD活性逐渐上升,提高了清除过氧化物的能力。枫香种子在萌发过程中三种酶活性相互协调,使得枫香自由基维持在较低水平状态,这可能是枫香种子能在重金属和酸污染的长汀稀土矿废弃地萌发的原因之一。未萌发种子的POD、SOD、CAT活性均显著降低,重金属及酸逆境胁迫下,枫香未萌发种子对活性氧的清除能力下降,使活性氧的产生速率超过抗氧化酶系统的清除能力。
MDA是膜脂质过氧化产物之一,其含量大小对生物体过氧化强度和膜系统受损程度具有重要指示作用[22]。在3种胁迫条件下MDA含量均随处理强度的升高而增加,在枫香萌发过程中MDA的积累与胁迫强度呈正相关。其中未发芽的种子MDA含量显著高于对照种子及其他处理组,这说明枫香种子体内活性氧产生和清除的平衡受到破坏,而有利于体内活性氧的产生,所积累的活性氧引发了膜脂过氧化,所以MDA含量高度积累,这与前人的研究[23-25]结果相一致。本试验仅探讨了酸、Pb、Cd单独胁迫下枫香种子的萌发及幼苗的生长,对酸和重金属复合胁迫,特别是成年植株的抗逆解毒机理、富集规律、分子水平及细胞结构上的影响,还有待进一步深入研究。
4 结论
(1)Pb、Cd处理对枫香种子发芽率无显著影响,但对幼苗根长具有显著的抑制效应,出现“无根苗”现象;pH-5.5、pH-4.5对枫香种子萌发、幼苗的生长有促进作用,pH-3.5则有抑制作用。
(2)CAT活性变化是枫香种子响应Pb、Cd和酸3种胁迫的主要策略;SOD在枫香种子适应Cd胁迫、POD在枫香种子适应Pb和酸胁迫的一定阶段也发挥了重要作用。在枫香萌发过程中MDA的积累与胁迫浓度呈正相关。
参考文献:
[1]苏文湫,祝怡斌.赣州稀土矿山废弃地土壤重金属污染现状评价[J].有色金属,2016,68(4):81-85.SU Wen-qiu,ZHU Yi-bin.Valuation of the soil heavy metal pollution in Ganzhou rare earth mine wasteland[J].Nonferrous Metals,2016,68(4):81-85.
[2]关军洪,郝培尧,董 丽,等.矿山废弃地生态修复研究进展[J].生态科学,2017,36(2):193-200.GUAN Jun-hong,HAO Pei-yao,DONG Li,et al.Review on ecological restoration of mine wasteland[J].Ecological Science,2017,36(2):193-200.
[3]王友生,侯晓龙,吴鹏飞,等.长汀稀土矿废弃地土壤重金属污染特征及其评价[J].安全与环境学报,2014,14(4):259-262.WANG You-sheng,HOU Xiao-long,WU Peng-fei,et al.Analysis of the characteristics and the evaluation of heavy metal pollutions in the deserted land-area left-over by the rare earth mining in Changting,Fujian[J].Journal of Safety and Environment,2014,14(4):259-262.
[4]董文洪,杨 海,令狐文生.等.土壤重金属污染及修复技术研究进展[J].化学试剂,2016,38(12):1170-1174.DONG Wen-hong,YANG Hai,LINGHU Wen-sheng,et al.Current progress on remediation of heavy metal contaminated soil[J].Chemical Reagents,2016,38(12):1170-1174.
[5]Insook L,Kyunghwa B,Hyunhee K,et al.Phytoremediation of soil cocontaminated with heavy metals and TNT using four plant species[J].Journal of Environmental Science and Health,2007,42(3):2039-2045.
[6]Zhang D P,Cai C J,Fan S H,et al.Effects of Pb2+,Cd2+on germination and seedling early growth of Moso bamboo(Phyllostachys edulis)seed[J].Forest Research,2012,25(4):500-504.
[7]冯 宏,戴 军,李永涛,等.重金属和pH值对类芦种子萌发的影响[J].水土保持通报,2010,30(6):96-99.FENG Hong,DAI Jun,LI Yong-tao,et al.Effects of heavy metals and pH value on seed germination of Burma reed[J].Bulletin of Soil and Water Conservation,2010,30(6):96-99.
[8]闫德民.我国矿山废弃地生态恢复限制因素及恢复策略[J].林业调查规划,2015,40(4):83-87.YAN De-min.Limiting factor and restoration strategy of ecological restoration in abandoned mine-area of China[J].Forest Inventory and Planning,2015,40(4):83-87.
[9]孔祥南.辽西金属矿山废弃地生态恢复与可持续技术研究[D].大连:大连工业大学,2015.KONG Xiang-nan.Study on the ecological restoration and sustainable technology for the wasteland of the metal mines in western Liaoning Province[D].Dalian:Dalian Polytechnic University,2015.
[10]李榜江.贵州山区煤矿废弃地重金属污染评价及优势植物修复效应研究[D].重庆:西南大学,2014.LI Bang-jiang.Evaluation of heavy metal contaminated soil and the effect of dominant plants remediation in mining wasteland in Guizhou mountain district[D].Chongqing:Southwest University,2014.
[11]王友生,吴鹏飞,侯晓龙,等.稀土矿废弃地不同植被恢复模式对土壤肥力的影响[J].生态环境学报,2015,24(11):1831-1836.WANG You-sheng,WU Peng-fei,HOU Xiao-long,et al.Effect of different revegetation model on soil properties in abandon mine area of rare earth[J].Ecology and Environmental Sciences,2015,24(11):1831-1836.
[12]韦美华.不同播种时间对枫香种子萌发特性的影响[J].福建农业科技,2016,12(2):31-33.WEI Mei-hua.Effects of different sowing time on seed germination characteristics of Liquidambar formosana[J].Fujian Agricultural Science and Technology,2016,12(2):31-33.
[13]刘 就,刘和平,陈考科,等.不同枫香种子性状研究进展[J].福建林业科技,2007,34(2):190-192.LIU Jiu,LIU He-ping,CHEN Kao-ke,et al.The research progress on the seed character of Liquidambar formosana[J].Fujian Forestry Technology,2007,34(2):190-192.
[14]王满莲,文香英,韦 霄,等.温度对3种金缕梅科植物种子萌发特性的影响[J].种子,2016,35(10):79-83.WANG Man-lian,WEN Xiang-ying,WEI Xiao,et al.Effects of temperatutre on seed germination of three species of Hamamelidaceae[J].Seeds,2016,35(10):79-83.
[15]滕 达,苏庆平,顾 秋,等.稀土尾矿区10种植物对重金属的吸收与富集作用[J].安徽农业科学,2009,37(2):798-799,804.TENG Da,SU Qing-ping,GU Qiu,et al.Absorption and enrichment of 10 plants to heavy metal in rare earth tailing area[J].Journal of Anhui Agricultural Sciences,2009,37(2):798-799,804.
[16]刘胜洪,张雅君,杨妙贤,等.稀土尾矿区土壤重金属污染与优势植物累积特征[J].生态环境学报,2014,23(6):1042-1045.LIU Sheng-hong,ZHANG Ya-jun,YANG Miao-xian,et al.Heavy metal contamination of soil and concentration of dominant plants in rare earth mine tailing area[J].Ecology and Environmental Sciences,2014,23(6):1042-1045.
[17]许亚夫,李银保,陈海花.定南县废弃稀土矿区土壤中重金属元素Pb、Cr和 Cu 的测定[J].广东微量元素科学,2012,19(10):10-14.XU Ya-fu,LI Yin-bao,CHEN Hai-hua.Determination of the content of heavy metal elements Pb,Cr and Cu in soil from abandoned rare earth mine in Dingnan County[J].Guangdong Trace Elements Science,2012,19(10):10-14.
[18]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.WANG Xue-kui.Principle and technology of plant physiology and biochemistry experiment[M].Beijing:Higher Education Press,2006.
[19]陈雪娇,韩 航,侯晓龙,等.水土保持植物类芦对土壤酸胁迫的形态生理响应[J].草业学报,2017,26(4):143-149.CHEN Xue-jiao,HAN Hang,HOU Xiao-long,et al.The morphological and physiological responses of the soil and water conservation plant Neyraudia reynaudiana to acid stress[J].Acta Prataculturae Sinica,2017,26(4):143-149.
[20]文晓慧.重金属胁迫对植物的毒害作用[J].农业灾害研究,2012,2(11/12):20-21.WEN Xiao-hui.Toxic effect of heavy metal stress on plant[J].Journal of Agricultural Catastrophology,2012,2(11/12):20-21.
[21]陈俊任,柳 丹,吴家森,等.重金属胁迫对毛竹种子萌发及其富集效应的影响[J].生态学报,2014,34(22):6500-6509.CHEN Jun-ren,LIU Dan,WU Jia-sen,et al.Seed germination and metal accumulation of Moso bamboo(Phyllostachys pubescens)under heavy metal exposure[J].Acta Ecologica Sinica,2014,34(22):6500-6509.
[22]张金彪.黄维南.镉对植物的生理生态效应的研究进展[J].生态学报,2000,20(33):514-523.ZHANG Jin-biao,HUANG Wei-nan.Advances on physiological and ecological effects of cadmium on plants[J].Acta Ecologica Sinica,2000,20(33):514-523.
[23]杨颖丽,王文瑞,尤 佳,等.Cd2+胁迫对小麦种子萌发、幼苗生长及生理生化特性的影响[J].西北师范大学学报,2012,48(3):88-95.YANG Ying-li,WANG Wen-rui,YOU Jia,et al.Effects of cadmium stress on the germination,growth of seedling and physiological and biochemical characters of wheat[J].Journal of Northwest Normal University,2012,48(3):88-95.
[24]陈 伟.重金属胁迫对草坪草生长发育及生理特性的影响[D].兰州:甘肃农业大学,2014.CHEN Wei.Effect of heavy metal stress on growth and physiological of turf plants[D].Lanzhou:Gansu Agricultural University,2014.
[25]罗良旭,高素萍,王成聪,等.紫萼玉簪种子和幼苗对酸雨与镉复合污染的生理生态响应[J].浙江大学学报,2017,43(2):192-200.LUO Liang-xu,GAO Su-ping,WANG Cheng-cong,et al.Physio-ecological responses of seeds and seedlings of Hosta ventricosa to combined pollution of simulated acid rain and cadmium[J].Journal of Zhejiang University,2017,43(2):192-202.

