UV-B辐射与稻瘟病菌复合胁迫对元阳梯田水稻生长和光合特性的影响
李 想,谢春梅,何永美,祖艳群,王 灿,李虹茹,李 元
(云南农业大学资源与环境学院,云南省农业环境污染控制与生态修复工程实验室,昆明 650201)
20世纪70年代初,大量氟氯烃化合物排放到大气中,经紫外线的作用分解出氯原子并与臭氧发生连锁反应,消耗了平流层中的臭氧,造成臭氧层衰减,大气层吸收UV-B辐射(280~315 nm)的能力减弱,地表UV-B辐射强度增加成为人类面临的严峻环境问题[1]。UV-B辐射对植物不利影响主要有损伤DNA、破坏光合系统酶的活性、光合色素和植物激素的光氧化、气孔传导受阻、抑制光合作用等[2-3]。UV-B辐射胁迫会诱导植物产生防御机制,包括光激活修复DNA损伤、积累酚类化合物、改变叶片表面蜡质层厚度来阻止UV-B辐射损伤组织细胞等[4]。UV-B辐射增强显著抑制稻瘟病菌的生长和产孢能力,使致病性降低[5]。植物的光防御过程与抗病过程相似,植物抗病性受UV-B辐射影响,当UV-B辐射强度变化在植物适应范围内时,诱导叶片产生系统性功能防御体系以提高植物抗病性[6-7]。
水稻(Oryza sativa)是人类生存的主要食物来源,世界上人口数量的增长带来了粮食供应不足的问题。稻瘟病菌(Magnaporthe oryzae)通过分生孢子的传播侵染水稻叶片,所引起的叶面真菌病即为稻瘟病,稻瘟病菌抑制水稻叶片光吸收能力,破坏PSⅡ反应中心[8],其也是限制水稻生产的主要因素[9]。水稻对环境的适应性和抗病性决定UV-B辐射与稻瘟病菌对水稻的胁迫程度[10]。在自然界中,作物处于生物胁迫和非生物胁迫相互作用下,研究单一的因素不能预测其联合效应对农业生产的影响[11]。
云南省元阳梯田作为一个稳定、可持续的稻田生态系统[12],生长于该系统的传统水稻品种经长期自然选择,对环境和气候变化的适应能力强[13]。前期研究发现UV-B辐射增强,降低稻瘟病菌致病性,提高水稻抗病性,抑制稻瘟病的发生[6],但UV-B辐射与稻瘟病菌的交互效应对水稻生长与光合特性的影响,目前尚少见报道,且UV-B辐射对稻瘟病菌侵染水稻过程的影响并不明晰。在大田条件下,太阳光谱中的UVB辐射仅占非常小的一部分(不足总量的1%),经过冠层的阻隔,辐射强度大幅度衰减[14],对水稻的危害较小,据此我们推测UV-B辐射与稻瘟病菌复合胁迫水稻,UV-B能够弱化稻瘟病菌的侵染,提高水稻对病原菌侵染的响应,缓解病情,促进水稻生长。本研究选取元阳梯田传统稻种——白脚老粳作为研究对象,开展大田原位种植试验,通过在水稻不同的感病时期(稻瘟病菌侵染前、侵染过程中、感病后)进行UV-B辐射处理,研究在UV-B辐射和稻瘟病菌双重胁迫下的水稻生长、叶绿素含量、光合参数、荧光参数以及稻瘟病病情指数的变化情况。
1 材料与方法
1.1 试验地概况与供试材料
UV-B辐射稻田试验站位于云南省元阳县新街镇的箐口村,是元阳梯田水稻种植的核心区域。选取该地海拔高度为1600 m的稻田作为试验地(23°7′15.8″N、102°44′45.6″E),当地 UV-B 辐射强度背景值为 10 kJ·m-2·d-1,试验地土壤理化性质:pH 值 6.58,全 N、全 P 和全 K 分别为 2.51、0.72 g·kg-1和 5.98 g·kg-1,碱解 N、速效 P 和速效 K 分别为 67.8、20.3 mg·kg-1和 150.8 mg·kg-1。原位种植元阳梯田地方水稻品种白脚老粳,种子由云南省元阳县新街镇农科站提供,该水稻品种在当地的种植历史已有300多年,也是目前主要的培育品种。
1.2 试验方法
试验设6个处理,复合胁迫处理组:UV-B辐射处理的同时接种稻瘟病菌(UV-B/菌),先接种稻瘟病菌7 d待水稻感病后进行UV-B辐射处理(菌→UVB),先UV-B辐射处理7 d后接种稻瘟病菌(UV-B→菌)。单一胁迫处理组:自然光照条件下接种稻瘟病菌(菌)和UV-B辐射处理不接种稻瘟病菌(UV-B)。对照处理:自然光照条件下不接种稻瘟病菌(自然光)。UV-B辐射强度增量为5 kJ·m-2,相当于试验地夏日晴天臭氧层衰减20%造成的UV-B辐射增量,白脚老粳对该辐射强度有显著的生理响应[6]。水稻于2016年3月18日播种在稻田中育苗,5月16日移栽。各处理重复3次,小区面积为390 cm×225 cm,小区间间隔50 cm,每小区种植10行,每行10株水稻,行距30 cm,株距15 cm,每丛一株秧苗,外围设置保护行,小区间用宽1.5 m的聚乙烯膜隔开。采用常规管理,不施用任何化学肥料与农药。
每行水稻正上方设置可升降灯架,架设40 W UV-B灯管(波长280~320 nm,北京电光源研究所提供)处理水稻,用0.13 mm醋酸纤维素膜滤除280 nm以下UV-C波段光线,并用UV-B辐射测定仪(北京师范大学光电仪器厂)测定植株顶端辐射强度。试验处理时间见表 1,每日辐照 7 h(10:00—17:00,此时段阴天或下雨时不进行UV-B辐射处理),随水稻生长调节灯的高度,至10月9日水稻收获后停止试验。自然光照组植株上方只挂设紫外灯灯架,以保证处理组和对照组的自然光条件一致。

表1 UV-B辐射处理与接种时间Table 1 The time of UV-B radiation treatment and inoculation
1.3 稻瘟病菌菌株培养与接种
供试菌株由云南农业大学植物保护学院提供(B6-4)。将菌株用燕麦培养基纯化培养7 d(恒温26℃),将若干菌丝块移至产孢培养基(燕麦50 g、蔗糖20 g、琼脂 16 g、蒸馏水 1000 mL),26 ℃恒温培养 8 d,光照时间10 h·d-(18:00—18:00,日光灯辅助照射)。
孢子悬浮液:在无菌条件下,用无菌水小心洗下培养皿中的孢子,用高温灭菌后的纱布过滤到烧杯中,烧杯密封好置于振荡器中振荡至均匀。然后将悬浮液移至10 mL的高压塑料管中并定容。用血球计数板将孢子悬浮液浓度调至约3×105个·mL-1,作为接种体。采取灭菌后针头吸取孢子悬浮液注射于水稻茎节处接种。
1.4 测定项目
1.4.1 生长指标
于10月9日水稻收获时对水稻株高、分蘖数和穗数进行测定。
每个小区随机测量15株水稻的株高(植株最高叶尖至泥土面的距离)并进行标记,分蘖数、穗数、穗粒数、千粒重同样选取这15株水稻,采用常规方法测定,稻穗收获经自然干燥后对产量进行测定。
生物量:将水稻穗套袋后采回,用自来水将其轻轻的冲洗干净,将穗、茎、叶分别装入牛皮纸袋内,自然风干至恒重,每隔24h测定一次其重量直到恒重。
1.4.2 稻瘟病流行指标的测定
稻瘟病菌接种后一周开始(7月6日)对水稻叶片叶瘟的病情指数(Disease Index,DI)进行观测,按照国际水稻病级分级标准(IRRI)[15],根据病斑面积占叶片面积的比例将病情分为10级,每一级代表相应数值,每隔5 d(7月11日、16日、21日)对水稻叶片数及发病重级调查一次。
DI=[∑(病级叶数×代表数值)]/总叶片数×发病重级的代表数值×100%
1.4.3 水稻叶片光合色素含量与光合特性的测定
于水稻稻瘟病盛行的分蘖期(7月21日)对水稻叶片取样并测定光合指标,叶绿素含量的测定参照Arnon方法[16]。水稻叶片光合特性的测定采用LCPRO便携式光合仪进行测定,每个处理选择9棵植株,测定接种小区植株自下而上第二片感病叶片与未做接种处理小区的同位叶片,测定指标有水稻叶片蒸腾速率(T)r,胞间CO2浓度(C)i,水分利用率(WUE),光合速率(Pn)。WUE=Pn/Tr。荧光特性采用调制叶绿素荧光仪MINI-PAM-II进行测定,叶片暗适应30 min后,作用光强度为191 μmol·m-·2s-1,测定PSⅡ最大光化学效率(Fv/Fm)、PSⅡ有效光化学效率(Fv′/Fm′)、光化学淬灭系数(qP)和非光化学淬灭系数(NPQ)。
1.5 数据处理与统计分析
数据用Excel 2010进行整理,Origin 9.0作图,统计软件SPSS 19采用Duncan检验法,P<0.05水平进行处理间差异显著性检验。
2 结果与分析
2.1 UV-B辐射与稻瘟病菌复合胁迫对水稻生长的影响
在UV-B辐射和稻瘟病菌胁迫下水稻生长受到显著抑制(表2)。UV-B辐射处理后水稻株高显著高于自然光处理,接种稻瘟病菌后水稻株高显著降低;UV-B→菌处理与自然光处理相比水稻株高显著下降,此时复合胁迫处理对株高的抑制作用显著高于单一胁迫处理;UV-B/菌抑制水稻株高,此时复合胁迫处理与接菌处理间无显著差异;菌→UV-B处理株高与自然光照处理和接菌处理间无显著差异。各处理对水稻分蘖数的影响不显著。单一胁迫处理对水稻穗数影响与自然光处理相比无显著差异,UV-B→菌处理显著抑制水稻穗数。菌→UV-B处理水稻地上部分生物量与自然光照处理无显著差异,其他处理均使水稻地上部生物量显著降低。自然光与菌→UV-B处理穗粒数间差异不显著,UV-B→菌显著低于其他处理。UV-B→菌与UV-B/菌处理较其他处理千粒重显著降低。水稻在UV-B辐射与接菌单一胁迫下产量与自然光处理相比显著降低,分别下降9.27%和41.24%,复合胁迫下菌→UV-B和UV-B/菌的产量下降幅度分别为10.79%和32.44%,产量显著高于接菌处理,UVB→菌处理水稻产量下降幅度为51.60%,显著低于其他处理。
2.2 UV-B辐射与稻瘟病菌复合胁迫对水稻叶片叶绿素含量的影响
叶绿素是植物光合作用的基础,UV-B辐射与稻瘟病菌复合胁迫会显著影响水稻叶片叶绿素含量(表3)。UV-B辐射显著提高了叶片Chla、Chlb和Chla+b含量,显著降低了Chla/Chlb,稻瘟病菌侵染水稻叶片后 Chla、Chla+b和 Chla/Chlb显著降低;UV-B→菌处理Chla、Chla/Chlb显著高于UV-B辐射处理;UV-B/菌处理的水稻叶片Chla与自然光处理之间差异不显著,Chlb显著高于自然光处理;菌→UV-B辐射处理叶片的Chla显著低于自然光处理,Chla/Chlb显著高于接菌处理。
2.3 UV-B辐射与稻瘟病菌复合胁迫对水稻叶片气体交换的影响
从图1可以看出,UV-B辐射与稻瘟病菌侵染均显著降低水稻叶片的光合速率,在水稻的不同感病时期进行UV-B辐射处理能显著降低水稻光合作用,UV-B/菌处理下水稻叶片光合作用显著高于接菌与菌→UV-B处理。UV-B辐射和接菌胁迫下胞间CO2浓度显著降低。UV-B辐射对水稻叶片蒸腾速率的影响最显著,显著高于其他处理。UV-B辐射与接种稻瘟病菌都会使水稻叶片水分利用率显著降低,处理间差异不显著。
2.4 UV-B辐射与稻瘟病菌复合胁迫对水稻叶片荧光参数的影响
UV-B辐射增强对水稻-稻瘟病菌互作体系中水稻叶片叶绿素荧光参数的影响见图2。Fv/Fm是水稻叶片最大光合量子产量,UV-B辐射对植物潜在最大光合能力的影响不显著,稻瘟病菌显著降低了水稻最大光合能力;菌→UV-B的值显著高于UV-B/菌,与UV-B→菌处理差异不显著;复合胁迫处理Fv/Fm值显著高于稻瘟病菌单一胁迫处理。Fv′/Fm′是表示水稻PSⅡ系统有效光化学效率的指标,也是有效光合量子产量,UV-B辐射显著降低了水稻叶片光化学效率,菌→UV-B辐射处理对水稻叶片光化学效率抑制程度最大。接菌处理qP值显著高于自然光处理和UV-B处理,菌→UV-B处理水稻叶片qP显著低于自然光处理,另外2个复合处理显著高于自然光处理。接菌使NPQ值显著降低,菌→UV-B处理NPQ值显著升高。

表2 UV-B辐射与稻瘟病菌复合胁迫对水稻生长的影响Table 2 Effects of UV-B radiation and Magnaporthe oryzae on rice growth
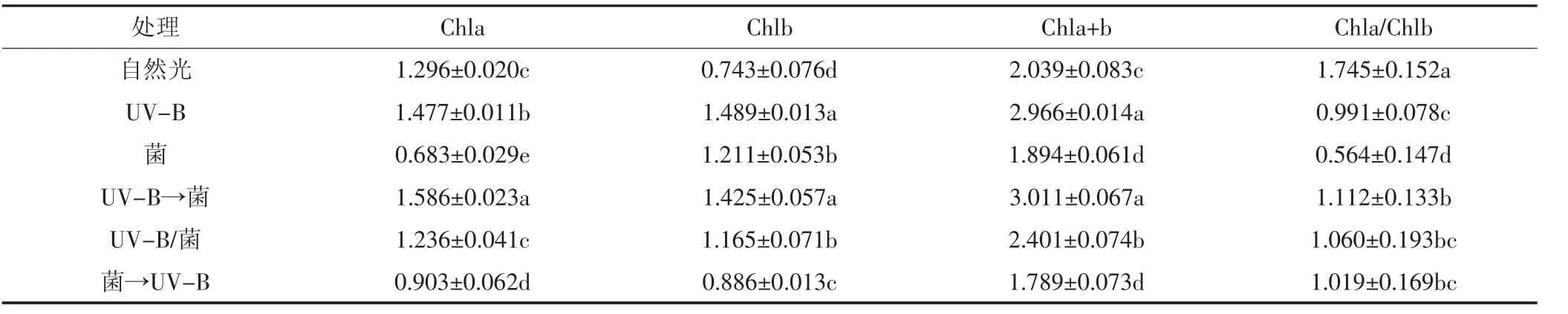
表3 UV-B辐射与稻瘟病菌复合胁迫对水稻叶片叶绿素含量的影响Table 3 Effects of UV-B radiation and Magnaporthe oryzae on chlorophyll content in rice leaves

图1 UV-B辐射对不同感病时期水稻叶片光合气体交换参数的影响Figure 1 Effects of UV-B radiation on the parameters of rice photosynthetic gas exchange in different periods of infection

图2 UV-B辐射对不同感病时期水稻叶片叶绿素荧光参数的影响Figure 2 Effects of UV-B radiation on the variation of rice chlorophyll fluorescence parameters in different periods of infection
2.5 UV-B辐射作用不同感病时期水稻叶片对稻瘟病流行的影响
UV-B辐射对于水稻病情具有显著影响(图3),但是各感病时期进行UV-B辐射增强处理间对水稻的病情指数没有显著差异,显著低于只接种稻瘟病菌处理的病情指数。自然光照下与增强UV-B辐射处理之间呈现规律与探究不同辐射强度对于水稻稻瘟病病情指数的结果具有一致性,增强UV-B辐射强度的病情指数显著低于自然光处理(稻瘟病菌孢子通过风力进行传播,大田条件下无法完全隔绝空气流通)。
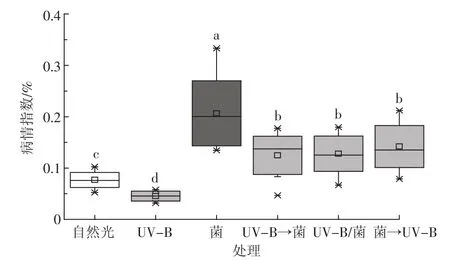
图3 UV-B辐射对不同感病时期水稻病情指数的影响Figure 3 Effects of UV-B radiation on the desease index of rice blast in different periods of infection
3 讨论
UV-B辐射是研究全球变化对生态系统影响的一个分支,稻瘟病是农业生产过程中需面对的重要问题。研究UV-B辐射与稻瘟病菌复合胁迫这一问题,有助于解释环境胁迫影响生物胁迫过程的机制,对稻瘟病菌侵染水稻叶片不同阶段进行UV-B辐射处理,能够分析水稻与稻瘟病菌对UV-B辐射的响应过程。本研究结果发现,UV-B辐射增强对白脚老粳株高有促进作用,与一些研究结果不同[17],这可能是元阳梯田传统水稻品种对环境适应能力强导致的。穗数、生物量和产量的减少,说明水稻在抵御外界胁迫、提高自身抗性的同时,消耗了生长所需的能量[18]和水稻发育早期阶段用于合成蛋白质的光合产物[19]。稻瘟病菌通过机械压穿透水稻表皮,破坏组织细胞,影响了正常光合生理过程,水稻生长受到显著抑制[20]。UV-B→菌处理下水稻叶片病情指数显著低于未辐射处理,这与水稻应激反应有关。UV-B辐射诱导水稻叶片开启类苯丙酸途径,通过合成类黄酮、酚类等物质阻止UV破坏叶绿体[21-22],这一过程中植物保卫素的合成与防御蛋白的积累均抑制病原菌的侵染[23],在水稻防御过程中,消耗水稻生长的能量,导致水稻生长受到抑制。环境胁迫导致植物代谢发生改变[24],防御反应与水稻叶片应激反应有关,植物对胁迫因子的抗性与抗氧化酶系统能力和抗氧化物质含量有关[25]。菌→UV-B处理与自然状态下水稻的生物量差异不显著,该处理减弱了病害对水稻生长的抑制,说明这一过程水稻损耗生长所需能量较少,这一变化可能与感病后进行UV-B辐射加速水稻氧化迸发反应有关,使感病叶片快速衰老和死亡[26],在抗逆过程中投入较少能量,使水稻生长的能量保持稳定,地上部生物量和产量受胁迫影响小,但UV-B辐射对感病叶片衰老机制的影响有待下一步验证。
光合作用是植物生长、生物量积累、产量形成的重要因素,对UV-B辐射和病原菌侵染的响应敏感[27]。光合色素的含量在一定程度上反映了水稻抵御逆境的能力以及胁迫对水稻生长的抑制作用。UV-B辐射显著抑制水稻的光合作用,胁迫程度低于病原菌。UV-B辐射增强显著提高了水稻叶片的蒸腾速率,说明UV-B辐射增加了水稻叶片内外蒸汽压差,但是胞间CO2浓度未显著改变,说明可能与非气孔限制有关[28]。内源激素也是蒸腾速率的控制器,通过蒸腾阻隔UV-B辐射,但机理有待进一步验证。复合胁迫处理间蒸腾速率差异不显著,这可能与二者交互作用有关。一些研究表明,植物在受到胁迫时Fv/Fm值下降[8,29],稻瘟病菌侵染水稻叶片会破坏水稻叶片内的叶绿体,阻碍水稻光合作用,水稻叶片光合结构受到损伤,生长被抑制。菌→UV-B处理,水稻叶片光合活性显著降低,水稻叶片正常生理活动受到破坏,这一变化与活性氧(ROS)生成量的增加有关,PSⅡ系统遭到破坏[28-30]。UV-B/菌处理对水稻叶片光合效率的抑制作用与UV-B辐射处理间无显著差异,可能是由于UV-B辐射损伤分生孢子,抑制孢子萌发,使稻瘟病菌的侵染过程受阻[31]。菌→UV-B处理光合速率与qP值的显著降低导致感病叶片光合过程受到显著抑制,水稻叶片光保护能力显著升高,叶片对于UV-B辐射的耐受度提高。植物生理活动正常时可以通过UV-B辐射刺激特定信号途径以激活抗氧化防御系统[32-33]。在稻瘟病菌侵染水稻后,水稻叶片通过氧化迸发反应于细胞中积累并释放大量ROS,ROS积累诱导氧化应激反应,这一过程使植物细胞开始死亡[34],在稻瘟病菌侵染位点形成细胞坏死反应,能抑制病原菌的生长[35],UV-B辐射可以促进这一过程发生,使感病叶片发生过敏性反应[36],加快叶片感病部位的死亡,控制病害的传播。
UV-B辐射强度在植物耐受范围内时对植物生长而言并非是一种胁迫,从防控病害角度可作为一种诱导剂或杀菌剂,二者交互作用小于二者单独作用时对水稻伤害的累加。后续工作中可设计模型分析UV-B辐射对植物-病原菌互作体系的影响因子,结合植物抗病性和病原菌致病性评价UV-B辐射增强可能给农业生产带来的影响。
4 结论
UV-B辐射增强抑制了稻田生态系统中水稻的生长与光合作用,能降低稻瘟病发病情况,抑制病情传播和扩散。
参考文献:
[1]Williamson C E,Zepp R G,Lucas R M,et al.Solar ultraviolet radiation in a changing climate[J].Nature Climate Change,2014,4(6):434-441.
[2]Kataria,S.Oxidative stress and antioxidative defence system in plants in response to UVB stress[M]//Singh V P,Singh S,Prasad S M,et al.UV-B radiation:From environmental stressor to regulator of plant growth.New York:John Wiley&Sons,2017,99-122.
[3]Reddy K R,Singh S K,Koti S,et al.Quantifying the effects of corn growth and physiological responses to ultraviolet-B radiation for modeling[J].Agronomy Journal,2013,105(5):1367-1377.
[4]Singh J,Gautam S,Bhushan P A.Effect of UV-B radiation on UV absorbing compounds and pigments of moss and lichen of Schirmacher Oasis region,East Antarctica[J].Cellular and Molecular Biology(Noisyle-Grand,France),2012,58(1):80-84.
[5]赵 颖,祖艳群,李 元.UV-B辐射增强对水稻稻瘟病菌(Magnaporthe grisea)生长和产孢的影响[J].农业环境科学学报,2010,29(增刊 1):1-5.ZHAO Ying,ZU Yan-qun,LI Yuan.Effects of enhanced UV-B radiation on growth and sporulation quantity of blast isolate Magnaporthe grisea[J].Journal of Agro-Environment Science,2010,29(Suppl 1):1-5.
[6]Li X,He Y M,Xie C M,et al.Effects of UV-B radiation on the infectivity of Magnaporthe oryzae and rice disease-resistant physiology in Yuanyang terraces[J].Photochemical&Photobiological Science,2017,17(1):8-17.
[7]Demkura P V,Abdala G,Baldwin I T,et al.Jasmonate-dependent andindependent pathways mediate specific effects of solar ultraviolet B radiation on leaf phenolics and antiherbivore defense[J].Plant Physiol,2010,152(2):1084-1095.
[8]易 军.稻瘟病菌对水稻光合特性和产量的影响研究[D].绵阳:西南科技大学,2015.YI Jun.Study on the effects of Magnaporthe Oryzae on photosynthesis characteristics and yield of rice plants[D].Mianyang:Southwest Universityof Science and Technology,2015.
[9]Fisher M C,Henk D A,Briggs C J,et al.Emerging fungal threats to animal,plant and ecosystem health[J].Nature,2012,484(7393):186-194.
[10]Ballaré C L.Light regulation of plant defense[J].Annual Review of Plant Biology,2014,65(1):335-363.
[11]Singh S K,Badgujar G,Redd V R,et al.Carbon dioxide diffusion across stomata and mesophyll and photobiochemical processes as affected by growth CO2and phosphorus nutrition in cotton[J].Journal Plant Physiol,2013,170(9):801-813.
[12]Xiahong H,Yan S,Dong G,et al.Comparison of agronomic traits between rice landraces and modern varieties at different altitudes in the paddy fields of Yuanyang terrace,Yunnan Province[J].Journal of Resources and Ecology,2011,2(1):46-50.
[13]林菁菁,李进斌,刘 林,等.云南元阳哈尼梯田稻瘟病菌遗传多样性分析[J].植物病理学报,2009,39(1):43-51.LIN Jing-jing,LI Jin-bin,LIU Lin,et al.Genetic diversity of Magnaporthe grisea of Hani terrace from Yuanyang County in Yunnan[J].Acta Phytopathologica Sinica,2009,39(1):43-51.
[14]Ballaré C L,Mazza C A,Austin A T,et al.Canopy light and plant health[J].Plant Physiol,2012,160(1):145-155.
[15]IRRI.Standard evaluation system for rice[R].Philippine:Los Banos,International Rice Research Institute,2002.
[16]Arnon D I.Copper enzymes in isolated chloroplasts.Polyphenoloxidase in Beta vulgaris[J].Plant Physiology,1949,24(1):1-15.
[17]蒲晓宏,岳修乐,安黎哲.植物对UV-B辐射的响应与调控机制[J].中国科学:生命科学,2017,47(8):818-828.PU Xiao-hong,YUE Xiu-le,AN Li-zhe.The response of plant to UVB radiation[J].Scientia Sinica(Vitae),2017,47(8):818-828.
[18]李 元,李 想,何永美,等.UV-B辐射增强对植物-病原菌互作体系的影响及评价[J].植物生理学报,2015,51(10):1557-1566.LI Yuan,LI Xiang,HE Yong-mei,et al.Effect and evaluation of enhanced UV-B radiation on interactions between plant and pathogen[J].Plant Physiology Journal,2015,51(10):1557-1566.
[19]Goufo P,Pereira J,Moutinho-Pereira J,et al.Rice(Oryza sativa L.)phenolic compounds under elevated carbon dioxide(CO2)concentration[J].Environmental&Experimental Botany,2014,99(3):28-37.
[20]Ribot C,Hirsch J,Balzergue S,et al.Susceptibility of rice to the blast fungus,Magnaporthe grisea[J].Journal of Plant Physiol,2008,165(1):114-124.
[21]Li Y,Zu Y Q,Chen J J,et al.Intraspecific differences in physiological response of 20 wheat cultivars to enhanced ultraviolet-B radiation under field conditions[J].Environ Exp Bot,2000,44(2):95-103.
[22]何永美,湛方栋,祖艳群,等.大田条件下UV-B辐射对元阳梯田2个地方水稻品种硅、类黄酮和总酚含量的影响[J].农业环境科学学报,2013,32(8):1500-1506.HE Yong-mei,ZHAN Fang-dong,ZU Yan-qun,et al.Effects of UV-B radiation on the contents of silicon,flavonoids and total phenolic of two local rice varieties in Yuanyang terrace under field conditions[J].Journal of Agro-Environment Science,2013,32(8):1500-1506.
[23]Schreiner M,Martínez-Abaigar J,Glaab J.UV-B induced secondary plant metabolites[J].Optik&Photonik,2014,9(2):34-37.
[24]Shen X,Dong Z,Chen Y.Drought and UV-B radiation effect on photosynthesis and antioxidant parameters in soybean and maize[J].Acta Physiologiae Plantarum,2015,37(2):1-8.
[25]Fedina I,Hidema J,Velitchkova M,et al.UV-B induced stress responses in three rice cultivars[J].Biologia Plantarum,2010,54(3):571-574.
[26]Heath M C.Hypersensitive response-related death[J].Plant Molecular Biology,2000,44(3):321-334.
[27]黄梅玲,江 洪,金 清,等.UV-B辐射胁迫下不同起源时期的3种木本植物幼苗的生长及光合特性[J].生态学报,2010,30(8):1998-2009.HUANG Mei-ling,JIANG Hong,JIN Qing,et al.The seedling growth and photosynthetic characteristic of three ligneous plants with different evolutionary time to UV-B radiation stress[J].Acta Ecologica Sinica,2010,30(8):1998-2009.
[28]Yuan L,He L L,Zu Y Q.Intraspecific variation in sensitivity to ultraviolet-B radiation in endogenous hormones and photosynthetic characteristics of 10 wheat cultivars grown under field conditions[J].South African Journal of Botany,2010,76(3):493-498.
[29]刘柿良,马明东,潘远智,等.不同光强对两种桤木幼苗光合特性和抗氧化系统的影响[J].植物生态学报,2012,36(10):1062-1074.LIU Shi-liang,MA Ming-dong,PAN Yuan-zhi,et al.Effects of light regimes on photosynthetic characteristics and antioxidant system in seedlings of two alder species[J].Chinese Journal of Plant Ecology,2012,36(10):1062-1074.
[30]Shine M B,Guruprasad K N.Oxyradicals and PSⅡactivity in maize leaves in the absence of UV components of solar spectrum[J].Journal of Biosciences,2012,37(4):703-712.
[31]Cheng P,Ma Z,Wang X,et al.Impact of UV-B radiation on aspects of germination and epidemiological components of three major physiological races of Puccinia striiformis f.sp.tritici[J].Crop Prot,2014,65:6-14.
[32]Hideg É,Jansen MA,Strid Å.UV-B exposure,ROS,and stress:Inseparable companions or loosely linked associates?[J].Trends Plant Sci,2013,18(2):107-115.
[33]Jenkins G I.Signal transduction in responses to UV-B radiation[J].Annu Rev Plant Biol,2009,60(1):407-431.
[34]Nawkar G,Maibam P,Park J,et al.UV-Induced cell death in plants[J].International Journal of Molecular Sciences,2013,14(1):1608-1628.
[35]Dodds P N,Rathjen J P.Plant immunity:Towards an integrated view of plant-pathogen interactions[J].Nat Rev Genet,2010,11(8):539-548.
[36]He Y M,Zhan F D,Zu Y Q,et al.Effect of elevated UV-B radiation on the antioxidant system of two rice landraces in paddy fields on Yuanyang terrace[J].Int J Agri Biol,2014,16(3):585-590.

