转基因大豆及其制品二重荧光定量PCR的建立与验证
王凤军,叶素丹,*,陈冠武,包永华
(1.浙江经贸职业技术学院,浙江杭州 310018;2.汕头出入境检验检疫局,广东汕头 515000)
《2016年全球生物技术/转基因作物商业化发展态势》报告显示转基因大豆的种植面积最大,为9140万公顷,占全球转基因作物总种植面积的一半。转入大豆中的基因种类较多,大致可分为:改善品质、抗虫、抗旱、除草、抗病、高产等几个方向[1]。截止2011年,全球共有19个转基因大豆获得批准商业化种植,包括1个抗虫、3个高油、11个耐除草剂、1个抗虫耐除草剂、3个耐除草剂高油转基因大豆。我国是大豆和大豆制品进口国,国内需求不断增加。目前为止,被批准进入中国的转基因大豆品系只有10种(A2704-12、A5547-127、CV127、DP305423、DP305423×GTS40-3-2、DP356043、GTS40-3-2、MON87701、MON87701×MON89788、MON89788)[1]。
转基因生物可以获得高产和优质的产品,这可解决人类粮食短缺,饥饿,贫穷等生存问题,但同时关于转基因作物的安全担忧也层出不穷[2-5],转基因产品的安全性和合理性争议一直伴随着转基因技术的发展历程,因此对作物转基因成分进行检测也显得尤为重要。目前转基因作物检测主要以PCR方法为主,根据转基因作物转化时惯用的启动子如花椰菜花叶病毒启动子(P-35S)、胭脂碱合成酶终止子(T-NOS)以及外源启动子或终止子与作物基因组的交联结构基因等设计合成特异性引物,用体外扩增的方法定性检测转基因作物样品[6]。该方法操作简便,耗时短,可以建立针对某种作物的标准化检测体系,主要有常规定性PCR法、巢式PCR法,等温扩增法和实时荧光定量PCR法等[7-10]。如朱琳峰等[11]使用LAMP检测方法对抗草甘膦转基因大豆Cp4-epsps基因进行检测;付海滨和钱云开等[12-13]使用实时荧光PCR对转基因大豆的品系进行鉴定。这些传统的转基因检测方法常常局限于单一基因,检测范围窄,效率低,迫切需要开发高通量快捷性的多重荧光PCR检测方法[14-15]。
本研究通过多重引物和荧光探针组合筛选,反应体系优化,特异性、重复性和灵敏性测试以及样品适用性验证检测等过程开发建立了二重荧光定量PCR检测技术,该技术可实现一个反应管中同时检测两个靶标基因,降低试剂成本,缩短检测时间,提高检测效率,为大豆及其深加工产品转基因成分的快速检测提供了有效方法。
1 材料与方法
1.1 材料与仪器
10% Roundup Ready转基因大豆标准品 深圳安莱尔科技公司;CNAS T025-24/30、CNAS T0659-23/74/79/104/175、ACAS-T067-J213 均为CNAS能力验证样品;其他用于适用性检测的大豆及其深加工制品等样品 均购于市场。
通用型基因组DNA小量制备试剂盒(Koning) 杭州百迈生物股份有限公司;AceTaq®DNA聚合酶(Vazyme)、dNTP mix(10 mM each)、10×PCR Buffer(AceTaq)(Mg2+plus)、PBS 南京诺唯赞生物科技公司;探针与引物 委托美国Invitrogen公司合成;AB7500荧光定量PCR仪 美国ABI公司;NanoDrop 核酸蛋白分析仪 美国Thermo公司。
1.2 实验方法
1.2.1 基因组DNA提取 称取干重样品40 mg或湿重样品150 mg,按照基因组DNA提取试剂盒说明书进行操作,加入50 μL灭菌双重蒸馏水洗脱两次。提取后取 1 μL 用核酸蛋白分析仪测定提取的基因组 DNA的浓度和纯度,用灭菌双重蒸馏水将所有样品标定至100 ng/μL,保存于-20 ℃待用。
1.2.2 引物和探针设计 在NCBI网页检索转基因大豆常用外源基因P-35S和T-NOS,根据多重实时荧光PCR检测引物设计与筛选的原则,使用Primer Express 3.0软件设计多重引物和荧光探针。探针分别使用荧光基团FAM和Cy5作为发光基团,使用BHQ作为非荧光淬灭基团。在DNAstar软件上评价引物和探针的特异性,在BLAST网页上比对扩增产物的特异性。检测引物和探针使用灭菌双重蒸馏水稀释至10 μmol/L备用。
1.2.3 二重荧光PCR反应 20 μL二重荧光定量PCR反应体系中包括Taq酶,dNTP,基因组DNA以及2组检测引物和探针等成分(具体见表1)。反应条件设置为95 ℃预变性15 s;95 ℃变性15 s,60 ℃退火延伸1 min,进行40个循环。定量中设置阴阳性对照、三个复孔的重复实验和空白对照实验。阳性对照中使用转基因阳性的大豆DNA模板,阴性对照中使用转基因阴性的大豆DNA模板,空白对照中不加DNA模板,而以灭菌蒸馏水代替,用于检验是否存在PCR污染和较高的引物二聚体污染。实验结果应用ABI 7500 software v2.3进行分析处理。

表1 二重荧光定量PCR的反应混合液组成Table 1 Reaction mix for mutiplex real-time PCR systems
1.2.4 特异性检测 提取ACAS-T067-J213转基因大豆样本以及CNAS T025-30非转基因大豆样本基因组DNA,使用上述二重荧光定量PCR体系进行转基因成分检测与判定,验证方法的特异性。
1.2.5 灵敏性检测 提取10% Roundup Ready转基因大豆样本基因组DNA,用基因组DNA提取时所用的洗脱液进行梯度稀释,按照10倍浓度稀释5个梯度,分别为23.000、2.300、0.230、0.023、0.0023 ng/μL。根据大豆的单倍体基因组分子重量约为1.15 pg[16],稀释后标准品浓度分别为20000、2000、200、20和2拷贝/μL,对5个梯度的标准品进行二重实时荧光定量反应,每个浓度设置3 个重复,验证方法的灵敏性。
1.2.6 适用性检测 采用上述大豆转基因成分二重荧光定量PCR检测方法对实验室收集的转基因大豆标准品,以及中国合格评定国家认可委员会(CNAS)组织的能力验证样品等已知样品进行检测,并对市场上购买的大豆及其深加工制品等流通产品,共27个批次进行检测。同时验证方法的适用性。
2 结果与分析
2.1 样品DNA提取结果
提取得到的DNA溶液经核酸蛋白分析仪检测,OD(260 nm/280 nm)大于1.5,OD(260 nm/230 nm)大于1.0,含量为在100 ng/L以上,纯度和提取效率较好。使用0.7% 琼脂糖凝胶电泳检测条带清晰,完整性好,可用于实时荧光PCR检测。
图1 ACAS-T067-J213转基因大豆样本以及CNAS T025-30非转基因大豆DNA提取结果Fig.1 The results of DNA isolation from ACAS-T067-J213 transgenic soybean samples and no-transgenic soybean CNAS T025-30注:1:ACAS-T067-J213; 2:CNAS T025-30;M:1ku DNA Ladder。
2.2 引物和探针特异性检测
按照1.2.2中的方法针对转基因大豆常用的P-35S启动子和T-NOS终止子各设计2~3对引物和探针,探针5′ 荧光染料标记根据所采用的实时荧光PCR仪的配置和荧光基团的发射光谱或者吸收光谱而定,探针的3′ 淬灭集团为非荧光标记,合成后探针进行扩增验证,筛选出特异性好的引物和探针用于后续实验。筛选的引物和探针信息见表2。
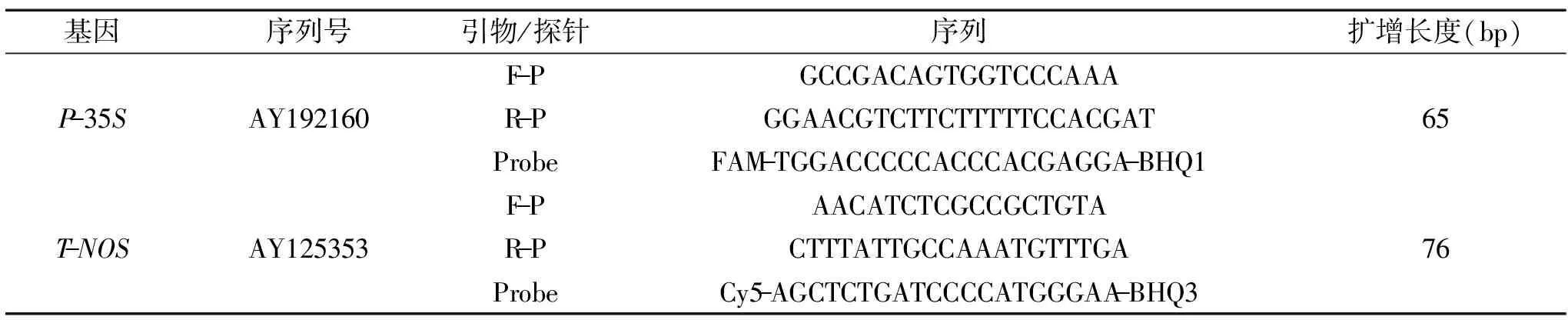
表2 转基因大豆特异性检测的引物和探针序列Table 2 The primers and probes of transgenic soya
2.3 特异性检测结果
使用上述的二重实时荧光定量PCR体系对转基因大豆阳性样本和转基因大豆阴性样本进行转基因成分检测,以验证方法的特异性。结果表明,在ACAS-T067-J213、CNAS T025-24、CNAS T0659-23、CNAS T0659-79、CNAS T0659-104、CNAS T0659-175等转基因大豆中外源基因P-35S启动子和T-NOS终止子检出,且扩增曲线呈现明显的S型(其中ACAS-T067-J213转基因大豆的扩增曲线见图2)。CNAS T0659-74、CNAS T025-30等非转基因大豆种子二重荧光PCR检测中P-35S和T-NOS均未检出,空白对照均无信号,检测基因之间无信号干扰,外源基因的反应结果与期望结果一致,表明建立的二重实时荧光PCR具有较好的特异性。

图2 ACAS-T067-J213转基因大豆样本中外源基因P-35S和T-NOS二重荧光PCR反应的扩增曲线图Fig.2 The amplification plots obtained for simultaneous amplification of P-35S and T-NOS
2.4 灵敏性检测结果
以拷贝数的自然对数值为横坐标,以循环数(Ct值)为纵坐标做外源基因P-35S和T-NOS的标准曲线(图3),其中R2分别为0.997和0.996。10% Roundup Ready转基因大豆单重和多重荧光定量PCR检测相对灵敏性分析见表3,可见本研究建立的二重实时荧光PCR与单重实时荧光PCR的稳定性和灵敏性相当。在二重实时荧光PCR检测中,检测同一参照样品重复间Ct值变异较小,外源基因P-35S的Ct值变化范围在19.23~34.09之间,标准偏差在0.202~0.789之间,扩增效率为93%;外源基因T-NOS的Ct值变化范围在22.73~35.69之间,标准偏差在0.397~0.910之间,扩增效率为91%,最低检测限为2拷贝/μL,表明本研究建立的二重实时荧光PCR检测方法灵敏性较高,能够满足筛选检测转基因大豆及其制品中转基因成分的需要。

表3 10% Roundup Ready转基因大豆单重和多重荧光定量PCR检测相对灵敏性分析Table 3 The relative sensitivity analyses of single and multiplex qPCR systems used in detention of 10% Roundup Ready transgenic soya reference materials

图3 10% Roundup Ready transgenic soybean样品中P-35S和T-NOS基因二重荧光PCR反应的标准曲线图Fig.3 Standard curves of detected genes of P-35S and T-NOS from 10% Roundup Ready transgenic soybean in duplex qPCR assay
2.5 适用性检测结果
对采自农贸市场的2批大豆和豆腐、腐竹、老豆干、素鸡、腐乳、素肉串、豆奶、豆浆、豆腐脑、豆瓣酱、豆卷、板筋等12种大豆制品25个批次样品,以及实验室保存的转基因标准品和能力验证剩余样品进行二重实时荧光PCR和内源基因Letin的检测,其中Letin基因均被检出,保证了核酸提取的有效性,不会出现假阴性检测结果。同时按照使用较多的标准SN/T 1204-2003[17]和GB/T 19495.5-2004[18]中规定的单重实时荧光PCR对外源基因P-35S和T-NOS进行筛选检测。结果发现使用建立的二重实时荧光PCR检测方法,2个批次的大豆样本中P-35S和T-NOS两个靶标基因均未检出,而在其25个批次的大豆制品中只有2个腐竹样本检出了两个靶标基因(见表4),检出率为7.4%,与标准中的方法检测结果一致,采自于市场的27个批次的样本和实验室保存的9个标准品以及能力验证剩余样品均未出现假阳性和假阴性的结果,表明建立的二重实时荧光PCR检测方法具有很好的适用性。
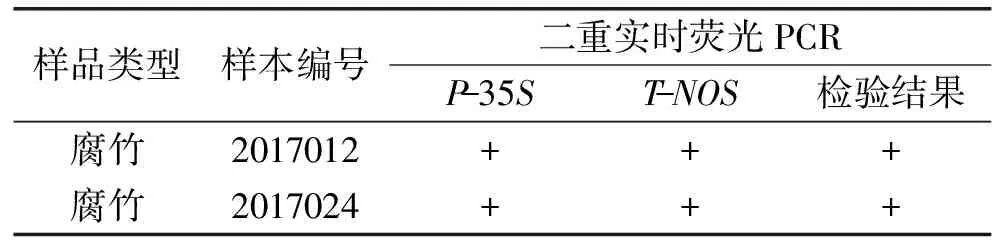
表4 农贸市场大豆及其制品抽样检验中转基因检测阳性结果汇总表Table 4 The summary table of the transgenic positive results of in the soybeans and their products from the farmers markets
3 结论
本研究建立的二重荧光PCR技术可同时对P-35S,T-NOS两个外源基因进行检测,为保证方法的准确性,通过了特异性、重复性和灵敏性的验证,确保了该方法在同时检测两个靶标基因时,无荧光信号的相互干扰,不会出现假阴性和假阳性结果;通过对比优化实验,摸索出二重荧光定量PCR检测的最佳反应体系,扩增效率在90%~110%之间;通过梯度标准品稀释建立的标准曲线决定系数R2大于0.98,确定了最低检测限为2拷贝/μL。通过对27个批次的样品进行转基因成分筛选测试,结果与预期的一致,显示该方法有较好的适用性。开发和建立的二重荧光定量PCR检测技术可为大豆及其深加工产品转基因成分的快速筛选检测提供了有效方法,可用于口岸和市场流通大豆样品的筛选检测。
[1]Clive James. 2016年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志,2017,37(4):1-8.
[2]许晓丹,刘畅,史永翠,等. 转基因大豆食品中外源基因种类及食用安全性分析[J]. 食品与药品,2013,15(6):446-449.
[3]Hails R S. Genetically modified plants-the debate continues[J]. Trends in Ecology and Evolution,2000,15(1):14-18.
[4]Li Y. Gene deletor:A new tool to address gene flow and food safety concerns over transgenic crop plants[J]. Frontiers in Biology,2012,7(6):557-565.
[5]Herman R A,Song P,Zhuang M. Safety risks of cryptic reading frames and gene disruption due to crop transgenesis:What are the odds?[J]. GM crops,2011,2(1):4-6.
[6]黄东东,吕振岳. PCR方法对转基因食品定性检测的研究[J]. 食品科学,2002,23(1):99-101.
[7]刘光明,苏文金,栾国彦,等. PCR方法检测食品中的转基因成分35S和NOS的研究[J]. 食品科学,2002,23(5):94-99.
[8]陈颖,葛毅强,苏宁,等. 食品中转基因成分检测方法的研究进展[J]. 食品与发酵工业,2003,29(6):82-86.
[9]赵锦,邓平建,刘建军,等. 转基因食品多重定性PCR及实时荧光定量PCR检测方法的研究[J]. 中国卫生检验杂志,2004,14(4):412-414.
[10]Mohamed Faize,Lydia Faize and Lorenzo Burgos. Using quantitative real-time PCR to detect chimeras in transgenic tobacco and apricot and to monitor their dissociation[J]. BMC Biotechnology,2010,10:53-61.
[11]朱琳峰,彭焕,黄文坤,等. 抗草甘膦转基因大豆Cp4-epsps基因快速简便的LAMP检测方法[J].植物保护,2015,41(3):86-92.
[12]付海滨,张敏,吴渺渺. 转基因抗虫大豆 MON87701 品系实时荧光PCR检测方法的建立[J]. 辽宁农业科学,2016(4):23-26.
[13]钱云开,高飞,王海洋,等. 16种转基因大豆品系的实时荧光PCR法筛查[J]. 中国油脂,2017,42(2):141-145.
[14]Wang FJ,Zhang XL,Feng JL,et al. Establishment of a
quadruplex real-time PCR for screening of genetically modified tomatoes[J]. Eur Food Res Technol,2014,238(4):683-690.
[15]付伟,任娇,魏霜,等. 转基因大豆DAS44406-6多重荧光定量PCR检测方法的建立[J]. 食品工业科技,2017,38(4):63-72.
[16]Arumuganathan K,Earle E D. Nuclear DNA content of some important plant species[J]. Plant Molecular Biology Reporter,1991,9(3):208-219.
[17]SN/T 1204-2003,植物及某加工产品中转基因成分实时荧光PCR定性检测方法[S].
[18]GB/T 19495.5-2004,转基因产品检测 核酸定量PCR检测方法[S].

