乳腺浸润性导管癌TOP2A基因与相关蛋白及临床病理特征的相关性分析
赵丽辉,易冰,孟凤娇
(广东省中山市人民医院 1.分子诊断中心,2.病理科,广东 中山 528403)
乳腺癌是当今威胁女性健康的第一大恶性肿瘤,其发病率正以每年5%的速度呈增长状态,且年轻、低龄化的趋势越来越明显[1-3],目前乳腺癌的治疗除手术外,还包括激素治疗、化疗和靶向治疗,而在化疗方案中蒽环类药物具有重要作用,但有效率仅为25%~30%[4-5],拓扑异构酶Ⅱα(topoisomeraseⅡα,TOP2A)是蒽环类抗生素的靶酶,有推断称使用TOP2A基因状态来预测患者对含蒽环类药物疗效的治疗方案更为准确[6],TOP2A的扩增或缺失与蒽环类药物的反应性之间相关性已经阐明[7-8],研究发现,蒽环类药物作用于TOP2A蛋白,产生细胞毒作用,诱导细胞凋亡,但蒽环类药物具有严重的毒副作用,因此需要综合评估其临床获益后使用。浸润性导管癌是浸润性乳腺癌中最常见的病理类型,TOP2A基因参与乳腺癌细胞的复制,人类表皮生长因子受体2(human epidermalgrowth factor receptor-2,HER2)、雌激素受体(estrogen receptor,ER)、孕激素受体(porgesterone receptor,PR)、Ki67蛋白是乳腺癌预后的重要生物学因子,是TOP2A基因相关蛋白。本文通过FISH检测方法对371例乳腺浸润性导管癌患者进行TOP2A基因检测,分析其基因状态与ER、PR、Ki67、HER2蛋白表达情况及临床病理特征之间的相关性,以期对乳腺浸润性导管癌在蒽环类药物的使用上提供更为准确的预后和预测信息。
1 资料与方法
1.1 一般资料
选取2015年7月-2017年5月中山市人民医院就诊的乳腺浸润性导管癌患者371例。男性3例,女性368例;年龄25~86岁,≥50岁191例,<50岁180例;手术切除116例,穿刺活检255例;左乳190例,右乳181例。所有患者术前均未行放、化疗或分子靶向治疗,标本均按常规行10%中性甲醛固定、脱水、石蜡包埋、切片及HE染色,由病理科医师阅片确诊为浸润性导管癌。
1.2 试剂与仪器
1.2.1 试剂FISH检测GLP TOP2A/GSP 17探针试剂盒(购自广州安必平生物技术有限公司),IHC检测(购自福州迈新生物技术开发有限公司),标记均设阳性对照组。
1.2.2 仪器Thermo Brite S500-24荧光原位杂交仪,Olympus BX51荧光显微镜,JENOPTIK摄像头及FISH分析软件。IHC检测使用VENTANA公司全自动免疫组织化学仪。
1.3 方法
1.3.1 FISH检测TOP2A基因状态连续切厚3~4 μm石蜡切片2张(1张备片),65℃恒温箱烤片过夜;二甲苯脱蜡15 min×2;无水乙醇10 min;梯度酒精(100%、95%、80%、70%)至去离子水;100℃煮片25 min;晾干后37℃恒温台上胃蛋白酶消化3~10 min;2×SSC缓冲液洗片5 min×2;梯度酒精(70%、80%、95%及100%)脱水,自然晾干;滴加TOP2A杂交液,封片,在杂交仪上变性杂交10~18 h,2×SSC缓冲液洗片10 min与0.1%NP~40缓冲液洗片5 min,洗去多余杂交液;滴加DAPI复染剂,荧光显微镜下观察计数。检测前须通过HE片定位肿瘤浸润区域。
1.3.2 IHC检测ER、PR、Ki67、HER2蛋白表达所有标本均在VENTANA公司全自动免疫组织化学(免疫组化)染色机上进行ER、PR、Ki67、HER2蛋白检测,具体操作步骤严格按罗氏诊断优化程序执行。
1.4 结果判读
1.4.1TOP2A基因FISH检测结果判读具体方法参照文献[11-12]。在60个浸润区癌细胞核内计数GSPTOP2A(红色)和GSP17(绿色)信号,分别计数GSPTOP2A和GSP17的信号总数,再计算GSPTOP2A和GSP17比率,当TOP2A信号呈簇状或比值≥2.0判定为基因扩增;比值<0.8判定为基因缺失;比值在0.8~2.0之间判定为基因无扩增或缺失;当比值在0.7~0.9或1.8~2.2时,需换人增加计数细胞重新计算比值。
1.4.2 免疫组化参照乳腺癌HER2检测指南(2014版),均以浸润癌细胞为观察目标,无着色或≤10%癌细胞微弱膜着色为(0);≥10%癌细胞微弱膜着色为弱阳性(+);10%癌细胞不完整和(或)中等强度膜着色;或≤10%癌细胞强而完整的膜着色为阳性(++);>10%癌细胞强而完整的膜着色为强阳性(+++)。ER、PR以1%为标准,≥1%即为阳性,<1%为阴性;Ki67以20%、50%为分界点,<20%为低表达,20%~50%为中表达,>50%为高表达。
1.4.3 组织学分级根据腺管形成的程度(有多数腺管为1分,有中度分化腺管为2分,细胞呈实性片块或条索状生长为3分)、细胞核的多形性(细胞核大小、形状及染色质一致为1分,细胞核中度不规则为2分,细胞核明显多形性为3分)及核分裂(1/10HPF为1分,2~3/10HPF为2分,>3/10HPF为3分)计数进行统计,3~5分为I级(分化好),6~7分为Ⅱ级(中等分化),8~9分为Ⅲ级(分化差)。
1.5 统计学方法
数据分析采用SPSS 16.0统计软件,用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 TOP2A基因异常与临床病理特征的关系
371例乳腺浸润性导管癌中TOP2A基因扩增64例,占17.25%;缺失12例,占3.24%,总异常率20.49%(76/371),无扩增或缺失295例,占79.52%(见图1)。TOP2A基因状态与年龄、部位及有无淋巴结转移差异无统计学意义(P>0.05),性别组男性的异常率高于女性,但例数较少,差异无统计学意义(P>0.05);病理组织学分级中,Ⅰ级异常率最低,仅为3.03%,Ⅱ级异常率为20.49%,Ⅲ级异常率最高为30.90%,差异有统计学意义(P<0.05),TOP2A基因异常中伴有高级别导管原位癌的病例占18.42%,高于伴中低级别导管原位癌的病例,差异无统计学意义(P>0.05),肿瘤在2~5 cm时TOP2A扩增和缺失比率较高,差异有统计学意义(P<0.05)。见表1。
2.2 TOP2A基因状态与ER、PR、Ki67、HER2蛋白表达异常的相关性
乳腺浸润性导管癌中ER、PR的阳性表达均高于阴性,但与TOP2A基因状态无关,差异无统计学意义(P>0.05),Ki67阴性或<20%,TOP2A基因异常率为8.33%,Ki67表达在20%~50%,TOP2A基因异常率为41.67%,KI-67表达>50%,TOP2A基因异常率为55.56%(见图2),发现TOP2A基因扩增随着Ki67表达增强而增高,但TOP2A基因缺失在Ki67蛋白表达20%~50%时异常率较高(75%),HER2蛋白表达+/++/+++(见图3),TOP2A基因异常率分别为8.33%、22.22%和75.00%,HER2蛋白表达越强TOP2A基因异常率越高。见表2。

图1 TOP2A基因表达情况 (100×1.30oil)

表1 TOP2A基因与临床病理特征的关系 例(%)
续表1
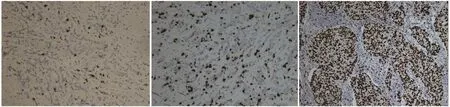
图2 Ki67蛋白不同表达水平 (×100)
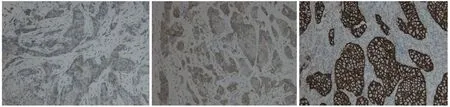
图3 HER2蛋白不同表达水平
表2 TOP2A基因突变与ER、PR、KI-67、HER-2蛋白表达异常的相关性 例(%)

续表2
3 讨论
TOP2A基因编码DNA拓扑异构酶IIα,是核基质成分之一,在核内发挥作用[9]。TOP2A作为调节核酸空间结构动态变化、控制核酸生理功能的一种关键酶,在多种细胞的酶类中均有存在,且在增殖细胞中呈现有周期特异性表达。TOP2A在肿瘤增殖的不同细胞周期中表达各异,一般表现为在DNA 复制后期及有丝分裂期延长,有丝分裂期结束后表达有所下降,提示肿瘤增殖受TOP2A表达的影响[10]。TOP2A基因参与乳腺癌细胞的复制,存在TOP2A基因异常的患者预后差,无复发生存期缩短,尤其是TOP2A基因缺失的患者预后更差。TOP2A基因扩增提示肿瘤有复发的可能,或者远期的疗效降低。因此正确检测和评定乳腺癌的TOP2A状态至关重要。而且TOP2A是蒽环类抗生素的靶酶,TOP2A基因的扩增或缺失可影响蒽环类药物的反应及其药效[11-12],国外有文献报道,乳腺癌TOP2A基因扩增23.9%,基因缺失2.8%[13],国内文献报道TOP2A基因扩增12.6%~19.0%,未见有缺失报道[14-16]。本研究对371例乳腺浸润性导管癌患者通过FISH方法进行TOP2A基因检测,基因异常率为20.49%(76/371),其中扩增64例(17.25%),缺失12例(3.24%),与国内外文献报道基本相符,在与临床病理特征的关系中发现,TOP2A基因改变与年龄、性别和部位及淋巴结转移无相关,男性乳腺癌的异常率虽然高于女性,但无差异,可能是由于样本例数较少,还有待于积累病例数进一步明确。浸润性导管癌组织学分级分为Ⅰ、Ⅱ、Ⅲ级,分级越高,肿瘤细胞分化程度越差,TOP2A基因异常率就越高,而且肿瘤在2~5 cm时TOP2A扩增和缺失比率较高。在统计中还发现,浸润性导管癌中约48.27%TOP2A基因改变伴有不同分化程度的原位癌,以高级别原位癌为主,笔者认为这可能是肿瘤在从原位癌发展为浸润癌的过程中细胞增殖比较活跃导致异常率增高的原因。ER、PR、HER2、Ki67的检测结果是分子分型的重要参考,ER、PR是调节性器官细胞生长发育的雌激素和孕激素受体,是类固醇激素受体超家族成员之一,以往研究发现,ER阳性乳腺癌细胞一般分化好,发展慢;ER阴性的细胞则分化差,恶性程度高。PR是雌激素与ER结合的衍生物。据研究显示,PR阳性表达者无瘤生存期长于PR阴性表达者[17]。本研究中显示,在TOP2A基因扩增、缺失和无异常的浸润性导管癌中ER、PR的阳性表达均高于阴性,对于TOP2A基因状态无差异,Ki67是一种与细胞增殖周期有关,参与DNA合成的蛋白质,目前,Ki67已成为检测肿瘤细胞增殖活性最可靠的指标。有研究表明,Ki67的表达与肿瘤分化程度、浸润转移等密切相关。本研究结果显示,TOP2A基因扩增随着Ki67表达增强而增高,TOP2A基因缺失在Ki67蛋白20%~50%表达范围突变率较高。TTOP2A基因和HER2/neu原癌基因在染色体上均定位于17q11.2~22区域,并且与HER2基因相隔很近,有研究表明,HER2与TOP2A在乳腺癌中的表达存在一定相关性且共同影响其发生、发展[18],本研究结果显示,HER2蛋白表达越强TOP2A基因异常率越高。文献报道,TOP2A基因异常与非特殊性浸润性乳腺癌的分级、HER2基因扩增以及Ki67蛋白表达存在正相关[19],也有文献报道TOP2A基因扩增与Ki67及病理分级无关联[16,20],本研究在这4种蛋白表达中,TOP2A基因异常与ER、PR蛋白表达无相关性,与HER2、Ki67蛋白表达呈正相关,蛋白表达越强异常率越高,各实验室研究报道不同,这可能与实验室标准、免疫组化的判读和分型比例及人为因素的差异有关,有待于进一步探讨。
乳腺浸润性导管癌TOP2A基因及相关蛋白的表达存在复杂性,但已成为乳腺癌治疗和预测的重要指标,TOP2A基因扩增及蛋白过表达可能增加乳腺癌细胞对蒽环类化疗药物敏感性[21]。因此,TOP2A基因检测是乳腺浸润性导管癌蒽环类药物使用的重要依据和必要检测手段。目前关于TOP2A基因状态的报道较少,有待于进一步的研究和总结。
参 考 文 献:
[1] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics,2013[J]. CA Cancer J Clin, 2013, 63(1): 11-30.
[2] WEISS J R, MOYSICH K B, SWEDE H. Epidemiology of male breastcancer[J]. Cancer Epidemiol Biomarkers Prev, 2005, 14(1):20-26.
[3] DEB S, JENE N, INVESTIGATORS K, et al. Genotypic and phenotypic analysis of familial male breast cancer shows under representation of the HER2 and basal subtypes in BRCA-associated carcinomas[J]. Bmc Cancer, 2012, 12(1): 510.
[4] O’MALLEY F P, CHIA S, TU D, et al. Topoisomerase II alpha and responsiveness of breast cancer to adjuvant chemotherapy[J].Journal of the National Cancer Institute, 2011, 103(4): 352.
[5] TUBBS R, BARLOW W E, BUDD G T, et al. Outcome of patients with early-stage breast cancer treated with doxorubicinbased adjuvant chemotherapy as a function of HER2 and TOP2A status[J]. Journal of Clinical Oncology, 2009, 27(24): 3881-3886.
[6] PRITCHARD K I, MESSERSMITH H, ELAVATHIL L, et al. HER-2 and topoisomerase II as predictors of response to chemotherapy[J]. Journal of Clinical Oncology, 2008, 26(5): 736.
[7] SIMON G, SHARMA A, LI X, et al. Feasibility and efficacy of molecular analysis-directed individualized therapy in advanced non–small-cell lung cancer[J]. Journal of Clinical Oncology, 2007,25(19): 2741.
[8] SLAMON D J, PRESS M F. Alterations in the TOP2A and HER2 genes: Association with adjuvant anthracycline sensitivity in human breast cancers[J]. Journal of the National Cancer Institute,2009, 101(9): 615-618.
[9] BRASE J C, SCHMIDT M, FISCHBACH T, et al. ERBB2 and TOP2A in breast cancer: a comprehensive analysis of gene amplification, RNA levels, and protein expression and their influence on prognosis and prediction[J]. Clinical Cancer Research,2010, 16(8): 2391.
[10] ROMERO A, CALDÉS T, DÍAZRUBIO E, et al. Topoisomerase 2 alpha: a real predictor of anthracycline efficacy[J]. Clinical &Translational Oncology, 2012, 14(3): 163-168.
[11] BARINOFF J, TRAUT A, BAUERSCHLAG D, et al.Chemotherapy for 70-year-old women with breast cancer in Germany: a survey by the German breast group[J]. Geburtshilfe Frauenheilkd, 2013, 73(5): 433.
[12] GOGIA A, RAINA V, DEO S V, et al. Taxane and anthracycline based neoadjuvant chemotherapy for locally advanced breast cancer: institutional experience[J]. Asian Pacific Journal of Cancer Prevention Apjcp, 2014, 15(5): 1989.
[13] BADAWY O M, LOAY I. FISH analysis of TOP2A and HER-2 aberrations in female breast carcinoma on archived material:Egyptian NCI experience[J]. Applied Immunohistochemistry& Molecular Morphology Aimm, 2017: 1. DOI: 10.1097/PAI.0000000000000574.
[14] 刘春萍, 逯翀, 田源, 等. 乳腺癌Her-2与TOP2A基因表达对新辅助化疗效果的预测价值[J]. 中国普通外科杂志, 2010,19(11): 1200-1203.
[15] 明洁, 逯翀, 田元, 等. 乳腺癌HER2与TOP2A的表达及其相关性[J]. 解剖学报, 2010, 41(3): 391-394.
[16] 张成娟, 董凤梅, 徐本玲, 等. Ki-67、Her-2及Top2A在乳腺癌中的扩增表达与蒽环类药物疗效关系的研究[J]. 肿瘤基础与临床, 2017, 30(1): 11-14.
[17] 王湛博, 赵坡, 刘梅, 等. 乳腺癌组织中雌激素受体和孕激素受体及细胞周期蛋白D1的表达及其临床病理意义[J]. 中华医学杂志, 2005, 85(8): 514-517.
[18] SIDDIQA A, LONG L M, LI L, et al. Expression of HER-2 in MCF-7 breast cancer cells modulates anti-apoptotic proteins Survivin and Bcl-2 via the extracellular signal-related kinase(ERK) and phosphoinositide-3 kinase (PI3K) signalling pathways[J]. BMC Cancer, 2008, 8(1): 129.
[19] 许洁, 陈洁, 张科平, 等. 非特殊性浸润性乳腺癌 TOP2 A基因状态与分级、HER-2和Ki-67的相关性[J]. 临床与实验病理学杂志, 2015(5): 576-578.
[20] 徐恩伟, 王跃华, 王晋芬, 等. 乳腺癌拓扑异构酶Ⅱα基因HER-2基因及Ki-67的关系研究[J]. 中国药物与临床, 2012,12(11): 1392-1394.
[21] COON J S, MARCUS E, GUPTABURT S, et al. Amplification and overexpression of topoisomerase IIalpha predict response to anthracycline-based therapy in locally advanced breast cancer[J].Clinical Cancer Research, 2002, 8(4): 1061.

