大黄素甲醚对白血病耐药细胞系K562/ADM耐药性的影响及机制研究*
杨璇,高菲,刘文君
(西南医科大学附属医院 儿科,四川 泸州 646000)
慢性粒细胞白血病(chronic myeloid leukemia,CML)是造血干细胞的恶性转化,其发病率为1~2/100 000[1]。随着CML病程的进展其化疗耐药性也随之增加,化疗失败是CML高死亡率的关键因素。因此,发现能提高治疗效果的新方法并且克服药物的耐药性具有重要意义。微小RNA(MicroRNAs,miRNA)是大小为18~25个核苷酸,进化高度保守的内生非编码小RNAs。其在肿瘤中异常表达,并且能作为癌基因通过结合目标mRNA的3'-UTR抑制mRNA的翻译或裂解目标mRNAs诱导其退化[2]。除了实体肿瘤,miRNA也在许多不同的血液恶性肿瘤中异常表达,如慢性淋巴白血病、急性髓系白血病、骨髓增殖性肿瘤。对CML,ROKAH等[3]发现与对照组细胞相比,下调K562细胞中的miRNA-31、miRNA-34a、miRNA-155及miRNA-564后,miRNA在CML发病机制中具有潜在的作用,miRNAs可能是CML治疗的新靶点[4]。大黄的药用成分是大黄素甲醚,曾被用作泻药,有护肝、抗炎及抗菌的特性。研究发现大黄素甲醚能够干预癌细胞的生理活动,其中包括细胞凋亡[5-6],细胞生长周期[7]及转移[8]。然而,大黄素甲醚在血液恶性肿瘤中的作用尚未阐明。本研究将探讨miRNA-146a对CML细胞(K562/ADM)耐药性的影响以及大黄素甲醚对K562/ADM多药耐药性的逆转效应。
1 材料与方法
1.1 材料与试剂
人CML细胞系K562细胞和耐阿霉素细胞系K562/ADM(由中国上海生物化学与细胞生物学研究所细胞库提供),CCK-8试剂盒(购自中国碧云天公司),Annexin V-FITC/PI细胞凋亡双染试剂盒、增加通透性试剂盒(购自BD公司),Hoechst33258(购自美国Sigma公司),总miRNA提取试剂盒、TaqMan探针、逆转录试剂盒(购自美国Applied Biosystems公司),总RNA提取试剂盒(购自中国天根生化科技有限公司),miRNA-146a mimic、miRNA-con的慢病毒载体及miRNA-146a inhibitor(购自德国Qiagen公司),LipofectamineTM2000(购自美国Invitrogen公司),抗鼠CXCR4-PE抗体(购自美国eBioscience公司),CXCR4及β-actin抗体(购自中国Abcam公司),辣根过氧化物酶(购自中国Boster公司),Transwell小室(购自美国Corning公司)。
1.2 细胞培养
将2种细胞悬浮于含有10%胎牛血清、100 u/ml青霉素和100 mg/ml链霉素双抗完全培养基中并接种在培养瓶,维持细胞密度为1×105个/ml,置于二氧化碳CO2体积分数为5%,饱和湿度90%的37℃培养箱中连续培养。在K562/ADM细胞培养液中加入5 mg/ml的ADM维持细胞系的耐药性,实验前用无ADM培养基至少培养2周。
1.3 方法
1.3.1 CCK-8检测运用药物干预2种细胞前,在96孔板中调整细胞浓度为5.0×103个/孔,培养24 h。按CCK-8说明书用移液枪吸取100 μl细胞悬液加入96孔板中,同时设置对照组(加入等量培养液)和空白调零组,每组设3个复孔,每孔再加10 μl的CCK-8溶液,在450 nm处用酶标仪测量各孔的OD值求得均值计算细胞增殖抑制率,增殖抑制率=(OD对照组-OD实验组)/(OD对照组-OD空白组)×100%。半数抑制率计算采用SPSS 11.0统计学软件分析(LOGIT方法),耐药逆转倍数=空白对照组IC50/逆转组 IC50。
1.3.2 细胞克隆形成实验将K562/ADM细胞悬浮于含有不同浓度大黄素甲醚的RPMI 1640琼脂糖混合物中,并接种于底面铺有RPMI 1640琼脂糖固体培养基的6孔板中。不更换新鲜培养基,将其置于温度为37℃,饱和湿度95%、CO2体积分数为5%的培养箱中,连续培养14 d。选取超过50个细胞的细胞团计数并用结晶紫染色,细胞拍照记录。
1.3.3 流式细胞术及Hoechst 33258检测细胞凋亡用不同浓度的大黄素甲醚干预K562/ADM 48 h,收集细胞用预冷的PBS洗涤细胞,加入500 μl的Binding Buffer悬浮细胞,按每份100 μl的细胞悬液进行分装备用。每个样本加入2 μl的Annexin V-FITC和2 μl的PI染色混匀后,避光,室温孵育5 min;上机前加入400 μl的Binding Buffer,流式细胞仪对1×104个细胞进行分析。Annexin V-FITC阳性的细胞为进行性凋亡的细胞,而FITC阴性细胞为存活的细胞。
Hoechst33258同样被用来检测凋亡细胞,细胞与Hoechst33258的高亲和力表明细胞凋亡。处理后的K562/ADM细胞经PBS洗涤后每孔加入500 μl预冷的乙醇固定10 min。然后加入1 μmol/L Hoechst 33258染色10 min后用荧光显微镜进行观察。200个细胞在3个随机选择的区域被计数并计算凋亡细胞核染色的发生率。
1.3.4 miRNA-146a下调、过表达及测定K562/ADM或K562细胞接种在96孔板中孵育过夜,然后根据LipofectamineTM2000说明书将细胞与miRNA-146a mimic、miRNA-146a抑制剂及空白的miRNA-con载体进行转染。转染效率用实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRTPCR)进行分析确定。
在miRNA检测中,应用总miRNA提取试剂盒提取总miRNA,miRNA-146a通过探针qRT-PCR检测。应用总RNA提取试剂盒从细胞中提取总RNA,逆转录为cDNA,qRT-PCR法扩增目的基因和内参照基因人GAPDH,引物序列由生工生物工程(上海)股份有限公司根据已发布的序列[9]合成。应用比较ΔCt法对qRT-PCR结果进行分析。
1.3.5 siRNA下调CXCR4的表达CXCR4 siRNA寡核苷酸序列由生工生物工程(上海)股份有限公司根据已发布的序列[10]合成,同时设计合成1条竞争序列作为对照。取对数生长期的K562/ADM细胞接种于6孔板中,调整细胞密度为3×105个/ml,孵育过夜,根据LipofectamineTM2000说明书将细胞与siRNA载体及竞争的siRNA载体进行转染。转染后的细胞继续孵育48 h后用Western blot分析其下调作用进行验证。
处理后,收集K562/ADM细胞加裂解液至冰上30 min后粉碎细胞,收集蛋白加入SDS-聚丙烯酰胺凝胶(SDS-PAGE)上样缓冲液进行SDS-PAGE电泳后将蛋白转移到PVDF膜上。蛋白经特殊的一抗和抗兔多克隆抗体处理后被检测,β-actin作为内参照,经TBST再次清洗后加入辣根过氧化物酶进行检测。信号检测使用化学发光底物,结果用Band Scan软件进行分析。
1.3.6 细胞表面CXCR4的表达在使用增加通透性的试剂盒之前先用抗鼠CXCR4-PE抗体固定K562/ADM细胞,然后用同样的抗体对细胞进行第2次固定。使用FACS Calibur和Flow Jo软件对结果进行分析。
1.3.7 质粒的构建及荧光素酶活性的检测①质粒的构建参考文献[11]。利用人基因组特定引物通过PCR对包括3'-UTR的片段进行扩增(正向5'-G CTCTAGACACAGATGTA-AAAGAC-3';反向 5'-GCTC TAGACCACTGGTACAAAATCTTTATGTAAG-3'),并且插入1个pGL3载体到反向荧光素酶基因的终止密码子,从而引起pGL3-3'-UTR/CXCR4的构成。②荧光素酶活性的检测。293T受体细胞暂时性地与0.2 μg的pGL3-3'-UTR/CXCR4结构结合,0.02 μg的pRL-TKRenilla荧光素质粒包含标准化的Renilla荧光素及5 pmol的miRNA-146a的过表达或对照质粒。转染24 h后溶解,根据设备说明书用双荧光素酶分光光度计检测系统进行荧光素酶的活性测量。
1.3.8 迁移实验K562/ADM经不同浓度的大黄素甲醚干预48 h后收集细胞,调整细胞浓度为5×105个/ml。将细胞悬液放于上层小室,100 ng/ml CXCL12放在下层小室。随后孵育8 h,未迁移的细胞在表面被移除,迁移细胞染色计数。
1.4 统计学方法
数据分析采用SPSS 11.0统计软件,计量资料以均数±标准差(±s)表示,采用t检验或方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miRNA-146a在K562/ADM细胞中的表达
根据CCK-8分析,K562细胞和K562/ADM细胞经ADM干预48 h后的IC50分别为0.15和3.50 μmol/L,K562/ADM细胞的耐药倍数是K562细胞的23倍多,见表1。与K562细胞比较,K562/ADM细胞中miRNA-146a的表达较低,表明miRNA-146a在K562细胞对ADM的获得性耐药中具有重要作用。见表2。
2.2 下调miRNA-146a对K562细胞ADM抵抗性的影响
转染miRNA-146a inhibitor后miRNA-146a的表达水平降低。细胞生存实验表明下调miRNA-146a后的K562细胞的生存率高于K562细胞及对照组(IC50分别为2.80、0.15及0.18 μmol/L,见表1)。另外,流式细胞术同样显示下调miRNA-146a能增强K562细胞抵抗ADM诱导的凋亡(见表3和图1),总的来说,该结果显示miRNA-146a与K562细胞对ADM耐药有关。
表1 ADM干预48 h的IC50 (n =3,μmol/L,±s)
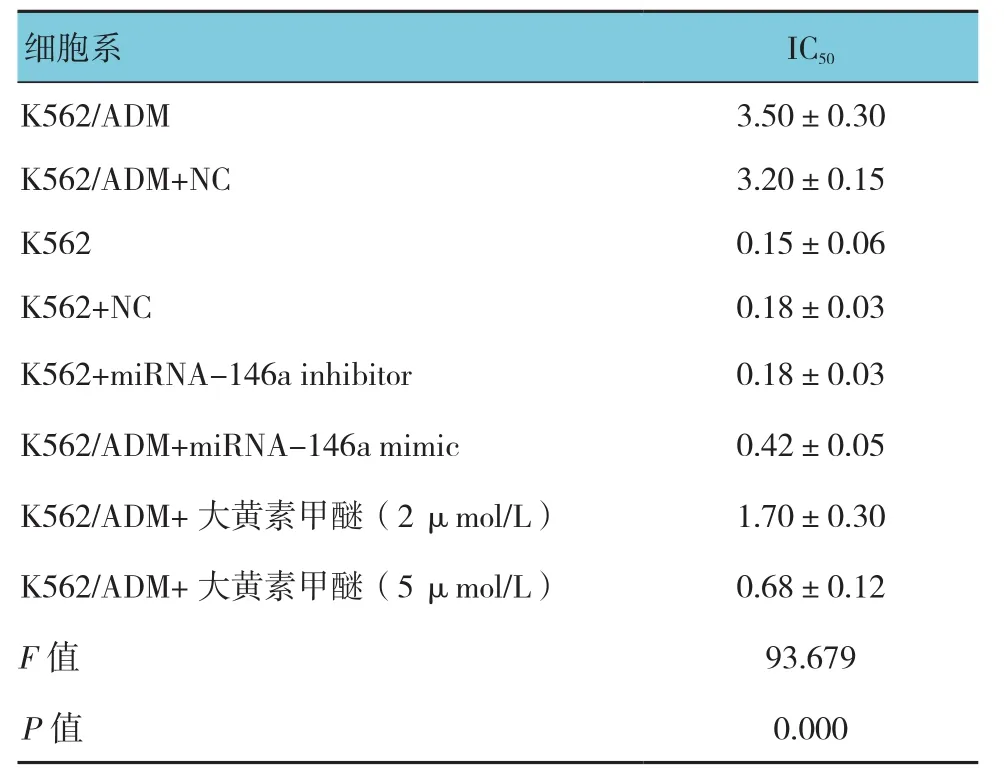
表1 ADM干预48 h的IC50 (n =3,μmol/L,±s)
IC50细胞系K562/ADM 3.50±0.30 K562/ADM+NC 3.20±0.15 K562 0.15±0.06 K562+NC 0.18±0.03 K562+miRNA-146a inhibitor 0.18±0.03 K562/ADM+miRNA-146a mimic 0.42±0.05 K562/ADM+大黄素甲醚(2 μmol/L) 1.70±0.30 K562/ADM+大黄素甲醚(5 μmol/L) 0.68±0.12 F值 93.679 P值 0.000
表2 miRNA-146a在K562/ADM及K562细胞中的表达(n =3,±s)

表2 miRNA-146a在K562/ADM及K562细胞中的表达(n =3,±s)
细胞系 miRNA K562 0.98±0.03 K562/ADM 0.29±0.02 t值 33.147 P值 0.000
2.3 上调miRNA-146a对K562/ADM细胞ADM敏感性的影响
miRNA-146a的作用通过应用miRNA-146a mimic被进一步研究。与K562/ADM细胞及转染空白质粒的K562/ADM细胞比较,转染miRNA-146a mimic的K562/ADM细胞中的miRNA-146a表达增高,见表4和图2。CCK-8检测显示K562/ADM细胞转染miRNA-146a mimic以后,与K562/ADM细胞及转染空白质粒的K562/ADM细胞相比能增强K562/ADM细胞对ADM的敏感性(IC50为0.42、3.50和3.20 μmol/L,见表1)。相应地,上调miRNA-146a能使K562/ADM细胞对ADM诱导凋亡的作用更敏感。
2.4 调节miRNA-146a对K562细胞ADM耐药的影响
下调或者上调K562细胞中的miRNA-146a未能引起P-gp或者MRP-1的mRNA的改变。相反,miRNA-146a的表达与CXCR4 mRNA的表达呈负相关,见表5。另外,流式细胞术和Western blot分析也显示miRNA-146a的表达与CXCR4的表达呈负相关(见表6和图3)。qRT-PCR和Western blot结果显示CXCR4 siRNA抑制CXCR4表达的增加是由miRNA-146a inhibitor引起的(见表7和图4)。另外,通过miRNA-146a inhibitor的诱导下调CXCR4的表达能降低K562细胞的耐药性(见表8和图5),表明miRNA-146a通过CXCR4在K562耐药细胞中发挥其功能。
表3 miRNA-146a在各组K562细胞中的miRNA表达及对细胞凋亡的影响 (n =3,±s)
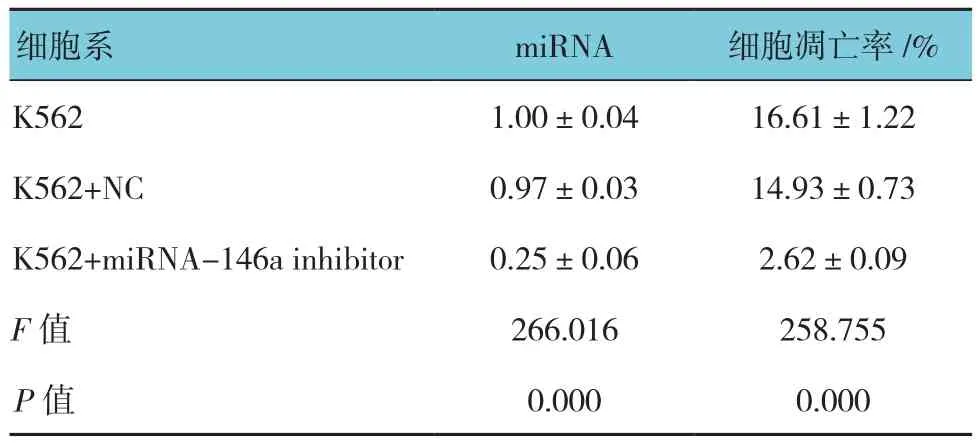
表3 miRNA-146a在各组K562细胞中的miRNA表达及对细胞凋亡的影响 (n =3,±s)
细胞系 miRNA 细胞凋亡率/%K562 1.00±0.04 16.61±1.22 K562+NC 0.97±0.03 14.93±0.73 K562+miRNA-146a inhibitor 0.25±0.06 2.62±0.09 F值 266.016 258.755 P值 0.000 0.000
表4 miRNA-146a在各组K562/ADM细胞中的miRNA表达及对细胞凋亡的影响 (n =3,±s)

表4 miRNA-146a在各组K562/ADM细胞中的miRNA表达及对细胞凋亡的影响 (n =3,±s)
细胞系 miRNA 细胞凋亡率/%K562/ADM 0.97±0.07 12.31±1.20 K562/ADM+NC 0.95±0.05 15.34±2.34 K562/ADM+miRNA-146a mimic 2.69±0.21 48.11±6.45 F值 174.361 73.108 P值 0.000 0.000

图1 miRNA-146a inhibitor干预后各组K562细胞的凋亡情况
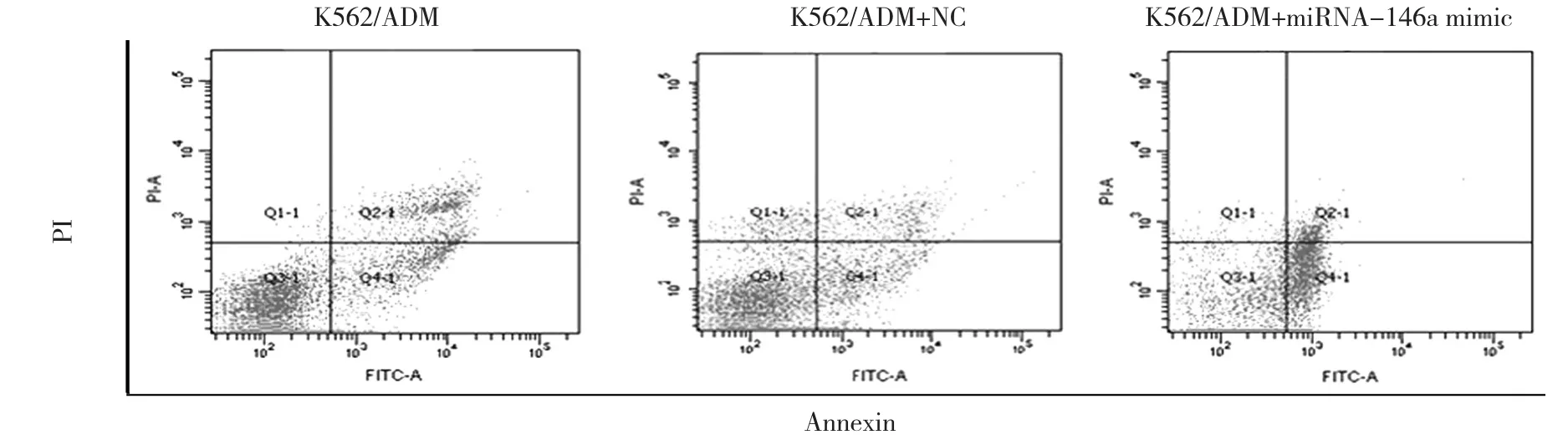
图2 过表达miRNA-146a对K562/ADM细胞凋亡的影响
2.5 大黄素甲醚对K562/ADM细胞ADM敏感性的影响
大黄素甲醚减少K562/ADM细胞的生存能力,且呈剂量依赖性。当K562/ADM细胞受到相同剂量大黄素甲醚干预时,孵育48 h的抗恶性细胞增生的作用比24 h更明显。然而,当将大黄素甲醚的干预时间延长到72 h,未观察到进一步的细胞抑制作用(见表1)。给予大黄素甲醚2和5 μmol/L干预48 h后并未显示出对K562/ADM细胞毒性作用(生长抑制率<10%),所以选择该剂量检查大黄素甲醚能否逆转K562/ADM细胞的耐药性。CCK-8结果显示选用2和5 μmol/L浓度的大黄素甲醚干预细胞后能降低K562/ADM细胞对ADM的IC50,IC50分别从3.50 μmol/L降到1.70和0.68 μmol/L。结果显示,大黄素甲醚能增强K562/ADM细胞对ADM的敏感性,耐药逆转倍数在2和5 μmol/L浓度下分别为2.03和5.30倍(见表1)。逆转耐药也可以经克隆形成实验证实,与单独用ADM干预的细胞比较,当大黄素甲醚和ADM联合作用于K562/ADM时,细胞集落数及集落大为减少,支持大黄素甲醚能增强K562/ADM细胞对ADM的敏感性。见表10和图6。流式细胞仪分析表明与单独用ADM干预比较,大黄素甲醚浓度在2和5 μmol/L能增加K562/ADM细胞的凋亡,见表11和图7A。另外,Hoechst染色也进一步表明通过大黄素甲醚能增强ADM诱导细胞凋亡的作用,见图7B。虽然大黄素甲醚自身不能诱导凋亡,但是通过核凝结能明确其对K562/ADM细胞的凋亡具有影响。
表5 调节miR-146a对细胞中P-gp、MRP-1及CXCR4表达的影响 (n =3,±s)
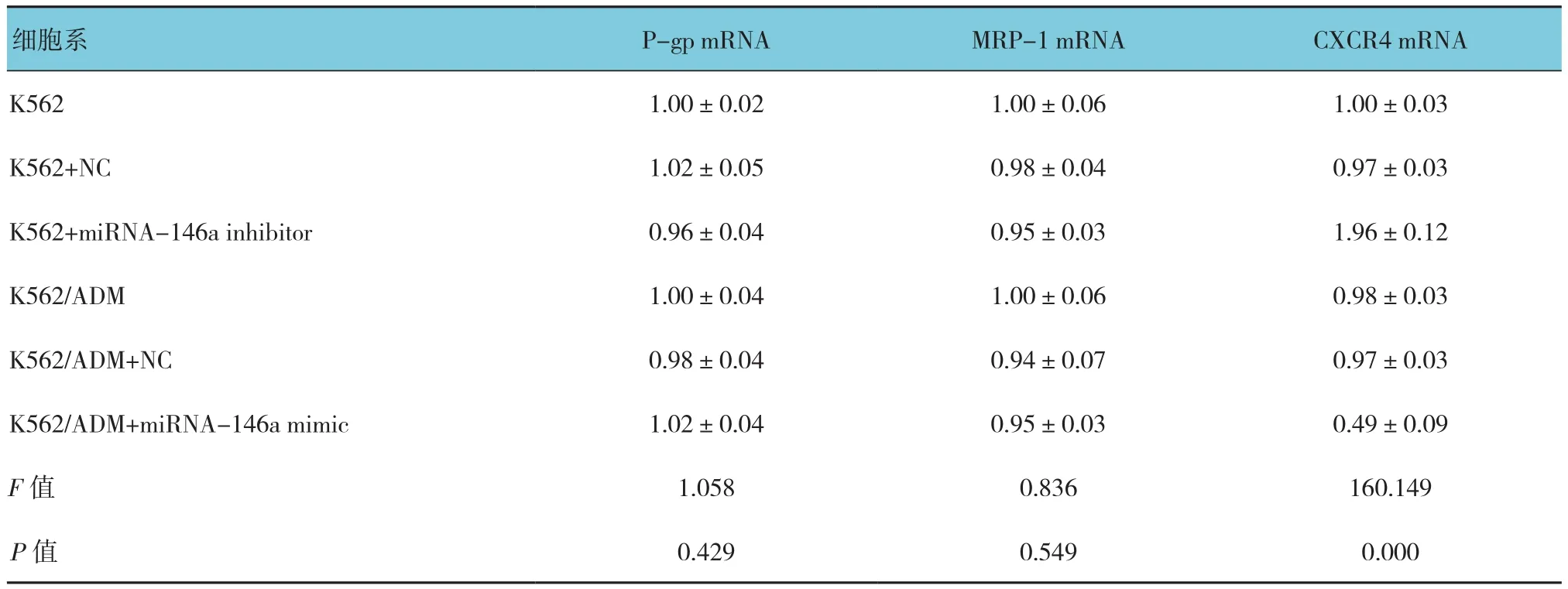
表5 调节miR-146a对细胞中P-gp、MRP-1及CXCR4表达的影响 (n =3,±s)
P-gp mRNA MRP-1 mRNA CXCR4 mRNA K562 1.00±0.02 1.00±0.06 1.00±0.03 K562+NC 1.02±0.05 0.98±0.04 0.97±0.03 K562+miRNA-146a inhibitor 0.96±0.04 0.95±0.03 1.96±0.12 K562/ADM 1.00±0.04 1.00±0.06 0.98±0.03 K562/ADM+NC 0.98±0.04 0.94±0.07 0.97±0.03 K562/ADM+miRNA-146a mimic 1.02±0.04 0.95±0.03 0.49±0.09 F值 1.058 0.836 160.149 P值 0.429 0.549 0.000细胞系
表6 CXCR4在各组K562和K562/ADM细胞中的表达 (n =3,±s)

表6 CXCR4在各组K562和K562/ADM细胞中的表达 (n =3,±s)
CXCR4的相对蛋白表达量K562 0.98±0.05 1.00±0.05 K562+NC 0.97±0.05 1.04±0.07细胞系 表面CXCR4的相对表达量K562+miRNA-146a inhibitor 2.25±0.26 1.85±0.17 K562/ADM 1.00±0.03 1.00±0.02 K562/ADM+NC 1.03±0.07 0.96±0.05 K562/ADM+miRNA-146a mimic 0.35±0.12 0.43±0.05 F值 74.915 89.579 P值 0.000 0.000
表7 miRNA-146a调节CXCR4对K562细胞ADM 耐药性的影响 (n =3,±s)
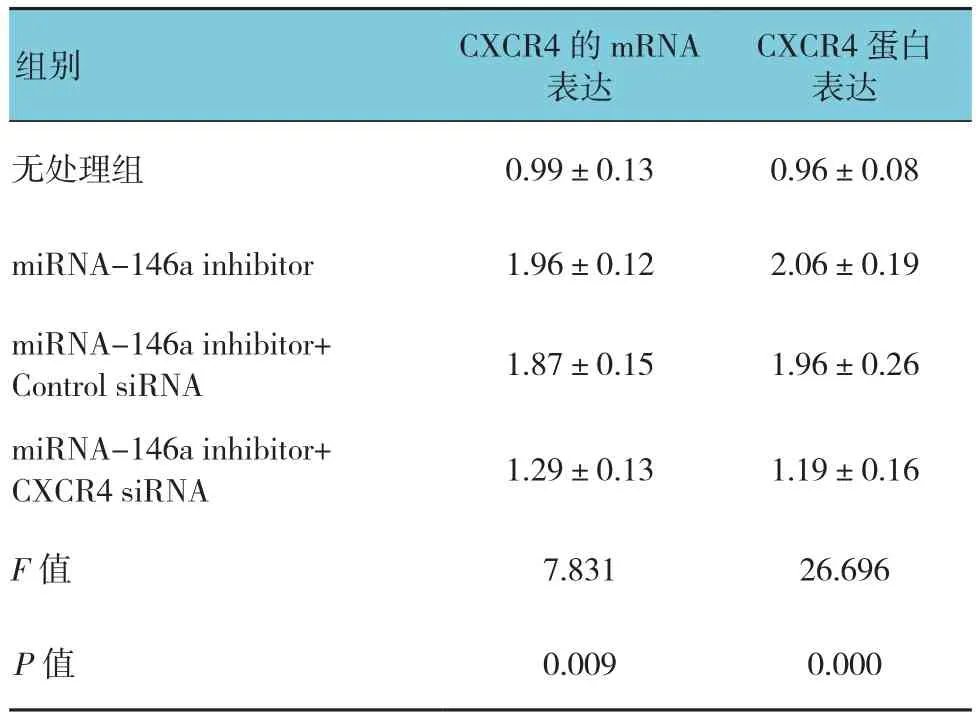
表7 miRNA-146a调节CXCR4对K562细胞ADM 耐药性的影响 (n =3,±s)
CXCR4蛋白表达无处理组 0.99±0.13 0.96±0.08组别 CXCR4的mRNA表达miRNA-146a inhibitor 1.96±0.12 2.06±0.19 miRNA-146a inhibitor+Control siRNA 1.87±0.15 1.96±0.26 miRNA-146a inhibitor+CXCR4 siRNA 1.29±0.13 1.19±0.16 F值 7.831 26.696 P值 0.009 0.000
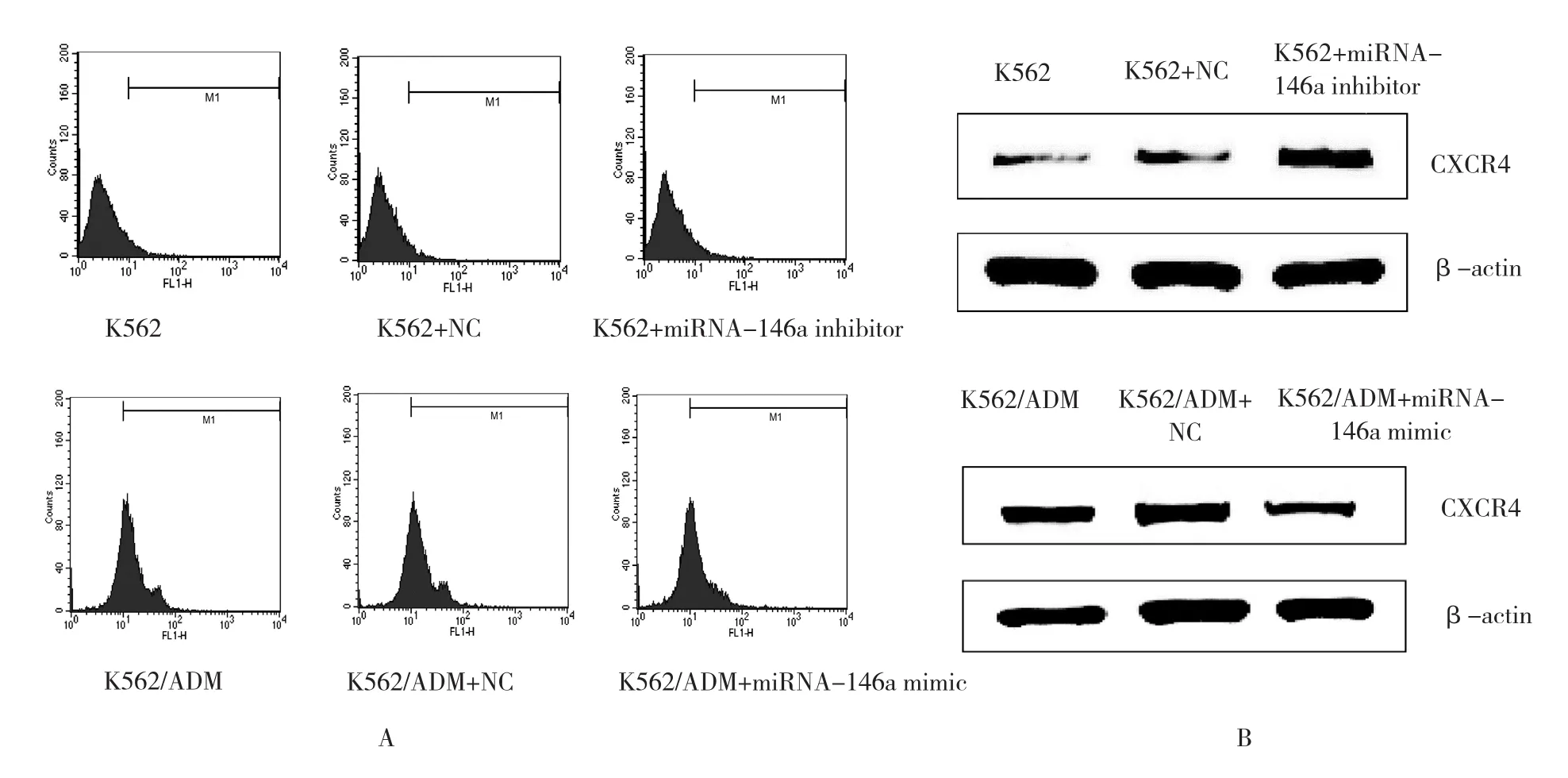
图3 CXCR4在K562或K562/ADM细胞中的表达及与miRNA-146a表达的关系

图4 miRNA-146a inhibitor转染的K562细胞中CXCR4的蛋白表达经CXCR4 siRNA降低
表8 miRNA-146a及CXCR4对K562细胞凋亡及活性的影响 (n =3,%,±s)
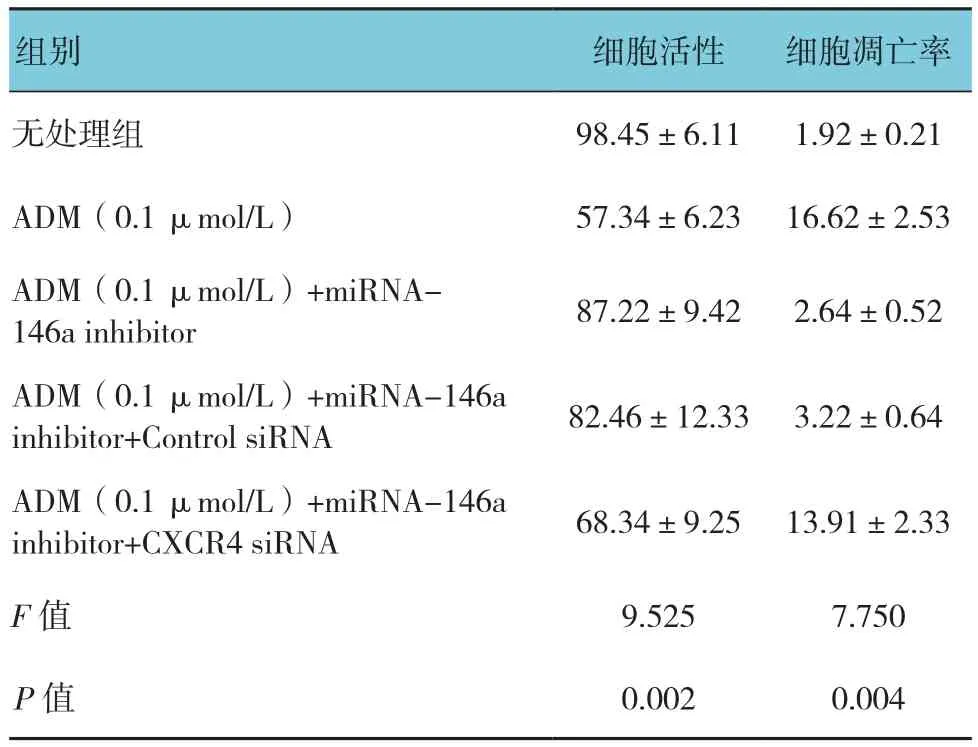
表8 miRNA-146a及CXCR4对K562细胞凋亡及活性的影响 (n =3,%,±s)
组别 细胞活性 细胞凋亡率无处理组 98.45±6.11 1.92±0.21 ADM(0.1 μmol/L) 57.34±6.23 16.62±2.53 ADM(0.1 μmol/L)+miRNA-146a inhibitor 87.22±9.42 2.64±0.52 ADM(0.1 μmol/L)+miRNA-146a inhibitor+Control siRNA 82.46±12.33 3.22±0.64 ADM(0.1 μmol/L)+miRNA-146a inhibitor+CXCR4 siRNA 68.34±9.25 13.91±2.33 F值 9.525 7.750 P值 0.002 0.004
2.6 大黄素甲醚调节miRNA-146a和干预CXCL 12/CXCR4信号对K562/ADM细胞耐药的影响
结果表明,大黄素甲醚干预能导致K562/ADM细胞中miRNA-146a水平呈剂量依赖性增加,见表12。除此以外,本研究结果还表明大黄素甲醚增强敏感性的作用经miRNA-146a inhibitor干预后几乎完全消失,表明大黄素甲醚通过调节miRNA-146a逆转K562/ADM细胞的多药耐药(见表13和图8)。与大黄素甲醚对miRNA-146a的影响相一致,大黄素甲醚干预导致K562/ADM细胞中趋化因子受体CXCR4的表达呈剂量依赖性降低(见表14和图9)。另外,迁移试验结果显示经大黄素甲醚干预后迁移受损(见表15和图10)。大黄素甲醚通过上调miRNA-146a调节CXCR4的表达且干扰CXCR12与CXCR4的结合。

图5 miRNA-146a及CXCR4对K562细胞凋亡的影响

图6 单细胞克隆实验检测大黄素甲醚联合ADM对K562/ADM细胞活性的影响
表9 不同浓度的大黄素甲醚对K562/ADM细胞活性的影响 (n =3,±s)

表9 不同浓度的大黄素甲醚对K562/ADM细胞活性的影响 (n =3,±s)
大黄素甲醚的浓度 细胞活性/%0 μmol/L 96.21±5.01 2 μmol/L 92.03±7.32 5 μmol/L 84.12±6.45 10 μmol/L 77.08±10.34 F值 97.678 P值 0.000
表10 大黄素甲醚联合ADM对K562/ADM细胞活性的影响 (n =3,±s)

表10 大黄素甲醚联合ADM对K562/ADM细胞活性的影响 (n =3,±s)
细胞克隆数无药物组 100±6 ADM(1.5 μmol/L) 78±9 ADM(1.5 μmol/L)+2 μmol/L 大黄素甲醚 62±8 ADM(1.5 μmol/L)组 +5 μmol/L 大黄素甲 42±6 F值 33.382 P值 0.000组别
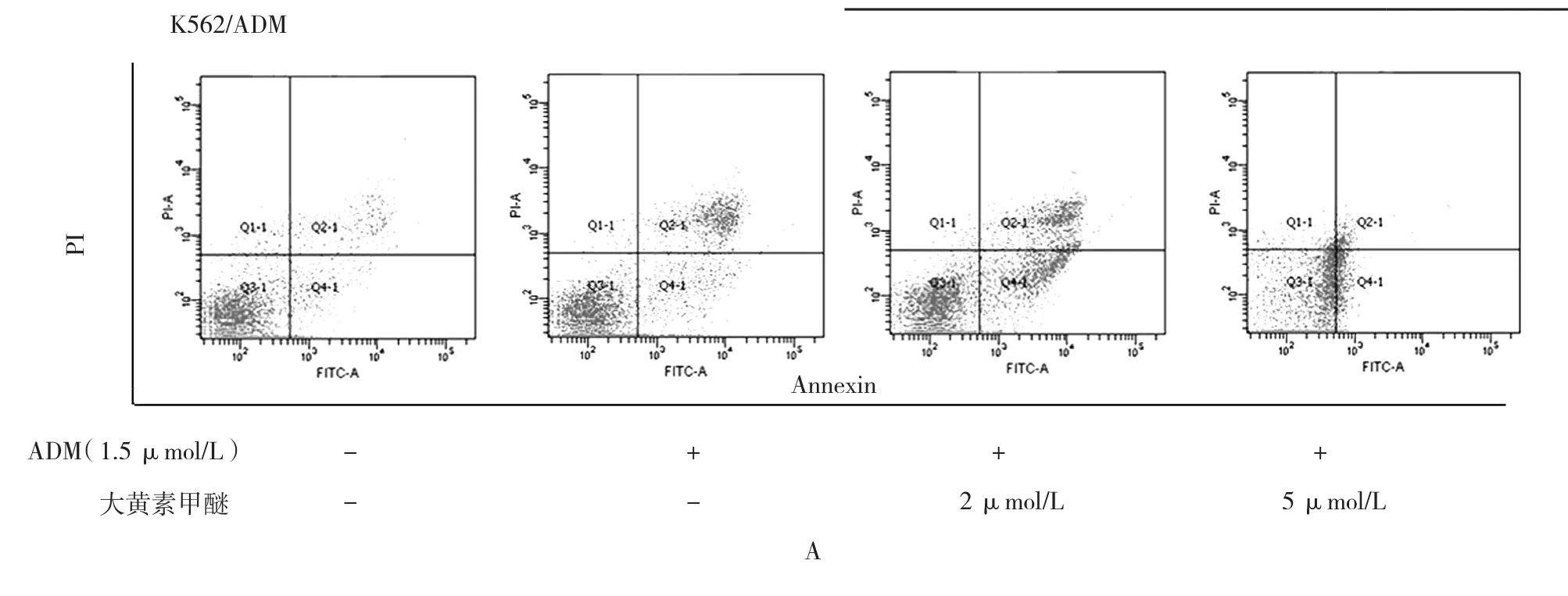

图7 大黄素甲醚联合ADM对K562/ADM细胞凋亡的影响
表11 大黄素甲醚联合ADM对K562/ADM细胞凋亡的影响 (n =3,±s)

表11 大黄素甲醚联合ADM对K562/ADM细胞凋亡的影响 (n =3,±s)
细胞克隆数无药物组 1.61±0.23 ADM(1.5 μmol/L) 12.33±1.62 ADM(1.5 μmol/L)+2 μmol/L 大黄素甲醚 22.43±3.62 ADM(1.5 μmol/L)+5 μmol/L 大黄素甲醚 38.12±5.64 F值 68.015 P值 0.000组别
表12 大黄素甲醚干预下K562/ADM细胞中miRNA-146a miRNA 的相对表达量 (n =3,±s)

表12 大黄素甲醚干预下K562/ADM细胞中miRNA-146a miRNA 的相对表达量 (n =3,±s)
大黄素甲醚的浓度 miRNA-146a miRNA的相对表达量0 μmol/L 1.03±0.12 2 μmol/L 1.26±0.16 5 μmol/L 1.69±0.21 F值 12.011 P值 0.008
表13 K562/ADM细胞中降低miRNA-146a后大黄素甲醚对细胞活性及凋亡的影响 (n =3,±s)
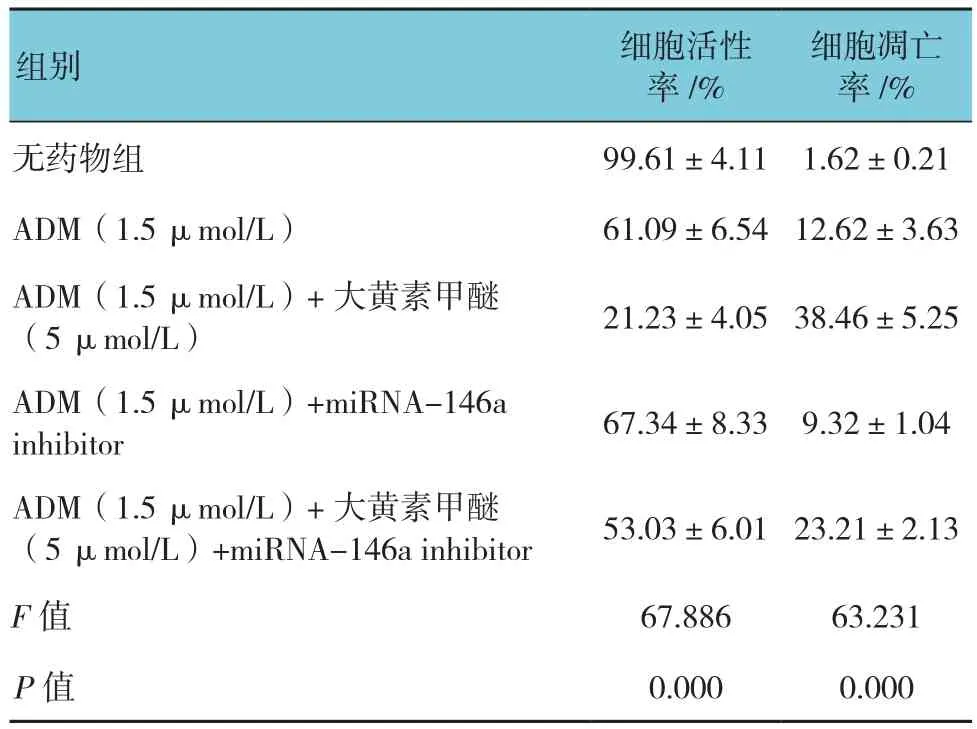
表13 K562/ADM细胞中降低miRNA-146a后大黄素甲醚对细胞活性及凋亡的影响 (n =3,±s)
细胞凋亡率/%无药物组 99.61±4.11 1.62±0.21 ADM(1.5 μmol/L) 61.09±6.5412.62±3.63组别 细胞活性率/%ADM(1.5 μmol/L)+大黄素甲醚(5 μmol/L) 21.23±4.0538.46±5.25 ADM(1.5 μmol/L)+miRNA-146a inhibitor 67.34±8.33 9.32±1.04 ADM(1.5 μmol/L)+大黄素甲醚(5 μmol/L)+miRNA-146a inhibitor 53.03±6.0123.21±2.13 F值 67.886 63.231 P值 0.000 0.000
表14 大黄素甲醚对K562/ADM细胞中CXCR4 表达的影响 (n =3,±s)

表14 大黄素甲醚对K562/ADM细胞中CXCR4 表达的影响 (n =3,±s)
CXCR4的蛋白相对表达量0 μmol/L 0.98±0.02 1.00±0.03 2 μmol/L 0.72±0.16 0.67±0.12 5 μmol/L 0.35±0.04 0.32±0.09 F值 32.685 44.474 P值 0.001 0.000大黄素甲醚的浓度 CXCR4的 mRNA相对表达量

图8 K562/ADM细胞中降低miRNA-146a后大黄素甲醚对ADM诱导的细胞凋亡的影响
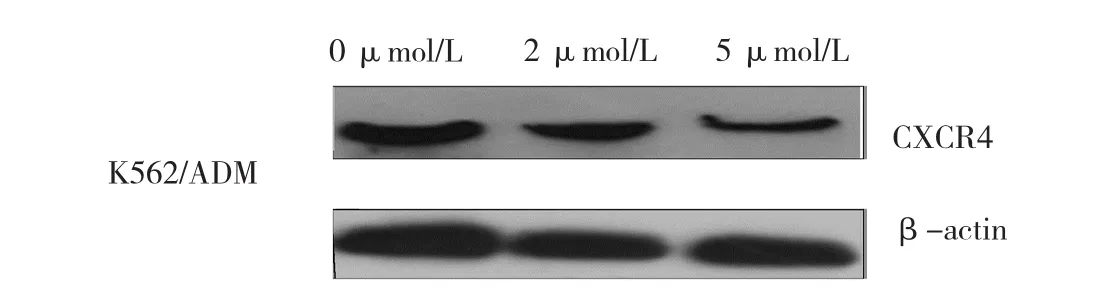
图9 大黄素甲醚对K562/ADM细胞中CXCR4蛋白表达的影响
表15 大黄素甲醚对CXC12和CXCR4结合的影响(n =3,%,±s)

表15 大黄素甲醚对CXC12和CXCR4结合的影响(n =3,%,±s)
细胞迁移率无药物组 100±6 CXCL12(100 ng/ml) 195±21 CXCL12(100 ng/ml)+2 μmol/L 大黄素甲醚 121±16 CXCL12(100 ng/ml)+5 μmol/L 大黄素甲醚 106±9 F值 28.408 P值 0.000组别
3 讨论
作为一组高度保守非蛋白编码的RNAs,miRNA能调节真核细胞中各种各样目标基因的表达,因此,其在细胞增殖、凋亡、发展及分化中具有重要作用。miRNA-146a第1次发现于先天免疫和炎症反应的微生物感染中,现在已经被发现在致癌作用和实体肿瘤的发展和转移中具有重要作用[12-13]。其在基因敲除小鼠骨髓和淋巴恶性肿瘤中已经被发现[14]。GARZON等已经发现miRNA-146a在骨髓CD34+细胞正常的捐赠者中表达相对较高的水平,然而在急性髓系白血病患者中低表达,甚至在来自健康捐赠者的外周血或骨髓中的单核细胞、粒细胞、红细胞、巨核细胞中的表达水平更低[15]。XU等也报道,miRNA-146a作为癌基因在急性早幼粒细胞白血病中的作用及其通过抑制Smad4有助于miRNA-146a的增高[16]。然而,miRNA-146a在CML的作用仍有待阐明。笔者的研究结果表明,miRNA-146a在耐药K562/ADM细胞中的表达低于对药物较敏感的K562细胞,上调miRNA-146a通过抑制趋化因子受体CXCR4的表达能恢复K562/ADM细胞对ADM的敏感性,大黄素甲醚通过上调miRNA-146a抑制CXCR4表达而增加K562/ADM细胞对ADM的敏感性。
越来越多的数据表明,miRNA因为其调节耐药相关基因的能力而参与在化疗耐药的肿瘤治疗中。miRNA-146 a与耐药性肿瘤细胞的相关性也在一些研究中被描述。与MCF-7敏感细胞比较,在顺铂耐药性乳腺癌MCF-7细胞中miRNA-146a上调[17]。在肝癌细胞的一项研究中发现,耐IFN-α细胞中miRNA-146a的表达高于IFN-α敏感细胞[10]。ZHUO等在另一项关于肝癌细胞的研究中报道miRNA-146a在耐药细胞系中上调[18]。在结直肠癌中miRNA-146a的高表达与西妥昔单抗耐药性和预后较差相关[19]。然而,相反的结果报道,miRNA-146a被发现在耐顺铂卵巢癌A2780细胞中低水平表达,尽管miRNA-146a inhibiter无法建立A2780细胞的耐药性[20]。在非小细胞肺癌细胞中miRNA-146a的低表达与前期临床TNM分期及远处转移相关联[21]。另外,最近的研究表明,miRNA-146的药物诱导能增强替莫唑胺诱导人类胶质母细胞瘤细胞凋亡的敏感性[22]。
本研究发现,miRNA-146a在耐ADM的K562细胞中的表达降低。此外,在敏感的K562细胞中转入miRNA-146a inhibiter后表明细胞抵抗ADM诱导凋亡,而转染miRNA-146a mimic的K562/ADM细胞则恢复其对ADM的敏感性。还发现miRNA-146a能提高K562细胞对ADM的耐药性。笔者推测miRNA-146a诱导耐药性的作用在不同肿瘤中有特定的作用。鉴于miRNA-146a在癌细胞中的目标不止1个信号通路,miRNA-146a是否促进或抗耐药可能取决于调节癌细胞的特定关键信号通路。
CXCR4是在造血细胞和上皮癌细胞上表达的趋化因子受体,已经发现其通过调节白血病细胞和间质细胞的相互作用,从而保护白血病细胞免于自发和化疗所致的死亡。因此,CXCR4被认为是影响急性髓系白血病生存和耐药白血病预后的一个关键因素。笔者的研究结果表明miRNA-146a与CXCR4的表达呈负相关。另外,通过下调miRNA-146a建立的K562细胞对ADM的抵抗性可以通过CXCR4 siRNA降低,这表明CXCR4是介导下调miRNA-146a产生ADM耐药结果的关键因素。除此以外,笔者发现miRNA-146a直接针对CXCR4 mRNA的3'-UTR并抑制其表达,与最近的一项研究是一致的[23]。有趣的是,最近的一项研究报道CXCR43'-UTR的过表达抑制miRNA-146a的活性,从而提高乳腺癌MCF-7细胞中CXCR4的表达,表明通过miRNA-146a调节CXCR4可能并是想象的那样简单[10]。然而,miRNA-146a和CXCR4之间更复杂的关系及其在K562细胞耐药性中的作用需要进一步的研究验证。
大黄素甲醚在2005年作为活性成分在多孢菌属的培养中被分离出来。后来的研究发现大黄素甲醚分别在人类乳腺癌细胞和宫颈癌细胞中能够诱导细胞周期阻滞和细胞凋亡[6,8]。另外,ELF等报道大黄素甲醚在裸鼠异种移植中通过抑制6-磷酸葡萄糖脱氢酶抑制癌症细胞增殖和肿瘤生长[24]。在本研究中,笔者为大黄素甲醚对miRNA-146a调节效应及其逆转耐药的能力提供第1个证据,支持天然化合物可以针对多个信号通路发挥抗肿瘤效应的这个概念。
总之,本研究结果表明下调miRNA-146和上调CXCR4可能与K562/ADM细胞的耐药性有关。另外,大黄素甲醚可以通过诱导miR-146a的表达抑制CXCL12/CXCR4信号从而逆转K562/ADM细胞对ADM的耐药性。鉴于大黄素甲醚对正常细胞的毒性较低,其可以考虑作为1个潜在的CML的候选辅助治疗剂。
参 考 文 献:
[1] CAGNETTA A, GARUTI A, MARANI C, et al. Evaluating treatment response of chronic myeloid leukemia: emerging science and technology[J]. Curr Cancer Drug Targets, 2013, 13(7): 779-790.
[2] LUO D, WILSON J M, HARVEL N, et al. A systematic evaluation of miRNA: mRNA interactions involved in the migration and invasion of breast cancer cells[J]. J Transl Med, 2013, 11(1): 57.
[3] ROKAH O H, GRANOT G, OVCHARENKO A, et al.Downregulation of miR-31, miR-155, and miR-564 in chronic myeloid leukemia cells[J]. PLoS One, 2012, 7(4): e35501.
[4] FERREIRA A F, MOURA L G, TOJAL I, et al. ApoptomiRs expression modulated by BCR-ABL is linked to CML progression and imatinib resistance[J]. Blood Cells Mol Dis, 2014, 53(1/2): 47-55.
[5] WIJESEKARA I, ZHANG C, VAN TA Q, et al. Physcion from marine-derived fungus Microsporum sp. induces apoptosis in human cervical carcinoma HeLa cells[J]. Microbiol Res, 2014,169(4): 255-261.
[6] CHEN X, GAO H, HAN Y, et al. Physcion induces mitochondriadriven apoptosis in colorectal cancer cells via downregulating EMMPRIN[J]. Eur J Pharmacol, 2015(764): 124-133.
[7] 陶毅明,洪雪,马义丽,等. 芦荟大黄素联用顺铂对乳腺癌MDA-MB-231细胞增殖和凋亡的影响[J]. 中国实验方剂学杂志, 2015, 21(20): 127-130.
[8] HAN Y T, CHEN X H, GAO H, et al. Physcion inhibits the metastatic potential of human colorectal cancer SW620 cells in vitro by suppressing the transcription factor SOX2[J]. Acta Pharmacol Sin, 2016, 37(2): 264-275.
[9] WANG Y, MIAO H, LI W, et al. CXCL12/CXCR4 axis confers adriamycin resistance to human chronic myelogenous leukemia and oroxylin A improves the sensitivity of K562/ADM cells[J].Biochem Pharmacol, 2014, 90(3): 212-225.
[10] TOMOKUNI A, EGUCHI H, TOMIMARU Y, et al. miR-146a suppresses the sensitivity to interferon-alpha in hepatocellular carcinoma cells[J]. Biochem Biophys Res Commun, 2011, 414(4):675-680.
[11] ZHENG T, CHOU J, ZHANG F, et al. CXCR4 3’UTR functions as a ceRNA in promoting metastasis, proliferation and survival of MCF-7 cells by regulating miR-146a activity[J]. Eur J Cell Biol,2015, 94(10): 458-469.
[12] RAIMO M, ORSO F, GRASSI E, et al. miR-146a exerts differential effects on melanoma growth and metastatization[J].Mol Cancer Res, 2016, 14(6): 548-562.
[13] WANG C, GUAN S, LIU F, et al. Prognostic and diagnostic potential of miR-146a in oesophageal squamous cell carcinoma[J].Br J Cancer, 2016(114): 290-297.
[14] BOLDIN M P, TAGANOV K D, RAO D S, et al. miR-146a is a significant brake on autoimmunity, myeloproliferation, and cancer in mice[J]. J Exp Med, 2011, 208(6): 1189-1201.
[15] GARZON R, VOLINIA S, LIU C G, et al. MicroRNA signatures associated with cytogenetics and prognosis in acute myeloid leukemia[J]. Blood, 2008, 111(6): 3183-3189.
[16] XU L, ZHONG H, WAN H, et al. miR-146a expression level as a novel putative prognostic marker for acute promyelocytic leukemia[J]. Dis Markers, 2014(2014): 150604.
[17] POGRIBNY I P, FILKOWSKI J N, TRYNDYAK V P, et al.Alterations of microRNAs and their targets are associated with acquired resistance of MCF-7 breast cancer cells to cisplatin[J].Int J Cancer, 2010, 127(8): 1785-1794.
[18] ZHUO L, LIU J, WANG B, et al. Differential miRNA expression profiles in hepatocellular carcinoma cells and drug-resistant sublines[J]. Oncol Rep, 2013, 29(2): 555-562.
[19] HWANG W L, JIANG J K, YANG S H, et al. MicroRNA-146a directs the symmetric division of Snail-dominant colorectal cancer stem cells[J]. Nat Cell Biol, 2014(16): 268-280.
[20] LI N, YANG L, WANG H, et al. miR-130a and miR-374a function as novel regulators of cisplatin resistance in human ovarian cancer A2780 cells[J]. PLoS One, 2015, 10(6): e0128886.
[21] CHEN G, UMELO I A, LV S, et al. miR-146a inhibits cell growth,cell migration and induces apoptosis in non-small cell lung cancer cells[J]. PLoS One, 2013, 8(3) : e60317.
[22] WU H, LIU Q, CAI T, et al. Induction of microRNA-146a is involved in curcumin-mediated enhancement of temozolomide cytotoxicity against human glioblastoma[J]. Mol Med Rep, 2015,12(4): 5461-5466.
[23] ALFANO D, GORRASI A, LI SANTI A, et al. Urokinase receptor and CXCR4 are regulated by common microRNAs in leukaemia cells[J]. J Cell Mol Med, 2015, 19(9): 2262-2272.
[24] LIN R, ELF S, SHAN C, et al. 6-Phosphogluconate dehydrogenase links oxidative PPP, lipogenesis and tumour growth by inhibiting LKB1-AMPK signalling[J]. Nat Cell Biol, 2015(17): 1484-1496.

