医院污水中碳青霉烯不敏感菌多样性及碳青霉烯耐药基因研究
张馨琢,江 南,黄永茂,周英顺
(西南医科大学:1基础医学院病原生物学教研室;2国际教育学院大二教研室;3基础医学院生理学教研室;4附属医院感染科,四川泸州 646000)
碳青霉烯类药物是治疗革兰阴性细菌尤其是肠杆菌科细菌感染的最后可选择药物,但由于近年广泛使用,也导致对碳青霉烯抗生素产生了耐药,主要由于出现水解该类抗生素的酶,包括blaOXA型碳青霉烯酶,金属β-内酰胺酶(blaNDM、blaIMP和blaVIM),A类碳青霉烯酶(blaKPC和blaGES)[1]。研究发现,医院污水中富集了来自临床的大量耐药细菌和用于治疗感染的残留抗菌药物,使医院污水集聚了高密度的耐药菌和抗菌药物,成为耐药基因的储蓄池[2]。医院污水中存在碳青霉烯不敏感菌株多样性和耐碳青霉烯耐药基因如何,目前不清楚。本研究拟探索医院污水中碳青霉烯不敏感细菌种类和主要的碳青霉烯酶基因型。
1 材料与方法
1.1 试剂与材料
胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(TSB)、LB固体培养基、LB营养琼脂、M-H肉汤均购自Solarbio北京索莱宝科技有限公司;DNA聚合酶Ex Taq、Premix TaqTM、dNTP Mixture、DNA Marker、琼脂糖均购自TakaRa大连宝生物有限公司;引物合成及测序由上海生工技术有限公司完成。
1.2 实验菌株来源和鉴定
2017年7 月于西南医科大学附属医院污水站进水口采集原水1 000 mL,充分混匀后作1∶10稀释,取100 μL涂布于含1 mg/L美罗培南(倍能,深圳海滨制药有限公司)的产色平板(CHROM Agar,科玛嘉,法国),37℃孵育过夜,筛选出对美罗培南敏感性降低(MIC>4 mg/L)的污水细菌16株。采用煮沸法提取细菌DNA。菌种鉴定选用通用引物27F和1492R通过对16S rRNA基因的部分测序,以及引物UP-1和UP-2r对gryB基因的测序完成[3-4]。扩增产物送上海生工生物有限公司进行序列测定,所获基因序列通过GenBank、EzTaxon6和LeBIBI数据库(https://umr5558-bibiserv.univ-lyon1.fr/lebibi/lebibi.cgi)检索鉴定污水菌种。
1.3 污水菌株的MIC值测定
采用微量肉汤稀释法测定16株污水菌株对亚胺培南西司他丁和美罗培南的MIC值。质控菌株大肠埃细菌ATCC25922。结果依照美国临床实验室标准化研究所(CLSI)2016年版规定的标准判读。
1.4 污水菌株的耐药基因检测
采用煮沸法制备模板DNA。PCR扩增A类碳青霉烯酶编码基因blaGES[5]、blaKPC[6]和新德里金属β-内酰胺酶编码基因blaNDM-1。多重PCR扩增OXA型碳青霉烯酶编码基因(blaOXA-51、blaOXA-23、blaOXA-24、blaOXA-58、blaOXA-143)[7-8]和金属β-内酰胺酶的编码基因(blaIMP、blaVIM、blaSPM、blaGIM、blaSIM)[9]。PCR反应体系及反应条件如参考文献所述。对多重PCR扩增产物经电泳显示有阳性目标条带的菌株,再通过单一PCR验证。目的基因阳性的PCR产物全部送上海生工技术有限公司测序。PCR引物见表1。
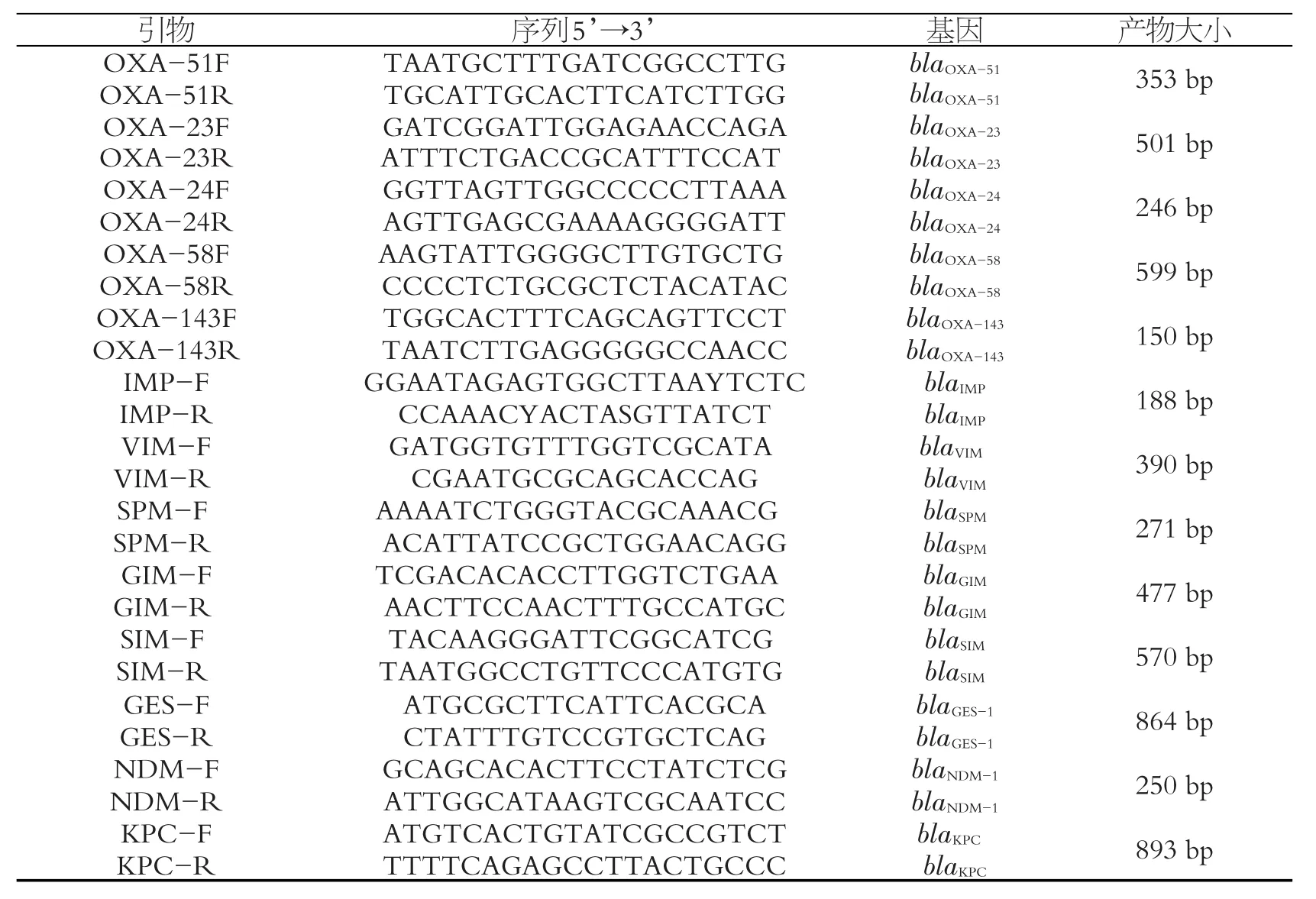
表1 各目的基因PCR扩增引物序列及PCR产物片段长度
2 结果
2.1 医院污水菌株分离、鉴定及MIC值
从医院污水中分离出对碳青霉烯类敏感性降低的污水菌株共16株,通过16S序列测定和Genbank,EzTaxon6和LeBIBI数据库在线比对,发现4株不动杆菌属,其中3株约氏不动杆菌属(H4、H6、H7),1株溶血不动杆菌(H5);4株气单胞菌属,包括2株嗜水气单胞菌(L1、L3),2株豚鼠气单胞菌(L2、L4);2株睾丸酮丛毛单胞菌(H2、H3);4株屎肠球菌(SL1、SL2、SL3、SL4);2株嗜麦芽窄食单胞菌(B1、B2)。MIC及细菌形态特征见表2。
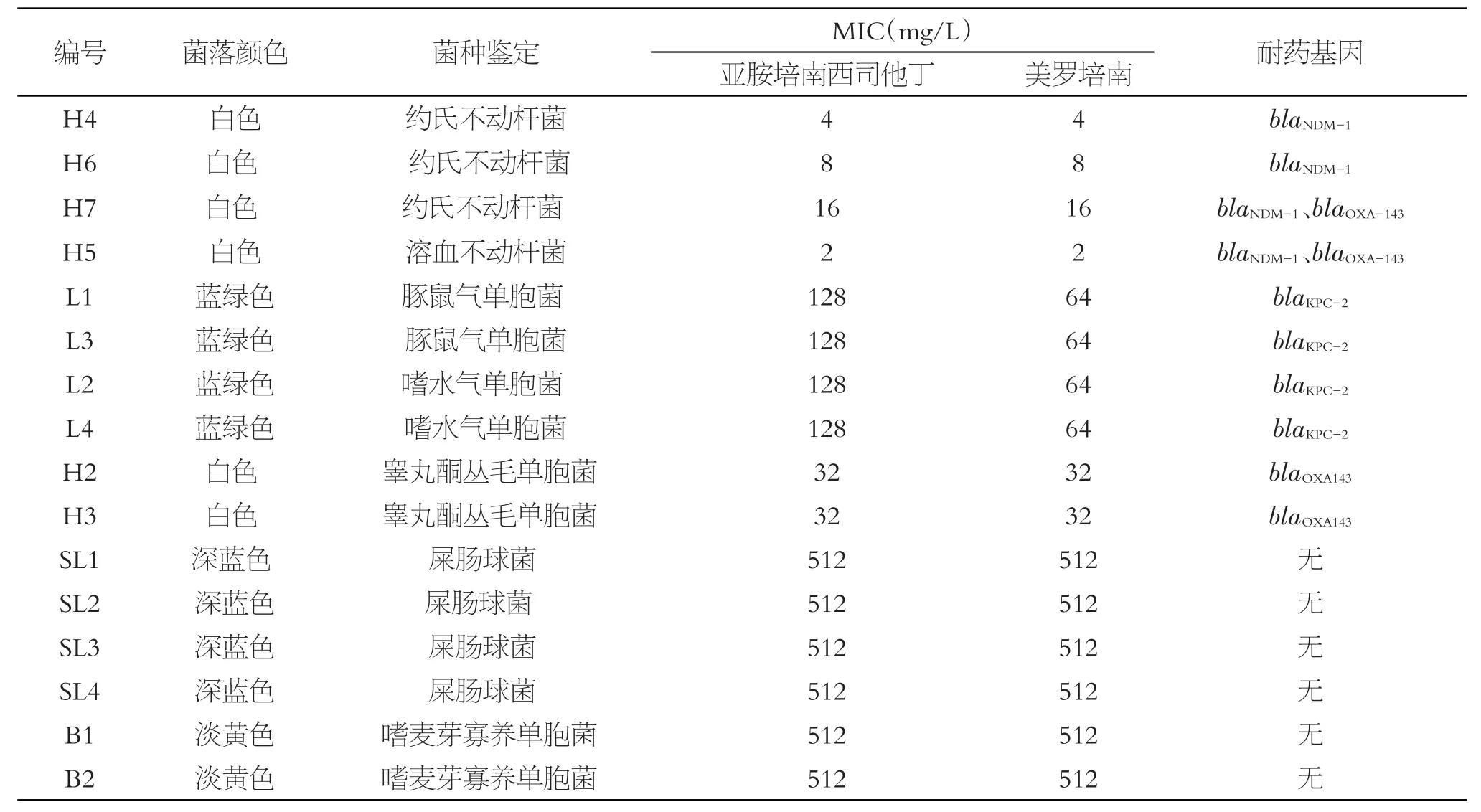
表2 污水菌株的菌种鉴定及MIC值测定
2.2 污水菌株的耐药基因检测
16株对碳青霉烯类敏感性降低的污水菌株中,有4株不动杆菌属(H4、H5、H6、H7)均检测出携带新德里金属β-内酰胺酶编码基因blaNDM-1,4株气单胞菌属(L1、L3、L2、L4)均检测出携带A类碳青霉烯酶编码基因blaKPC-2,2株睾丸酮丛毛单胞菌(H2、H3)和2株不动杆菌属(H5、H7)携带有blaOXA143耐药基因。在所有菌株中均未检测到blaOXA和blaGES型产碳青霉烯酶耐药基因。
3 讨 论
碳青霉烯类抗生素已经成为临床治疗革兰氏阴性杆菌的最后可选择药物,对产碳青霉烯耐药性的监控对细菌耐药性的防治具有重要意义。本研究从医院污水中分离出16株碳青霉烯类不敏感菌株,发现4株不动杆菌,2株嗜水气单胞菌,2株豚鼠气单胞菌,2株睾丸酮丛毛单胞菌,4株屎肠球菌,2株嗜麦芽窄食单胞菌。研究发现所分离菌均为条件致病菌,如不动杆菌属[11]、屎肠球菌,嗜麦芽窄食单胞菌为临床常见条件致病菌。豚鼠气单胞菌主要引起人类和动物的腹泻,在全世界许多国家都有发现,豚鼠气单胞菌可粘附在人或动物的肠上皮细胞上并聚集成团,形成生物被膜,从而导致肠上皮细胞的破损,引起腹泻。除肠道外,豚鼠气单胞菌还能损伤人和动物的肝、肺、肾等重要器官以及肌肉组织等[12]。2015年Lopes AC等报道了巴西一起由豚鼠气单胞菌产生耐热肠毒素引发的腹泻在人群中的爆发流行[13]。嗜水气单胞菌广泛分布于自然界的各种水体,是典型的人-兽-鱼共患病病原菌,可以产生溶血素、组织毒素、坏死毒素、肠毒素、蛋白酶等外毒素,主要通过粘附人和动物的肠道组织引发感染。通常具有高粘附力的嗜水气单胞菌株同时也能产生毒性很强的外毒素,从而导致暴发性出血病。睾丸酮丛毛单胞菌,主要引起呼吸道感染。通过ERIC-PCR对所分离细菌进行克隆相似性分析,所分离细菌为不同克隆类型,表明了医院污水中存在条件致病菌多样性。
通过耐药基因检测发现,4株不动杆菌属(H4~7)均检测出携带新德里金属β-内酰胺酶编码基因blaNDM-1。近年来,国内blaNDM-1相关报道逐渐增多,但多见于临床菌株。携带blaNDM-1的污水菌株是否也来源于临床,其毒力因子是否增强,值得进一步关注和研究。在4株气单胞菌属[2株嗜水气单胞菌(L1、L3),2株豚鼠气单胞菌(L2、L4)]均检测出携带A类碳青霉烯酶编码基因blaKPC-2。国内blaKPC-2相关报道较多,但气单胞菌检测及相关报道较少。在2株睾丸酮丛毛单胞菌(H2,H3)和2株不动杆菌属(H5,H7)携带有blaOXA143耐药基因,此外还有6株对亚胺培南等碳青霉烯类天然耐药的屎肠球菌和嗜麦芽寡养单胞菌,结果表明医院污水中存在耐药基因多样性。
4 结论
总之,本研究从医院污水中检测到对碳青霉烯类敏感性降低的5个属16株细菌携带blaNDM-1、blaK⁃PC-2、blaOXA-143等能水解碳青霉烯类的耐药基因。表明医院污水碳青霉烯不敏感菌菌株多样性和细菌耐药基因多样性,表明医院污水是重要但常常被忽视的耐药菌株和耐药基因的储蓄池,应该受到更多关注。
1. Zhang X,Lu X,Zong Z.Enterobacteriaceae producing the KPC-2 carbapenemase from hospital sewage[J].Diag⁃nostic microbiology and infectious disease,2012,73(2):204-206.
2. Marathe NP,Pal C,Gaikwad SS,et al.Untreated urban waste contaminates indian river sediments with resistance genes to last resort antibiotics[J].Water research,2017,124:388-397.
3. Sabat AJ,van Zanten E,Akkerboom V,et al.Targeted next-generation sequencing of the 16s-23s rRNA region forculture-independentbacterialidentification- in⁃creased discrimination of closely related species[J].Scien⁃tific reports,2017,7(1):3 434.
4. Yamamoto S,Harayama S.PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Seu⁃domonas putida strains[J].Appl Environ Microbiol,1995,61(3):1 104-1 109.
5. Poirel L,Le Thomas I,Naas T,et al.Biochemical se⁃quence analyses of GES-1,a novel class a extended-spec⁃trum beta-lactamase,and the class 1 integron In52 from Klebsiella pneumoniae[J].Antimicrob Agents Chemoth⁃er,2000,44(3):622-632.
6. Poirel L,Lienhard R,Potron A,et al.Plasmid-mediated carbapenem-hydrolysing β -lactamase KPC-2 in a Kleb⁃siella pneumoniae isolate from Switzerland[J].J Antimi⁃crob Chemother,2011,66(3):675-676.
7. Woodford N,Ellington MJ,Coelho JM,et al.Multiplex pcr for genes encoding prevalent OXA carbapenemases in acinetobacter spp[J].International Journal of Antimicrobi⁃al Agents,2006,27(4):351-353.
8. HigginsPG,Lehmann M,SeifertH.Inclusion of OXA-143 primers in a multiplex polymerase chain reac⁃tion(PCR)for genes encoding prevalent OXA carbapene⁃mases in acinetobacter spp[J].Int J Antimicrob Agents,2010,35(3):305.
9. Ellington MJ,Kistler J,Livermore DM,et al.Multiplex pcr for rapid detection of genes encoding acquired metal⁃lo-beta-lactamases[J].The Journal of antimicrobial che⁃motherapy,2007,59(2):321-322.
10. Versalovic J,Koeuth T,Lupski JR.Distribution of repeti⁃tive DNA sequences in eubacteria and application to fin⁃gerprinting of bacterial genomes[J].Nucleic Acids Res,1991,19(24):6 823-6 831.
11. 张金平,周英顺,王光西,等.耐碳青霉烯类鲍曼不动杆菌ESBLs耐药基因分析[J].西南医学大学学报,2017,40(1):35-38.
12. Padilla JC,Bustos P,Castro-Escarpulli G,et al.Draft ge⁃nome sequence of aeromonas caviae strain 429865 inp,isolated from a mexican patient[J].Genome Announc.2015,3(5):e01240-15.
13. Lopes AC,Martins LM,Gatti MS,et al.Diarrhea out⁃break in pernambuco,brazil,associated with a heat-stable cytotoxic enterotoxin produced by aeromonas caviae[J].Rev Inst Med Trop Sao Paulo,2015,57(4):349-351.

