高氧对宫内缺氧新生大鼠海马齿状回血管内皮生长因子表达的影响
蒋丽雯,刘 铫,何 丹,郝 雯,李军成,余 鸿
(西南医科大学:1临床医学院2013级本科;2组胚教研室,四川泸州 646000)
宫内缺氧在胚胎发育期很常见,是影响胚胎发育的重要因素,通常会引起新生儿缺氧缺血性脑病,可能导致急性脑损伤、随后的认知缺陷和儿童癫痫的发生。神经细胞对缺氧较为敏感,尤其是海马区神经元对缺氧极为敏感。因此,研究缺氧对海马神经元的影响具有重要意义。血管内皮生长因子(vascular endothelial growth factor,VEGF)可促进血管再生,故在神经系统损伤修复过程中VEGF具有十分重要的作用。宫内缺氧在临床治疗上还未有特异性药物,而高氧治疗不乏为较好的一般治疗措施,但其治疗机制还未阐明。为此,本实验通过建立宫内缺氧模型,检测宫内缺氧后新生大鼠海马区VEGF表达的变化,并观察高氧治疗后的VEGF表达变化,从而探讨高氧对宫内缺氧的治疗作用机制,为临床宫内缺氧的治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
体重230~260 g的15只成年雌性SD大鼠和3只成年雄性SD大鼠由西南医科大学动物中心提供(一级实验动物,许可证号:川实动管质第17号)。
1.1.2 主要试剂及仪器
小鼠抗VEGF一抗、生物素化羊抗鼠二抗(SABC)试剂盒,多聚赖氨酸(Poly-L-Lysine)、DAB显色试剂盒(棕黄色)均购自武汉博士德生物工程有限公司。德国Leica RM2245电动切片机,美国REV⁃CO公司的三气培养箱,日本Olympus公司的Ax-70荧光显微成像系统,Media Cybernetics公司的Im⁃age-Pro Plus6.0图像分析系统。
1.2 方法
1.2.1 动物配种、饲养、分组
健康成年雌性SD大鼠15只,每只先后分别与一只雄鼠合笼饲养配种,第二日早晨发现雌鼠阴栓记为雌鼠妊娠0 d,取出雌鼠,单独饲养至孕期15 d。将15只孕鼠随机分为:对照组(CG组)、缺氧组(HG组)和高氧组(HOG组),每组5只。
1.2.2 动物造摸
自孕15 d开始将缺氧组和高氧组孕鼠置于三气培养箱中(事先设置氧浓度130 mL/L,二氧化碳浓度0.3~0.4 mL/L,相对湿度 75% ~80%,温度250C),缺氧2 h/d,连续缺氧5 d(孕15~19 d)。高氧组孕鼠每次缺氧后在正常环境生活1 h后再次放入三气培养箱中(设置氧浓度500 mL/L,二氧化碳浓度0.3~0.4 mL/L,相对湿度75%~80%,温度250C)。对照组不缺氧也不用高氧治疗。3组孕鼠待其自然分娩(第21 d),每只孕鼠可产新生鼠5~8只。
1.2.3 取材、石蜡切片、免疫组化
每窝新生鼠随机选取4只,取其大脑组织(每组均可得20个大脑组织),分别放入40 g/L的多聚甲醛中固定60 min。常规石蜡包埋、经海马冠状切面切片(片厚4 μm),各切片作VEGF(一抗浓度1∶400)免疫组化染色(SABC法),DAB显色。
1.2.4 照相、图像分析
应用Olympus Ax-70荧光显微成像系统对各免疫组化染色切片照相,应用Image-Pro Plus 6.0图像分析系统对每张VEGF免疫组化200倍照片均在海马齿状回相同视野选取相同大小的区域进行图像分析,统计每张切片的阳性细胞的IOD值。
1.3 数据分析
用SPSS 16.0统计软件包进行统计分析,计量资料用±s(均数±标准差)表示,3组间的比较采用单因素方差分析,每两组间的比较用LSD检验,P<0.05为有统计学意义。
2 结 果
对照组VEGF阳性细胞胞质染为棕黄色,细胞大而圆,在齿状回主要分布于锥体细胞层,该层细胞主要是神经细胞,分布较集中;与对照组相比,缺氧组VEGF阳性细胞的分布无变化,但阳性细胞数量较对照组增多、染色增强,其积分光密度值增大(P<0.05)。高氧组VEGF阳性细胞分布也与对照组相似,与缺氧组相比,数量变化不明显,但染色明显增强,其积分光密度值均增大(P<0.05)。见图1、表1。
表1 3组VEGF阳性细胞IOD值±s)
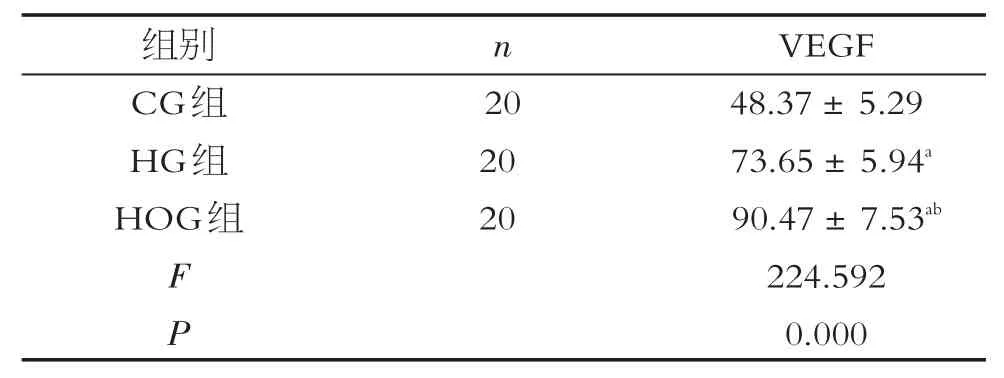
表1 3组VEGF阳性细胞IOD值±s)
注:a与CG组比较,P<0.05;b与HG组比较,P<0.05。
组别CG组HG组HOG组n 20 20 20 FP VEGF 48.37±5.29 73.65±5.94a 90.47±7.53ab 224.592 0.000
3 讨 论
VEGF作为一种调节性蛋白,广泛存在于机体多种组织、器官内,具有神经营养和神经保护作用。在应激状态下,可通过促进血管内皮细胞增殖、增强血脑屏障对葡萄糖的通透性以及抗氧化等作用抑制神经细胞凋亡、促进神经再生。杨瑶瑶等[1]通过采用CoC12构建Hela细胞体外缺氧微环境模型,应用实时荧光定量PCR法和免疫细胞化学技术发现人宫颈癌Hela细胞的VEGF-mRNA和VEGF蛋白的表达随着缺氧时间(3~24 h)的增加而逐渐增加。Troll⁃mann等[2]研究表明,缺氧可刺激大脑皮层、海马及胎盘缺氧诱导因子(hypoxia-inducible factor,HIF)的表达增高。万绍勇等[3]研究发现新生儿发生窒息所致新生儿大脑缺氧、缺血后,脑组织中VEGF水平明显升高,且因新生儿血脑屏障发育还不完善,故VEGF能够较早地释放入血。也有研究表明,在新生大鼠急性缺血缺氧后,大鼠大脑侧脑室会出现短时间内上调的 VEGF 表达[4]。最近,SatriotomoI等[5]研究发现,急性间歇性缺氧可增强脊髓非呼吸运动神经元VEGF的免疫活性,并提示急性间歇性缺氧可能成为治疗脊髓损伤和运动神经元疾病等的治疗手段;Rodriguez-Alvarez等[6]也发现,新生7 d的大鼠全脑缺氧(5%的氧气)15 min,可致大鼠海马体VEGF的表达增加。说明缺氧可刺激神经组织内VEGF的表达,而VEGF的高表达,又是神经组织内血管内皮存活和增生的中心环节,从而促使神经元及神经胶质细胞再生,因此,VEGF的高表达是整个大脑缺氧缺血损伤后修复的关键。不仅如此,Plaschke等[7]还证实了VEGF的高表达在大鼠空间学习和记忆等认知功能上有保护作用。在本实验中,胞质染为棕黄色的VEGF阳性细胞大而圆,主要分布于齿状回锥体细胞层,而该层细胞主要为神经细胞;有宫内缺氧的新生大鼠海马齿状回VEGF表达较对照组新生大鼠明显增高,说明缺氧刺激所致的VEGF高表达可能是机体抵抗缺氧的一种自我保护机制,通过VEGF的高表达而刺激局部组织的血管增生、使局部神经组织的血-脑屏障对血液中葡萄糖的通透性增高,从而抑制神经细胞凋亡,而达到自我保护的状态。
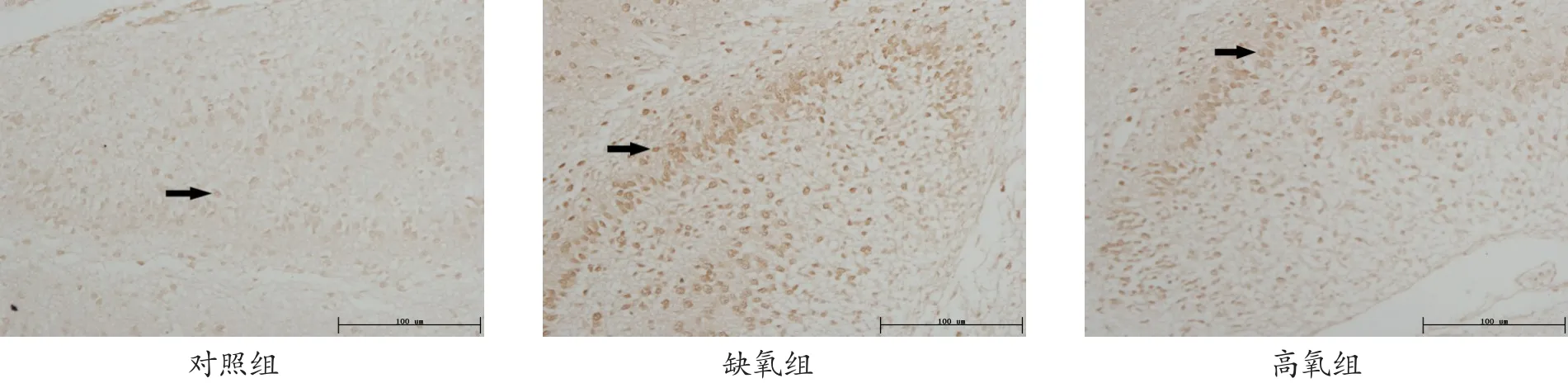
图1 3组新生大鼠海马齿状回VEGF表达变化(SABC法,×200)
王涛[8]的研究表明,高压氧干预能够实现脊髓损伤大鼠脊髓组织内VEGF的高表达,延长VEGF高表达的时间,从而发挥神经保护作用。本实验中应用高氧治疗后,新生大鼠海马齿状回VEGF表达又较缺氧组有进一步的增高,说明缺氧所致的VEGF表达增加尚不足以抵抗由于持续5 d(2 h/d)的宫内缺氧(130 mL/L)所导致的神经损伤作用,而通过高氧治疗使VEGF的表达进一步增高,从而增强了神经保护及修复作用,进一步刺激损伤区的血管发生以改善局部的缺血、缺氧环境,最终达到一种治疗的效果。
4 结 论
宫内缺氧可促进新生大鼠海马齿状回区VEGF的表达,高氧治疗可进一步增强该区神经组织VEGF的表达。
1. 杨瑶瑶,陈丽,龚莉,等.缺氧微环境对宫颈癌Hela细胞HIF-1α及VEGF-A表达的影响[J].西南医科大学学报,2017,40(2):123-127.
2. Trollmann R,Strasser K,Keller S,et al.Placental HIFs as markers of cerebral hypoxic distress in fetal mice[J].Am J Physiol Regul Integr Comp Physiol,2008,295(6):1 973-1 981.
3. 万绍勇,明靖淞,蓝照,等.关于新生儿缺氧缺血性脑病患儿VEGF、CK及CK-BB检测的临床价值[J].中国民康医学,2016,28(12):46-47.
4. Bain J M,Moore L,Ren Z,et al.Vascular endothelial growth factors-A and C are induced in the SVZ follow⁃ing neonatal hypoxia—ischemia and exert diferent effects on neonatal glial progenitors[J].Transl Stroke Res,2013,4(2):158-170.
5. SatriotomoI,Nichols NL,Dale EA.et al.Repetitive acute intermittent hypoxia increases growth/neurotrophic factor expression in non-respiratory motor neurons[J].Neuroscience,2016,322:479-488.
6. Rodriguez-Alvarez N,Jimenez-Mateos EM,Dunleavy M.et al.Effects of hypoxia-induced neonatal seizures on acute hippocampal injury and later-life seizure susceptibil⁃ity and anxiety-related behavior in mice[J].Neurobiol Dis,2015,83:100-114.
7. Plaschke K,Staub J,Ernst E,et al.VEGF overexpression improves mice cognitive abilities after unilateral common carotid artery occlusion[J].Exp Neurol,2008,214(2):285-292.
8. 王涛.高压氧干预对大鼠脊髓继发性损伤中HIF—lα及VEGF表达的影响[J].现代中西医结合杂志,2015,24(22):2 403-2 405.

