绿竹侧枝扦插生根机理研究
凡莉莉,薛 磊,荣俊冬,姚 旺,郑郁善,苏小青
(1. 福建农林大学 林学院,福建 福州 350002;2. 福建农林大学 园林学院,福建 福州 350002)
绿竹Dendrocalamopsis oldhami是禾本科Gramineae绿竹属Dendrocalamopsis竹类,是我国著名的笋材两用大型丛生竹,栽培存活率高,产量大,收益高,具有可观的经济利用价值和生态功能的发展潜力。传统丛生竹造林以蔸带竿移植为主,具有破坏原竹丛生长和发笋能力的风险,存在运输和栽植不便,不利于丛生竹生产扩展等问题。扦插作为竹子营养繁殖技术之一,具有简单方便、成本低和大规模生产等特点。目前关于丛生竹扦插报道多集中在扦插基质[1]、生长调节剂[2]、扦插时间[3]、扦插枝条年龄[4]等方面,对绿竹扦插的研究也集中于扦插育苗技术[5-7]方面,而关于绿竹扦插生根过程中营养物质和抗氧化酶类活性的研究为空白。因此,研究了ABT1处理对绿竹侧枝扦插生根过程中主要代谢物质含量和抗氧化酶活性变化的影响,揭示生根过程中,扦插苗物质代谢特征、耐受胁迫的机制,阐明绿竹扦插苗的生根机理,旨在为丛生竹繁殖体系优化和规模化育苗提供理论依据和技术指导。
1 材料与方法
1.1 试验地概况
试验地设在福建农林大学竹类研究所试验地,地理坐标119°13′51.18″ E,26°05′4.35″ N,属于亚热带季风性气候,年平均日照数1 700 ~ 1 980 h,年平均降水量900 ~ 2 100 mm,年平均气温16 ~ 20℃,无霜期达360 d以上。
1.2 试验设计
2015年11月初,以福建省漳州市东山县赤山国有林场2年生绿竹的侧枝为实验材料,选择健康、无病虫害、枝条粗壮、枝和叶色鲜绿、芽饱满的粗壮侧枝。剪掉枝梢,插条长3 ~ 4节左右,保留2对健康叶片,每片叶片保留 1/2左右以减少蒸腾作用,侧枝基部通过脱脂棉吸水保湿处理,带回福建农林大学竹类研究所,当日进行扦插处理。用600 mg·L-1的ABT1号处理浸泡插条基部,处理时间为5 min,以黄泥土:泥炭土(1:1)为扦插基质,进行扦插。按照随机区组试验设计,3次重复,每重复200根插穗。
扦插前,用多菌灵粉2.5 g·m-2对育苗基质进行消毒,将处理好的插条垂直插入基质并压实。扦插深度为2 ~3节,插床进行遮阴处理。最高温度控制在35℃以下,相对湿度保持在85%以上,每日9:00-10:00时定时喷雾,开始生根后适当延长喷雾天数。每隔7 ~ 10 d在插床及周围喷洒800倍多菌灵溶液1次,防止病虫害。ABT1号生根粉由上海伊卡生物技术有限公司生产,多菌灵粉由四川国光农业股份有限公司生产。
1.3 测定指标及方法
1.3.1 生根特性 11月初扦插,在扦插当日插条经ABT1处理后取样,之后,每隔7 d取样1次,每次每区随机抽取10根插条,共取样6次。取出插条后,用超纯水将枝蔸冲洗干净进行生根形态观察。在扦插35 d后,统计插条生根率、不定根数和不定根根长。
1.3.2 营养物质与酶活性测定 扦插当日取样1次后,每隔7 d取样一次,每次每区随机抽取10根插条,共取样6次。取出插条后,超纯水冲洗干净,将枝蔸进行冰浴,剥取枝蔸的嫩芽,混合后分为3组,用液氮冷冻后置于超低温冰箱中保存,用于相关生理生化指标测定。
可溶性糖含量采用蒽酮比色法[8]测定;可溶性蛋白含量采用考马斯亮蓝法[8]测定;过氧化物酶(POD)活性采用愈创木酚比色法[9]测定;吲哚乙酸氧化酶(IAAO)活性采用邻苯二酚比色法[10]测定;多酚氧化酶(PPO)和超氧化物歧化酶(SOD)活性采用南京建成试剂盒测定。
1.3 数据处理
实验数据采用Microsoft Excel 2010进行统计分析;采用SPSS 19.0软件进行方差分析,在α= 0.05和α= 0.01水平下进行差异显著性检验。
2 结果与分析
2.1 绿竹侧枝扦插生根类型的确定
由图1表明,绿竹侧枝扦插14 d后,枝蔸节上不定根原基开始萌发。14 ~ 21 d,竹蔸节上出现较短的不定根。21 d后,不定根继续生长,最长的能达到3 ~ 7 cm。35 d后进行生根指标全面调查,ABT1号处理插条生根率最高可达57.25%;生根插条不定根根数范围为21 ~ 79条;平均根数为49条;不定根根长范围为1 ~ 7 cm。观察竹子的扦插生根过程中,插条的切口没有发生明显的变化,绿竹扦插生根属于潜伏不定根原基生根型。根据生根特点,将不定根的形成划分为3个阶段,即不定根诱导阶段(0 ~ 14 d)、不定根表达阶段(14 ~ 21 d)和不定根伸长阶段(21 ~ 35 d)。

图1 绿竹生根过程Figure 1 Rooting process of D. oldhami cuttings
2.2 扦插生根过程中可溶性糖和可溶性蛋白含量变化
由图2表明,绿竹插条生根过程中可溶性糖含量呈“下降-上升-下降”的变化趋势。在0 ~ 14 d,可溶性糖含量下降,在14 ~ 21 d,其含量升高,之后(21 d),其含量又降低。方差分析表明,不同生根时期可溶性糖含量差异显著(P< 0.05),说明可溶性糖含量与绿竹侧枝生根有密切联系。由图3表明,绿竹插条生根过程中可溶性蛋白含量呈“上升-下降-上升”的变化趋势。在0 ~ 21 d,可溶性蛋白含量持续上升,在第21 d时达到最高值,其中处理插条比扦插0 d可溶性蛋白含量增加了18.6%。21 d后开始下降,28 d后又有所上升。方差分析表明,不同生根时期可溶性蛋白含量差异不显著(P> 0.05)。
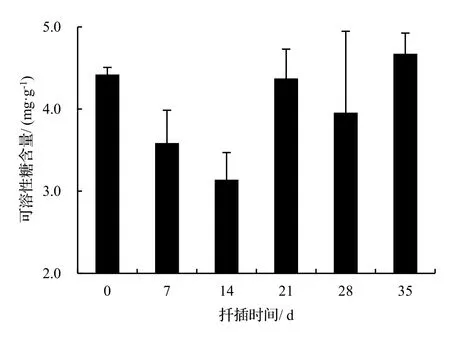
图2 扦插生根过程中可溶性糖含量变化Figure 2 Changes of soluble sugar content during rooting of D. oldhami cuttings
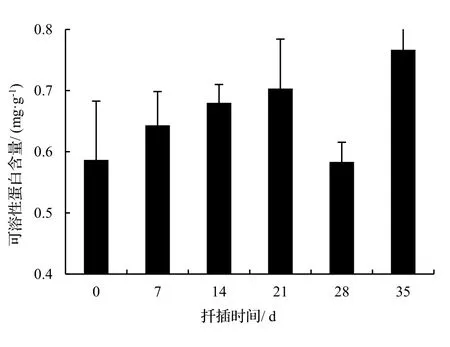
图3 扦插生根过程中可溶性蛋白含量变化Figure 3 Changes of soluble protein content during rooting of D. oldhami cuttings
2.3 扦插生根过程中氧化酶类变化
2.3.1 POD活性变化 由图4表明,在0 ~ 14 d,绿竹插条内POD活性持续上升,在14 d时达到第一个峰值,之后(14 ~ 21 d),POD活性降低,但21 d后,随着不定根的伸长和发育,其活性升高,并达到第2个峰值。2个峰值分别比扦插前POD含量增加了34.6%和29.15%。经方差分析,不同生根时期POD活性差异显著(P<0.05),说明POD活性变化与绿竹侧枝生根有密切联系。
2.3.2 IAAO活性变化 由图5表明,在0 ~ 21 d,绿竹插条内IAAO活性均呈持续上升趋势,之后(21 d)大幅度下降,与扦插前差异极显著(P< 0.01),IAAO活性高峰出现在不定根表达时期,其中处理插条比扦插前IAAO含量增加了412.6%。经方差分析,不同生根时期IAAO活性差异显著(P< 0.05),说明IAAO活性变化与绿竹侧枝生根有密切联系;不定根伸长时期14 ~ 28 d)和0 d处理时插条IAAO活性差异极显著(P< 0.01),说明ABT1号处理对IAAO活性扦插后期影响明显。

图4 扦插生根过程中POD活性变化Figure 4 Changes of POD activity during rooting of D. oldhami cuttings
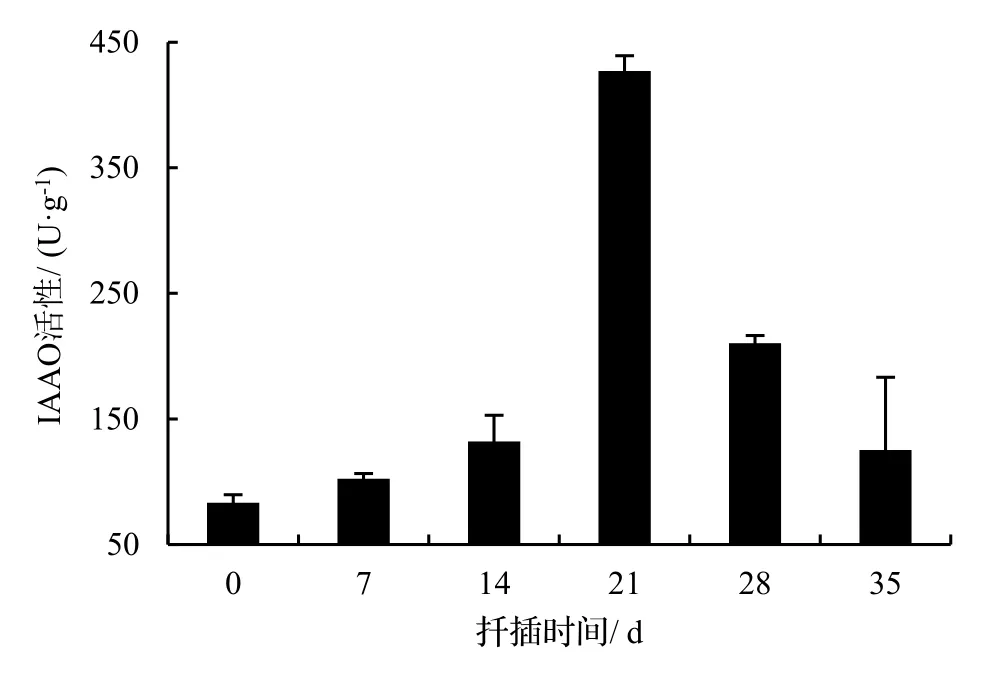
图5 扦插生根过程中IAAO活性变化Figure 5 Changes of IAAO activity during rooting of D. oldhami cuttings

图6 扦插生根过程中PPO活性变化Figure 6 Changes of PPO activity during rooting of D. oldhami cutttings
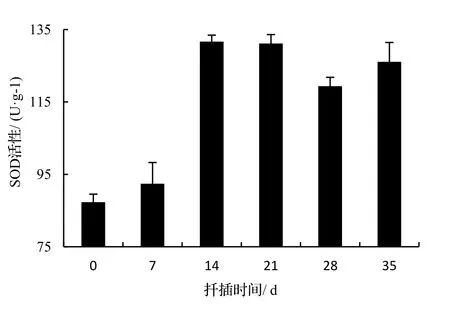
图7 扦插生根过程中SOD活性变化Figure 7 Changes of SOD activity during rooting of D. oldhami cuttings
2.3.3 PPO活性变化 由图6表明,在0 ~ 14 d,绿竹插条内PPO活性呈持续上升趋势,在14 d左右达到峰值,其中处理插条比扦插前PPO含量增加了111%。在14 ~ 21 d,活性下降,之后(21 d),略有上升。经方差分析,不同生根时期PPO活性差异显著(P< 0.05),说明PPO活性变化与绿竹侧枝生根有密切联系;不定根诱导时期(0 ~ 14 d)和0 d处理插条PPO活性差异极显著(P< 0.01),说明ABT1号处理对PPO活性扦插前期影响明显。
2.3.4 SOD活性变化 由图7表明,在0 ~ 14 d,SOD活性逐渐上升,活性增强。14 ~ 28 d时,不定根逐渐成形,SOD活性略有所下降,之后(28 d),SOD活性略上升。经方差分析,不同生根时期SOD活性差异极显著(P< 0.01),说明SOD活性变化是影响绿竹侧枝生根关键因子之一;所有处理时期插条SOD活性差异极显著(P< 0.01),说明ABT1号处理对SOD活性整个扦插时期影响明显。
3 结论与讨论
3.1 绿竹扦插生根特性
绿竹扦插生根属于潜伏不定根原基生根型,根据生根特点,以不定根的形成划分为诱导阶段(0 ~ 14 d)、表达阶段(14 ~ 21 d)和伸长阶段(21 ~ 35 d)3个阶段。插条基部能否生根是插条扦插成活的关键,有研究表明[11]插穗生根率达到50%上可应用于生产。ABT1号处理的绿竹插条生根率最高可达57.25%,这与金爱武[2]用ABT1号处理绿竹插条研究结果相近,与ABT1号在其它植物[12-13]扦插育苗中研究结果相似,但ABT1处理的绿竹插条生根率并不高,具体原因有待进一步研究。在扦插生根时期,可以适当补充营养物质,并做好水肥管理,从而可以提高生根效果,保证育苗存活率。
3.2 营养物质与插条生根的关系
插条生根和生长过程中需要消耗大量营养物质,其中主要是碳水化合物和氮素化合物,而可溶性糖是插条体内碳水化合物相互利用的主要物质,可溶性蛋白是生物体能够吸收利用的主要氮素化合物,营养物质的含量会直接影响生根过程的发生和进行。张忠微等[14]对金露梅Potentilla frutieosa嫩枝扦插研究表明插条内可溶性糖含量需达到一定的水平才能保证插条的生根。姜志强[15]对榉树Zelkova serrata扦插研究表明营养物质与榉树插穗生根关系密切,这些观点与本文研究一致。
绿竹插条内可溶性糖和可溶性蛋白含量变化的转折点与插条生根过程相联系,与扦插生根过程中不定根的生长时间相呼应。在不定根诱导阶段,绿竹插条进行细胞分裂,呼吸强度增大,代谢旺盛,需要消耗大量营养物质,可溶性糖含量急剧下降。在表达阶段,随着插条抽枝展叶,叶片不断合成光合产物及体内淀粉的降解,供给生根营养物质,可溶性糖含量升高。而可溶性蛋白含量在不定根诱导期和表达期逐渐增高,待到伸长期,可溶性蛋白含量大量被消耗用以产生不定根。在绿竹扦插生根过程中,可溶性糖含量总体呈现先下降后上升再下降的变化趋势,而可溶性蛋白则呈相反变化趋势,这与王新建等[16]和张鸽香等[17]的研究结果不同,但可溶性糖变化趋势与曾炳山等[18]对柚木Tectona grandis嫩枝扦插研究结果一致,说明可溶性糖和可溶性蛋白含量对插条生根的影响可能因植物不同而异。
3.3 氧化酶活性与插条生根的关系
PPO,POD,IAAO和SOD是目前学术界公认的在扦插过程中与插条生根关系最为密切的几种酶[19],绿竹的扦插生根过程与各类氧化酶类的活性变化密切相关。在不定根的萌发阶段,POD,PPO,IAAO及SOD活性升高,待生根以后,逆境状态逐渐消除,4个氧化酶活性开始下降,插条内IAA含量增加,高浓度的IAA促进了不定根的生长发育。氧化酶活性规律性变化与不定根形成各个阶段的形态发生密切相关,这与尹万元[20]研究结果一致。
POD是植物活性氧清除系统中重要的酶,具有维持活性氧自由基产生与清除系统平衡[21],参与IAA分解,调节插条内IAA含量等重要作用。在诱导时期,POD活性升高是生根能力的标志[22-23],同时降解IAA的能力增强,导致IAA的含量减少,促进根原基的发育和不定根的诱导。在表达时期,POD活性降低,IAA含量积累增多,促进不定根的生长。同时POD也是参与木质素合成的关键酶之一[24]。在不定根伸长时期,随着根的木质化,POD参与合成木质素,因此POD活性再次升高。POD活性在扦插过程中出现两个峰值,这与以往研究结果一致[25-26]。
PPO能够催化各种酚类氧化,其中催化后的酚类物质与IAA形成的“IAA-酚酸复合物”是不定根的生根辅助因子[27-28]。绿竹扦插初期,PPO活性逐渐增高,催化形成的“IAA-酚酸复合物”相应增多,有利于插条根原基的发育和不定根的诱导,促进不定根的形成,这与王瑞等[29]对油茶Camellia oleifera组培苗生根研究结论一致。待生根后,PPO活性开始下降,低活性的PPO能够减少IAA的消耗,IAA含量得到积累,促不定根伸长发育。
IAAO是分解IAA的专一性酶,能降解IAA,调节植物体内IAA水平,从而影响植物生长发育等生理过程[30]。绿竹在扦插初期,高活性的IAAO可以氧化IAA,减少插条内IAA含量,促进侧芽萌发,符合低浓度IAA有利于诱导生根的观点[31-34]。待不定根形成后,IAAO活性下降,低活性的IAAO能够减少IAA的消耗,增加插条内IAA的含量,促进不定根的伸长,这与扈红军等[35]用榛子Corylus heterophylla嫩枝扦插生根研究相关氧化酶活性变化的结果一致。IAAO和POD同为IAA分解代谢的关键酶,在IAA分解代谢过程中起着关键作用[36],但通过方差分析表明,不同生根时期之间IAAO活性比POD活性变化差异更为显著,说明在绿竹扦插生根过程中IAAO活性是调控插条IAA含量水平的关键因素。
SOD是氧自由基清除酶促防御系统中的重要成员,与植物抗氧化能力直接相关[37-38]。绿竹扦插初期,插条离开母株时,处于逆境生长,插条内部的营养物质和超氧阴离子大量积累,从而使SOD活性增强。待不定根逐渐成形,逆境状态逐渐缓和导致 SOD活性略有所下降,这一部分研究与赵云龙[39]对糙叶杜鹃Rhododendron scabrifoliumSOD活性变化趋势研究一致。
3.4 小结
综上所述,营养物质含量和各类氧化酶活性的变化与绿竹扦插生根相互联系,既能独立影响,又能共同作用,影响生根。通过ABT1号处理可以提高可溶性糖和可溶性蛋白含量,调节各类氧化酶活性,促进生根,说明ABT1号处理可以提高绿竹扦插生根效果,可为绿竹及其它丛生竹类扦插生产提供技术支持和理论依据。
参考文献:
[1] 孙中元,马艳军,高健. 慈竹竹枝扦插及埋节育苗技术[J]. 东北林业大学学报,2013(09):14-18.
[2] 金爱武,方伟,余学军,等. ABT生根粉处理绿竹、吊丝单竹主枝扦插试验[J]. 林业科技开发,2001,15(04):31-33.
[3] 张光楚,陈富枢,杨爱国. 丛生竹次生枝的扦插繁殖[J]. 西南林业大学学报:自然科学,1994,(3):137-143.
[4] 唐廷贵. 麻竹扦插繁育技术研究[J]. 四川林勘设计,2003(03):24-28.
[5] 杨长职. 绿竹侧枝扦插育苗技术的研究[J]. 竹子研究汇刊,1994(3):44-48.
[6] 黄锋,刘旭光,宋滔滔. 绿竹扦插育苗技术[J]. 林业工程学报,2003,17(4):42-43.
[7] 余学军,林德芳,吴寿国,等. 绿竹快速育苗技术比较[J]. 浙江林学院学报,2005,22(2):235-237.
[8] 高俊凤. 植物生理学[M]. 北京:高等教育出版社,2006:142,144.
[9] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,1999:195.
[10] 张志良,瞿伟菁,李小芳. 植物生理学实验指导[M]. 北京:高等教育出版社,2009:155.
[11] 郭英超. 兴安圆柏扦插繁殖技术及插穗生根生理基础的研究[D]. 保定:河北农业大学,2007:9.
[12] 王宏信. ABT1处理对降香黄檀硬枝扦插生根及其关联酶活性的影响[J]. 江苏农业科学,2017,45(8):138-141.
[13] 欧滨,洪仁辉,林旭俊,等. ABT1在南方红豆杉扦插育苗中的作用研究[J]. 热带林业,2017,45(1):25-27.
[14] 张忠微,石素霞,张彦广,等. 金露梅嫩枝插穗生根过程中营养物质含量变化研究[J]. 河北农业大学学报,2008,31(4):56-59.
[15] 姜志强. 榉树扦插繁殖技术与生根机理的研究[D]. 南京:南京林业大学,2008,2016:47-48.
[16] 王新建,何威,张秋娟,等. 豫楸1号扦插生根过程中营养物质含量及氧化酶类活性的变化[J]. 林业科学,2009,45(4):156-161.
[17] 张鸽香,彭立毛. IBA处理对紫薇扦插中营养物质及抗氧化酶活性变化的影响[J]. 安徽农业大学学报,2016,43(5):733-736.
[18] 曾炳山,黄永芳,杨懋勋,等. 柚木嫩枝扦插生根过程中营养物质的研究[J]. 中南林业科技大学学报,2013,33(2):1-4.
[19] 姚旺. 两种丛生竹的侧枝扦插技术及生根机理研究[D]. 福州:福建农林大学,2016:6.
[20] 尹万元. 光叶榉扦插繁殖技术及生根过程中生理变化[D]. 泰安:山东农业大学,2016:41-42.
[21] 裴斌,张光灿,张淑勇,等. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J]. 生态学报,2013,33(5):1386-1396.
[22] MONCOUSIN C H,GASOAR T. Peroxidase as a marker for rooting improvement in Cynara scolymus L. Cultivated in vitro[J]. Biochem Physiol Pflanz,1983,178:263-271.
[23] HAISSIG B E. Influences of auxins and suxin synergists on adventitious root primordium initiation and development[J]. N Z J For Sci,1974,4:311-323.
[24] 卢善发,宋艳茹. 维管组织分化的分子生物学研究[J]. 植物学通报,1999,16(3):219-227.
[25] HAISSIF B E. Metabolic processes in adventitious rooting of cuttings[A]. Berlin:Springer Netherlands,1986,20:141-189.
[26] GEBHARDT K. Activation of indole-3-actic acid oxidase from horseradish and prunus by phenols and hydrogen peroxide[J]. Plant Grow Regul,1982,1(2):73-84.
[27] MERGRE D,DOKANE K,KONDRATOVICS U. Can changes in starch content and peroxidase activity be used as rooting phase markers for rhododendron leaf bud cuttings [J]. Acta Biol Cracov,2011,53(1):74-79.
[28] 李明,黄卓烈,谭绍满. 难易生根按树多酚氧化酶,吲哚乙酸氧化酶活性及其同工酶的比较研究[J]. 林业科学研究,2000,13(5):493-500.
[29] 王瑞,陈永忠,王湘南,等. 油茶组培苗生根过程中生理生化指标的变化[J]. 经济林研究,2015,33(2):68-72.
[30] 王小玲,赵忠,权金娥. 外源激素对四倍体刺槐硬枝扦插生根及其关联酶活性的影响[J]. 西北植物学报,2011,31(1):116-122.
[31] 宋金耀,何文林,李松波,等. 毛白杨嵌合体扦插生根相关理化特性分析[J]. 林业科学,2001,37(5):64-67.
[32] CALDERSON-BALTIERRA X V. Changes in peroxidase activity during root formation in Eucalyptus globulus shoots raised in vitro [J]. Plant Perox Newsl,1994(4):27-29.
[33] MONCOSIN C H,GASPAR T. Peroxidase as a marker for rooting improvement in Cynara scolymus L. cultivated in vitro[J]. Biochemphysiol Pflanz,1983,178(4):263-271.
[34] PACHECO P,BALTIETTA X C,VEGA A. Flavonoids as regulators and markers of root formation by shoots of Eucalyptus globulus raises in vitro[J]. Plant Perox Newsl,1995(5):9-12.
[35] 扈红军,曹帮华,尹伟伦. 榛子嫩枝扦插生根相关氧化酶活性变化及繁殖技术[J]. 林业科学,2008,44(06):60-65.
[36] 原牡丹,侯智霞,翟明普,等. IAA分解代谢相关酶(IAAO、POD)的研究进展[J]. 中国农学通报,2008,24(8):88-92.
[37] SAITAM R K,SAXENA D C. Oxidative stress and antioxidants in wheat genotypes: possible mechanism of water stress tolerance[J]. J Agronom Crop Sci,2000,184(1):55-61.
[38] 刘明鲁,孙磊,张晓峰. 桑树硬枝扦插生根过程中相关生理生化指标的动态分析[J]. 中国蚕业,2011,32(4):9-14.
[39] 赵云龙,陈训,李朝婵. 糙叶杜鹃扦插生根过程中生理生化分析[J]. 林业科学,2013,49(6):45-51.

