临床药师参与关节炎患者应用NSAIDs治疗的回顾性分析
丁淑萍 高荣 于晓阳
NSAIDs是指一类通过抑制环氧合酶 (cyclooxygenase, COX),阻断花生四烯酸(arachidonic acid, AA)代谢, 减少前列腺素(prostaglandin, PG)生成来发挥抗炎镇痛作用的非类固醇药物, 在临床上广泛用于骨关节炎、类风湿性关节炎、炎性疾病及多种发热和各种疼痛症状的缓解[1]。长期大剂量使用NSAIDs可导致胃肠道、肝脏、肾脏、血液系统损害、心血管不良反应、过敏反应等副作用, 接受NSAIDs治疗的患者中, 71%的患者有小肠黏膜受损[2]。本院临床药师参与患者临床药物治疗时发现, 目前针对骨关节炎和类风湿性关节炎需要长期服用NSAIDs的患者, 临床通常采用两种治疗方案,一种是使用洛索洛芬联合雷贝拉唑;另一种是使用塞来昔布。为验证两种方案的安全性, 为临床治疗药物选择提供依据,作者进行了如下研究。
1 资料与方法
1.1 一般资料 查阅某三甲医院2015年1~10月应用塞来昔布或洛索洛芬联合雷贝拉唑进行抗炎治疗的267例骨关节炎和类风湿性关节炎患者病历。其中应用塞来昔布治疗的患者122例, 应用洛索洛芬联合雷贝拉唑治疗的患者145例。
1.2 筛选标准
1.2.1 入组标准 ①诊断为骨关节炎或类风湿性关节炎并且定期使用NSAIDs治疗的患者。②年龄≥60岁并且没有胃十二指肠溃疡史和胃肠道出血的患者。③年龄18~59岁,有胃十二指肠溃疡但胃肠道出血史>90 d的患者。④已经确定消除幽门螺杆菌感染或幽门螺杆菌测试阴性的患者。
1.2.2 排除标准 ①同时使用抗血小板或抗凝药物的患者。②患有缺血性心脏病、心脏衰竭、外周动脉疾病、脑血管疾病、胃肠道出血的患者。③患有全身胃肠道疾病、腐蚀性食管炎、胃幽门梗阻、<90 d的活跃的胃十二指肠溃疡患者。④有酒精和药物滥用史的患者。⑤对洛索洛芬过敏的患者。⑥血清丙氨酸转氨酶和天冬氨酸转氨酶浓度超过正常上限1.5倍的患者。⑦血清肌酐浓度超过正常上限1.2倍的患者。⑧研究期间除了使用NSAIDs或抗溃疡的药物外, 还使用了细胞毒性药物、锂、铁补充剂的患者。⑨任何使用其他药物低于80%或高于120%标准剂量的患者。
1.3 方法和步骤 按照“1.2”项的标准对267例患者进行筛选, 排除162例不符合标准和1例因肺部严重感染而死亡男性患者后, 第2次筛选再次排除了1例因出现腹泻停用塞来昔布, 1例因出现过敏症状停用洛索洛芬和2例因使用洛索洛芬疼痛不能缓解改用美洛昔康, 共4例早期停药患者。通过筛选的患者中, 最终应用塞来昔布的实验组51例, 应用洛索洛芬联合雷贝拉唑的对照组49例。见图1。筛选入组的实验组与对照组患者性别、年龄、病程及用药时间等一般资料比较, 差异均无统计学意义(P>0.05)。见表1。
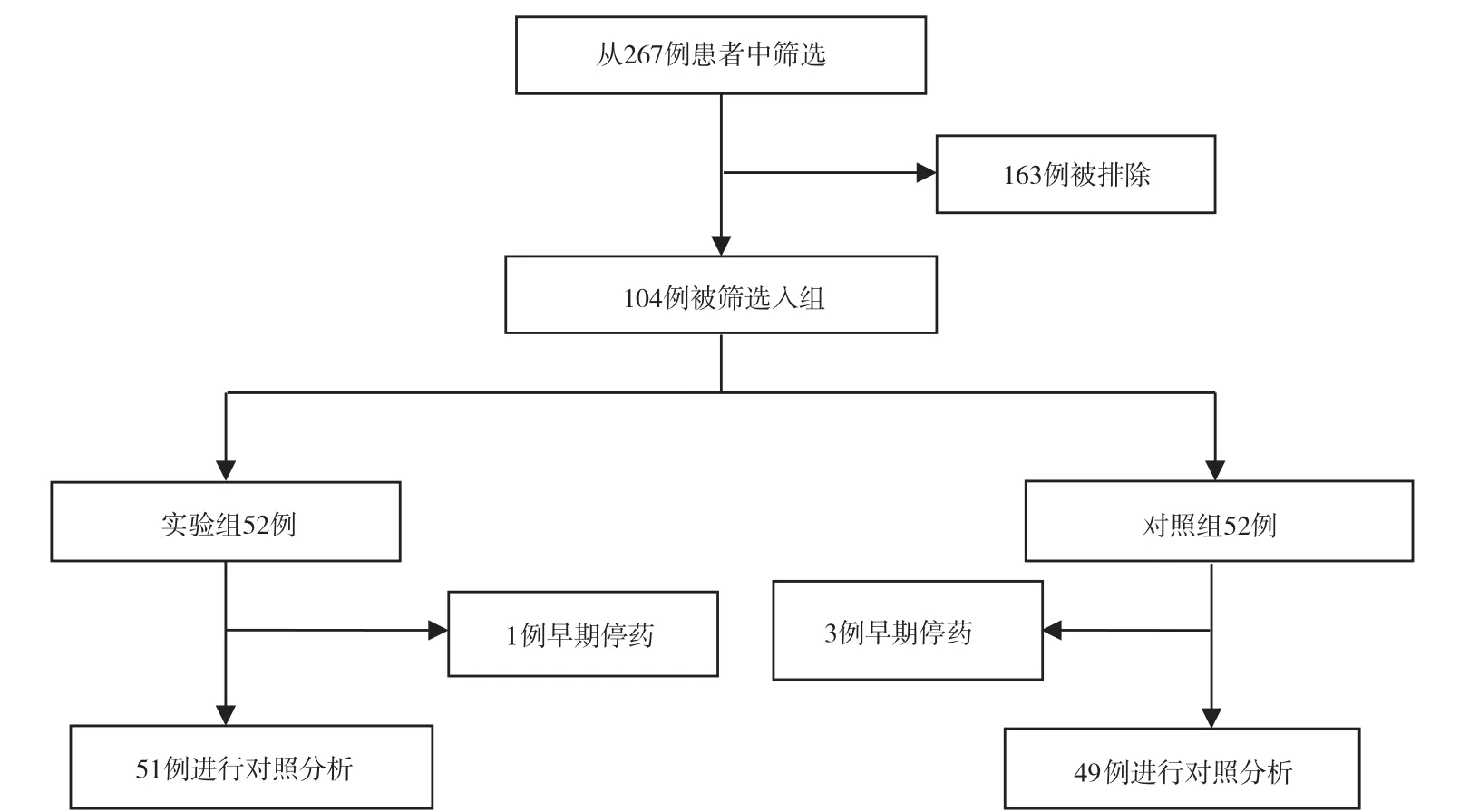
图1 患者入组筛选流程图
表1 筛选入组的两组患者一般资料比较

表1 筛选入组的两组患者一般资料比较
注:与对照组比较, aP>0.05
指标 实验组(n=52) 对照组(n=52)性别 (男/女) 15/37a 9/43平均年龄(岁) 64.6±10.5a 61.7±11.8平均病程(年) 7.04±7.34a 7.81±6.48平均用药时间(d) 10±3a 9±3
提取两组患者的实验室检验结果和病历信息, 对两组患者的既往消化性溃疡病史、心血管病史及Hb(hemoglobin)水平等方面进行对照分析。重点关注临床上发生在整个胃肠道的明显不良反应[3], 对重度贫血的判定是Hb下降值≥20 g/L,或者血细胞压积降低至少10个百分点[4]。筛选入组的两组患者合并症情况比较差异无统计学意义(P>0.05)。见表2。

表2 筛选入组的两组患者合并症分析(n)
1.4 观察指标及评定标准 观察两组不良反应(Hb降低、DVT/PE发生风险、肌酐升高、心血管不良反应、其他等)发生情况, DVT/PE风险通过Wells等建立的加拿大评分系统预测法评定[5]。
1.5 统计学方法 采用SPSS18.0统计学软件对研究数据进行分析处理。计量资料以均数±标准差表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
整理研究记录发现, 最终实验组有10例患者出现Hb下降(1例下降至标准值以下), 其中下降值在1~5 g/L的患者有4例;6~10 g/L的患者有3例;11~20 g/L的患者有3例。对照组有17例患者出现Hb下降(有4例下降至标准值以下),其中下降值在1~5 g/L的患者有7例;6~10 g/L的患者有5例;11~20 g/L的患者有3例且全部超过15 g/L;Hb下降20 g/L或更多的患者有2例, 均在对照组。有36例患者被认定存在DVT/PE风险, 其中实验组有21例, 对照组有15例。对照组出现了2例肌酐升高的患者, 升高值分别为9 mol/L和14 mol/L。出现心血管不良反应事件的有7例, 实验组有2例(1例为突发心前区疼痛, 1例为心律失常), 对照组有5例(2例为窦性心律不齐, 3例为心律失常)。其他不良反应实验组有3例(包括1例腹痛), 对照组有6例(包括2例轻度贫血)。实验组Hb降低、肌酐升高、心血管不良反应、其他不良反应比例均低于对照组, DVT/PE发生风险比例高于对照组, 但两组比较差异均无统计学意义(P>0.05)。见表3。

表3 两组不良反应发生率比较(%)
3 讨论
NSAIDs具有消炎、止痛、抗凝等作用, 临床应用广泛。随着其在临床的大量应用, 胃肠道副作用日益凸显, 包括引起NSAIDs相关性溃疡以及溃疡出血, 甚至威胁服药者的生命安全[6]。因此, NSAIDs致胃肠黏膜损伤的不良反应越来越引起医学界的重视。NSAIDs对胃肠黏膜的损伤机制可能与其可抑制环氧化酶(COX)-1的活性, 减少黏膜前列腺素的合成, 导致胃黏膜屏障变薄[7,8]和血小板功能下降, 使黏膜对胃酸、胆盐和消化酶损伤的易感性增加有关。同时血栓素A2的生成减少, 血小板的聚集功能下降, 出血时间延长, 也易引起黏膜受损出血[9]。除上述因素外, 原有消化性溃疡、饮酒、吸烟(抑制前列腺素和碳酸氢盐分泌)、饮咖啡(诱导盐酸分泌)和酸性饮料(降低pH)、同时使用皮质激素或用华法林抗凝者均是导致NSAIDs诱发消化道出血的危险因素[10]。
有临床研究表明, 既往有消化性溃疡史的患者服用NSAIDs出现溃疡不良反应的几率增加[11], 但既往消化道溃疡或出血史在两组出血患者中比较差异无统计学意义(P>0.05)。这可能与明确有溃疡病史的患者往往慎用NSAIDs,由于NSAIDs的强力镇痛作用, NSAIDs诱发的上消化道溃疡或出血常为无痛性, 消化道症状不明显, 多以严重出血为首发症状, 使得许多溃疡早期并未诊断等原因有关[12]。粪便检验是检验工作中比较普遍的一个项目, 在消化道恶性肿瘤的筛选以及慢性消化道出血的临床诊断中可以发挥重要作用[13]。但在本次查找病例过程中发现有很多患者没有进行粪便隐血试验, 极易发生漏诊。相关资料统计结果显示, 外观性状正常粪便的隐血阳性率有时甚至会超过常规检测阳性率, 原因在于消化道溃疡或者出血患者早期并不会出现明显症状, 但是消化性溃疡活动后粪便就会随之发生病理改变,粪便外观以及形状对于阳性的检出没有太大影响[14]。因此,为了避免长期服用NSAIDs的患者消化道溃疡或出血的漏诊、误诊情况的出现, 临床进行隐血试验是十分必要的。
在患有骨性关节炎或类风湿性关节炎且未使用抗血小板和抗凝药物的患者群体中, 服用NSAIDs发生胃肠道的不良反应主要体现在隐秘的胃肠道失血, 上消化道隐秘出血可引起患者Hb的大幅降低。本研究数据显示, 应用洛索洛芬联合雷贝拉唑的患者发生Hb降低的几率远远超过应用塞来昔布的患者, 该结果证实了研究前预测的患者胃肠道风险的假设。但该研究纳入的病例数量有限, 导致研究结果有一定的局限性, 临床应用NSAIDs时应结合患者实际情况, 选择个体化的治疗方案。对照组有肌酐升高的情况, 在心血管不良反应方面多于实验组。以上回顾性分析表明, 临床在治疗骨性关节炎或类风湿性关节炎时, 与应用洛索洛芬联合雷贝拉唑相比, 应用塞来昔布的不良反应发生率相对较低, 安全性更高。
临床药师作为医疗工作中治疗团队成员之一, 拥有扎实的药学专业知识, 具有一定的临床专业知识与技能, 直接参与临床用药, 发现、解决、预防潜在的或实际存在的用药问题,在工作中应坚持发挥药学专业技术在药物治疗中的作用。临床药师在查房过程中应及时全面地掌握患者的疾病信息和治疗情况, 如有需要可根据本院患者情况查阅资料, 进行回顾性分析, 为临床药物选择提供证据支持, 与医师、护士等共同保护患者用药权益, 促进药物合理使用, 保障药物在临床使用过程中安全、有效、经济。
[1] 罗剑刚, 李慧, 杨聪娴.COX-2选择性抑制剂治疗疼痛的研究进展.中国疼痛医学杂志, 2012, 18(2):66-69.
[2] 朱剑, 黄烽.客观评价与量化使用非甾体消炎药的新工具:非甾体消炎药评分系统.中华内科杂志, 2013, 52(4):282-284.
[3] Chan FK, Cryer BJ.A novel composite endpoint to evaluate the gastrointestinal (GI) effects of nonsteroidal antiinflammatory drugs through the entire GI tract.Journal of Rheumatology, 2010, 37(1):167-174.
[4] Chan FK, Lanas A, Scheiman J, et al.Celecoxib versus omeprazole and diclofenac in patients with osteoarthritis and rheumatoid arthritis(CONDOR): a randomised trial.Lancet, 2010, 376(9736):173-179.
[5] 吴庆华, 杨耀国.深静脉血栓形成和肺栓塞的诊治路径.中国实用外科杂志, 2010(12):995-998.
[6] Ahsberg K, Höglund P, Kim WH, et al.Impact of aspirin, NSAIDs,warfarin, corticosteroids and SSRIs on the site and outcome of non-variceal upper and lower gastrointestinal bleeding.Scand J Gastroenterol, 2010, 45(12):1404-1415.
[7] Takeuchi K.Pathogenesis of NSAID-induced gastric damage:importance of cyclooxygenaseinhibition and gastric hypermotility.World J Gastroentero, 2012, 18(18):2147-2160.
[8] Nema H, Kato M.Investigation of gastroduodenal mucosal injuries caused by low-dose aspirin therapy in patients with cerebral infarction.Journal of Gastroenterology & Hepatology, 2010, 25 Suppl 1(Supplement s1):S119.
[9] 黄宝强.浅谈非甾体类抗炎药对胃黏膜的损伤及防治.中国医药指南, 2010, 8(21):151-152.
[10] 江小云.非甾体类抗炎药致胃肠道黏膜损害的临床特点.临床和实验医学杂志, 2011, 10(10):739-740.
[11] 吴松兵, 李松长, 黄永华.非甾体抗炎药相关性上消化道出血的危险因素分析.当代医学, 2012, 18(19):116-117.
[12] 谭丽蓉, 刘代华, 喻珊珊, 等.非甾体抗炎药相关消化性溃疡出血患者的临床特点及药学监护.中国药房, 2015(14):1988-1990.
[13] 郭江梅, 邹灵丽, 杨志芳, 等.1532例粪便常规检查和801例隐血试验结果的分析.检验医学, 2009, 24(12):944.
[14] 段彩萍.粪便常规检查和隐血试验结果的分析.大家健康(学术版), 2014(19):157-158.

